ИЗУЧЕНИЕ НЕЙРОГЕННЫХ АРИТМИЙ СЕРДЦА ПРИ ФОКАЛЬНОЙ ЭПИЛЕПСИИ У КРЫС В ЭКСПЕРИМЕНТЕ
DOI: https://doi.org/10.23670/IRJ.2022.118.4.080
ИЗУЧЕНИЕ НЕЙРОГЕННЫХ АРИТМИЙ СЕРДЦА ПРИ ФОКАЛЬНОЙ ЭПИЛЕПСИИ У КРЫС В ЭКСПЕРИМЕНТЕ
Научная статья
Вечканова Н.А.1, *, Мельникова Н.А.2, Белова О.А.3, Прокофьев Д.А.4,Сорокина О.А.5, Алиев А.Г.6, Новикова А.И.7, Гройсман П.С.8, Чалдаева А.Н.9, Евинова М.В.10, Горохова М.А.11
1- 11Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва, Саранск, Россия
*Корреспондирующий автор (doctordmk[at]mail.ru)
Аннотация
Одновременное наблюдение как за электрической активностью нейронов головного мозга, так и за электрической активностью сердца позволило установить временную корреляцию между частотой спонтанных импульсов нейронов и электрической активностью сердца. Эксперименты выполнены на 30 беспородных крысах обоего пола с массой тела 280-405г. Регрессионный анализ временных корреляций между эпилептической активностью и аритмиями показал, что ЭЭГ-паттерны и пароксизмальная активность имеют линейную корреляцию во время межприступной и иктальной активности. Начиная с момента начала эксперимента и до 120 минуты наблюдалась параллельная тенденция переменной пароксизмальной электроэнцефалографической активности и аритмической активности (r = 0,856 и r = 0,642, соответственно), что свидетельствовало о нарастании аритмической активности, прямо пропорциональной эпилептической активности.
Ключевые слова: фокальная эпилепсия, аритмии, ЭЭГ, ЭКГ.
A STUDY OF NEUROGENIC CARDIAC ARRHYTHMIAS IN FOCAL EPILEPSY IN RATS IN AN EXPERIMENT
Research article
Vechkanova N.A.1, *, Melnikova N.A.2, Belova O.A.3, Prokofyev D.A.4,Sorokina O.A.5, Aliev A.G.6, Novikova A.I.7Groysman P.S.8, Chaldaeva A.N.9, Evinova M.V.10, Gorokhova M.A.11
1, 2, 3. 4. 5,6. 7, 8. 9, 10, 11 N.P. Ogarev National Research Mordovian State University, Saransk, Russia
*Corresponding author (doctordmk[at]mail.ru)
Abstract
Simultaneous observation of both the electrical activity of brain neurons and the electrical activity of the heart made it possible to establish a temporal correlation between the frequency of spontaneous impulses of neurons and the electrical activity of the heart. The experiments were performed on 30 outbred rats of both sexes with a body weight of 280-405g. A regression analysis of temporal correlations between epileptic activity and arrhythmias showed that EEG patterns and paroxysmal activity have a linear correlation during intercalative and ictal activity. Starting from the beginning of the experiment and up to 120 minutes, there was a parallel trend of variable paroxysmal electroencephalographic activity and arrhythmic activity (r = 0.856 and r = 0.642, respectively), which indicated an increase in arrhythmic activity directly proportional to epileptic activity.
Keywords: focal epilepsy, arrhythmias, EEG, ECG.
Актуальность
По данным статистики около 70 млн. человек во всем мире страдают эпилепсией. По приблизительной оценке, экспертов ВОЗ, у 65-70% людей с подтвержденным диагнозом - эпилепсия, приступы могут не проявляться клинически, лишь при условии своевременной и доступной диагностики и полноценного лечения, тем не менее, почти у 1 000 000 пациентов эпилептические приступы сохраняются на протяжении всей жизни [1], [2]. Достоверно известно, что распространенность сердечно-сосудистых заболеваний статистически значимо в 2,5 раза выше у пациентов с эпилепсией, в сравнении с общей популяцией.
Нарушения ритма у больных эпилепсией имеют нейрогенное происхождение [3]. Они способны вызвать серьезные гемодинамические изменения, в свою очередь нарушения сердечного ритма могут трансформироваться в жизнеугрожающие аритмии, и привести к внезапной сердечной смерти. Внезапная сердечная смерть наступает у 6-30% больных эпилепсией. Достоверно известно, что внезапная сердечная смерть у больных эпилепсией часто происходит во сне. Поскольку сон является мощным активатором пароксизмальной электроэнцефалографической активности у больных эпилепсией, эта активация в сочетании с неадекватным уровнем противосудорожных и антиаритмических препаратов в крови может привести к смерти. Аритмии, возникшие на фоне эпилептиформных разрядов в головном мозге, могут представлять собой триггерный фактор, который инициирует фатальные события. Анализ типов аритмий, возникающих у больных эпилепсией, безусловно представляет терапевтическую ценность, чем и обусловлена актуальность данной статьи.
Материалы и методы исследования
Эксперименты выполнены на 30 беспородных крысах обоего пола с массой тела 280-405г. Все манипуляции с животными проводились в соответствии с Руководством по содержанию и использованию лабораторных животных [4]. Животным проводилось анестезиологическое пособие, включающее интраперитонеальное введение препаратов: «Золетил 100» и «Ксилазин» по стандартной методике [5]. Производилась респираторная поддержка. Температуру тела постоянно контролировали и поддерживали на уровне 36,8± 1,5°С с помощью грелки. Наркотизированных животных фиксировали в стереотаксической установке, выполняли краниоэктомию для обнажения полушарий головного мозга, эпилептогенный очаг создавался аппликацией порошка металлического кобальта на поверхность сенсомоторной области коры левого полушария мозга крыс по стандартной методике. Преимуществом данной экспериментальной модели фокальной эпилепсии, является то, что она позволяет вызывать воспроизводимые нарушения ритма сердца. На аппаратном комплексе «BIOPAC» регистрировалось АД, ЧСС, ЭКГ, ЭЭГ, проводилось измерение температуры, а также измерение парциального давления кислорода (Р02), углекислого газа (РС02), рН в соответствии со стандартными методиками [6]. В ходе эксперименты оценивалась активность эпилептогенных очагов. Для статистической обработки данных, полученных в ходе эксперимента, использовался пакет программ «Statistica 6.0» с применением метода корреляционно-регрессионного анализа. Данные принимались за статистически значимые при р<0,05.
Результаты и их обсуждение
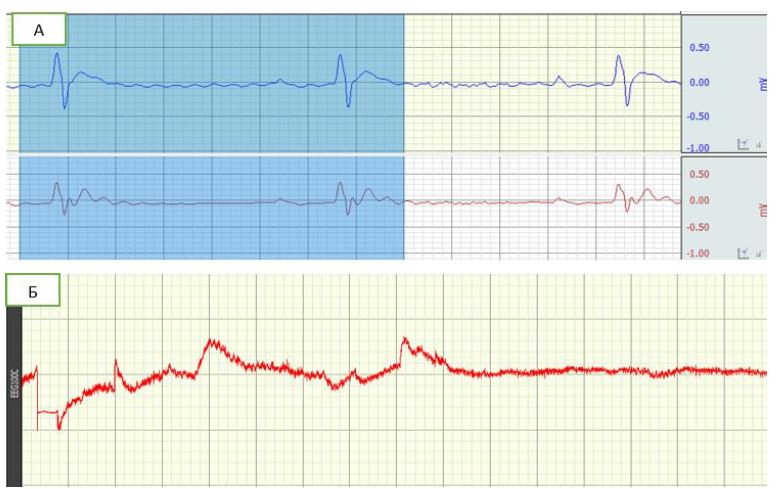
Наркотизированным животным проводилась респираторная поддержка, PCO2 и PO2 (М±m) составили: 39,3±2,76 мм.рт.ст и 112±8,87 мм.рт.ст, соответственно, рН 7,43 ±0,03. Одновременное наблюдение как за электрической активностью нейронов головного мозга, так и за электрической активностью сердца позволило установить временную корреляцию между частотой спонтанных импульсов нейронов и электрической активностью сердца. Через 35 минут после аппликации порошка металлического кобальта на поверхность сенсомоторной области коры левого полушария зафиксирована межприступная эпилептиформная активность, характеризующаяся одиночными вспышками (каждая длительностью 80—120 миллисекунд). Нарушения ритма и проводимости, прежде всего характеризовались эпизодами брадиаритмии с коротким латентным периодом (каждый продолжительностью 0,5–2 секунд) (рис. 1).
Рис.1 – Электрическая активность сердца(А) и электрическая активность нейронов головного мозга (Б) крыс после аппликации порошка металлического кобальта на поверхность сенсомоторной области коры левого полушария
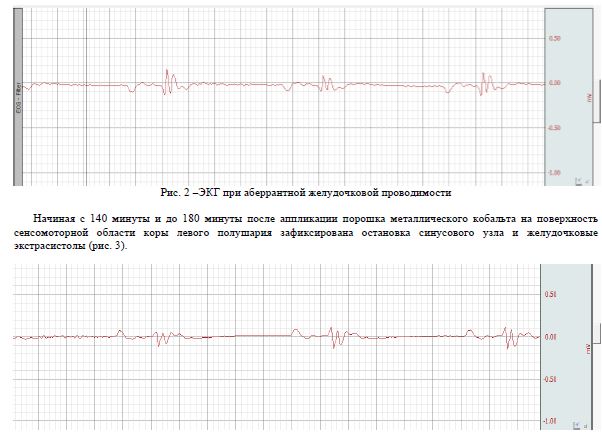
Одиночные ЭЭГ-паттерны вызывали кратковременные эпизоды аритмии. Спустя 120 минут после аппликации отмечались длительные периоды пароксизмальной активности (каждый продолжительностью 1—1,5 минуты). Зафиксированная нами пароксизмальная активность инициировала в свою очередь появление последующих коротколатентных брадиаритмических эпизодов (продолжительностью 0,9-6 секунд каждый). После прекращения пароксизмальной активности ритм вновь становился правильным, а нарушения проводимости нивелировались, что касается взаимных отношений между эпилептическим очагом и нарушениями ритма сердца во время как межприступной, так и иктальной активности, эпизоды аритмий не влияли на синхронность и синфазность эпилептической активности. Ритм сердца у всех исследуемых животных становился правильным после затухания эпилептической активности, а эпилептическая активность всегда предшествовала аритмической активности (рис. 1). Анализ ЭКГ показал, что межприступная активность с одиночными вспышками низкой частоты вызывала появление эпизодов дисфункции синусового узла (0,5-2 секунд каждый). Во время иктальной пароксизмальной активности эпизоды синусовой брадиаритми длились статистически значимо дольше, и с пропорционально большей частотой. Наджелудочковые экстрасистолы и аберрантная желудочковая проводимость наблюдались в 5% случаев (рис. 2).
Рис.3 – ЭКГ при остановке синусового узла и единичных желудочковых экстрасистолах
Во всех случаях, спустя 180 минут после затухания эпилептического очага, а также в конце иктального периода в 100% случаев зарегистрировано восстановление правильного сердечного ритма. Непрерывный мониторинг электрической активности сердца позволил также проанализировать среднюю частоту сердечных сокращений и средний интервала R-R. Иктальная эпилептическая активность вызвала выраженную брадиаритмию, особенно в интервале с 120 минуты по 180 минуты с момента аппликации порошка металлического кобальта. Средняя частота сердечных сокращений (М±m) статистически значимо снижалась с 345,65±51,96 до 180,42±68,11 ударов в минуту (р<0,05), но стоит отметить, что брадикардия была обусловлена увеличением частоты аритмических эпизодов с последующим удлинением интервалов R-R. Электрическая активность нейронов и артериальное давление (зафиксированные одновременно) показали, что эпилептиформная активность в межприступный период увеличивает интервал между сфигмическими периодами сокращения сердца при статистически значимом снижении диастолического давления, которое постепенно возвращается к базовому уровню. Поскольку систолическое давление оставалось на базовом уровне, снижение диастолического давления приводило к увеличению среднего артериального давления. Во время иктальной эпилептической активности систолическое и диастолическое давление статистически значимо снижалось с 120,35± 3,32 и 85,75±2,12 мм. рт. ст. до 100,19±3,09 и 65±6,89 мм. рт. ст. соответственно (p<0,05). Когда иктальный эпизод закончился, системное давление вернулось к базовому уровню.
Регрессионный анализ временных корреляций между эпилептической активностью и аритмиями показал, что ЭЭГ-паттерны и пароксизмальная активность имеют линейную корреляцию во время межприступной и иктальной активности. Начиная с момента начала эксперимента и до 120 минуты наблюдалась параллельная тенденция переменной пароксизмальной электроэнцефалографической активности и аритмической активности (r = 0,856 и r = 0,642, соответственно), что свидетельствовало о нарастании аритмической активности, прямо пропорциональной эпилептической активности. Во время иктальной активности (с 120 до 180 минуты) аритмическая активность возрастала по отношению к эпилептической активности, но не с односторонней стохастической зависимостью (r = 0,48 и rx ~ 0,24), что свидетельствует об ограничении брадиаритмического влияния эпилептиформного очага.
По результатам нашего эксперимента можно предположить, что выявленные в ходе эксперименты синусовые брадиаритмии, прямо пропорциональны длительности эпилептиформных пароксизмов. Иктальная активность могла спровоцировать кратковременную остановку синусового узла и желудочковые экстрасистолы, которые нивелировались при прекращении пароксизмальной активности.
Никаких других ЭКГ-паттернов в ходе нашего эксперимента, чем те, которые были описаны ранее, не наблюдалось, кроме 10% животных от общего числа, исключенных из оценки результатов. У этих животных показатели PCO2, PO2, рН статистически значимо отличались от базового уровня, и данные животные не были включены, во избежание недостоверного установления нейрогенного генеза аритмий. У этих животных метаболические нарушения инициировали появление тахикардии, стойкой остановки синусового узла, нарушение реполяризации, ишемического поражения сердца, атриовентрикулярной блокады II-III степени, фибрилляции желудочков и смерти. Можно предположить, что при отсутствии респираторной поддержки и возможных метаболических осложнениях у экспериментальных животных могли бы возникнуть более серьезные брадиаритмии, чем наблюдаемые в настоящем эксперименте.
Эпилептическая активность инициировала брадиаритмию, которая приводила к удлинению интервала R-R, и диастолы с последующим выраженным снижением диастолического давления, которое постепенно возвращалось к базовому значению. Вероятно, помимо брадиаритмического эффекта, эпилептиформный очаг влиял и на системную гемодинамику за счет снижения периферического сопротивления и, следовательно, диастолического давления. Поскольку систолическое давление сохранялось на базовом уровне, возможно, что удлинение диастолы способствовало увеличению преднагрузки, которая затем могла вызвать увеличение сердечного выброса с целью устранения нейрогеннообусловленного снижения сократительной способности сердца (выявлено повышение артериального давления, а, следовательно, и увеличение среднего давления, так как этот компенсаторный механизм мог обеспечить достаточный сердечный выброс во время межприступной активности).
Баланс между симпатическими и парасимпатическими влияниями посредствам реализации хронотропных и инотропных эффектов на сердечно-сосудистую систему, а в частности на миокард, обуславливает сердечный гомеостаз. Нарушения этого баланса приводят к изменению функциональных возможностей сердца. В ряде экспериментов по оценке глобальной и региональной симпатической активности было показано, что при локализации эпилептогенного очага в сенсомоторной области фиксируется снижение захвата радиофармпрепарата в сравнении с интактными животными [7], [8], что безусловно, указывает на десинхроноз симпатической иннервации. Десинхроноз симпатической иннервации сердца зачастую сопровождается повышением чувствительности β-адренергических рецепторов к адренергическим влияниям, и как следствие, отмечается повышенная аритмогенная активность при взаимодействии с катехоламинами. По мере распространения эпилептической активности от первичного очага и вовлечения структур головного мозга начинают появляться перииктальные кардио-феномены. Во время эпилептических припадков высвобождаемые надпочечниками катехоламины могут существенно влиять на сердечный ответ. Увеличение титров катехоламинов в плазме зачастую сопровождается дилатацией миокарда желудочков со снижением глобальной сократимости и формированием стресс-индуцированной кардиомиопатии [10].
Учитывая латентность кардиального и гемодинамического ответа, можно резюмировать, что во время пароксизмальной активности нейронов головного мозга нарушения ритма и гемодинамические изменения имели нейрогенное происхождение. Снижение диастолического и среднего артериального давления, вероятно, не влияло на мозговой кровоток. Критическое снижение мозгового кровотока должно вызывать церебральную ишемию с последующими изменениями электрической активности головного мозга [9], [11]. При церебральной ишемии эпилептическая активность значимо возрастает или напротив резко прекращается в зависимости от степени снижения мозгового кровотока [11].
Выводы
Резюмирую выше изложенное, можно отметить следующее: одиночные ЭЭГ-паттерны вызывают кратковременные эпизоды аритмии. Спустя 120 минут после аппликации отмечаются длительные периоды пароксизмальной активности (каждый продолжительностью 1—1,5 минуты). Регрессионный анализ временных корреляций между эпилептической активностью и аритмиями показал, что ЭЭГ-паттерны и пароксизмальная активность имеют линейную корреляцию во время межприступной и иктальной активности. Синусовые брадиаритмии, прямо пропорциональны длительности эпилептиформных пароксизмов. Иктальная активность могла спровоцировать кратковременную остановку синусового узла и желудочковые экстрасистолы, которые нивелировались при прекращении пароксизмальной активности.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Feigin V.L. Global, regional, and national burden of neurological disorders, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016/ V.L. Feigin, Е. Nichols, Т. Alam //Lancet Neurology. -2019.-№18. –Р. 459–480.
- Bertran F. Epilepsy today/ F. Bertran // Revue de l'Infirmiere. – 2018. – №67(243). –Р.14-16. DOI: 1016/j.revinf.2018.07.003. PMID: 30262002.
- Sidhu M.K. Neuroimaging in epilepsy/ M.K. Sidhu, J.S. Duncan, J.W. Sander// Current Opinionin – 2018. – №31(4). – Р. 371-378. DOI: 10.1097/WCO.0000000000000568. PMID: 29782369.
- Annex a to the european convention on the protection of spine animals used for experiments and other scientific purposes (ets №. 123) guidelines for the maintenance and care of laboratory morals (laboratory). – 2006. [Electronic resource]. – URL: http://conventions.coe.int/Treaty/EN/Treaties/PDF/123- Arev. pdf (accessed: 11.03.2022).
- Inchina V.I. Study of peculiarities of expression of neurological deficiency in rats with cerebral pathology of traumatic genesis and acute hypoxia in the acute period / V.I. Inchina, D.M. Korobkov, A.O. Petrunin A.O//Modern problems of science and education. – –№3. –P. 100.
- Reference Manual for AcqKnowledge® 4.4 Software & MP150/MP36R, BioHarness, B-Alert Mobita or Stellar Hardware/Firmware on Windows® 10, 8, 7 or Vista, or Mac OS® X 10.5-10.9 [Electronic resource]. URL: https://www.biopac.com/wp-content/uploads/BSL-PRO-3_7-Manual.pdf (accessed: 11.03.2022).
- Steriade C. Epilepsy: key experimental therapeutics in early clinical development/ С. Steriade C., J. French, О. Devinsky// Expert Opinionon Investigational Drugs. ––№29(4). –Р. 373-383. DOI: 10.1080/13543784.2020.1743678. PMID: 32172604.
- Singh G. The global burden of epilepsy report: Implications for low- and middle-income countries/ G. Singh, W. Sander// Epilepsy& Behavior. –2020. –№105. –Р.106949. DOI: 10.1016/j.yebeh.2020.106949. PMID: 32088583.
- Huberfeld G., Blauwblomme T, Miles R. Hippocampus and epilepsy: Findings from human tissues/ G. Huberfeld, Т. Blauwblomme, R. Miles // Revue Neurologique. – –№171(3). –Р. 236-251. DOI: 10.1016/j.neurol.2015.01.563. PMID: 25724711; PMCID: PMC4409112.
- Fernandez-Baca Vaca G. Focal EEG abnormalities and focal ictal semiology in generalized epilepsy/ G. Fernandez-Baca Vaca, J.T.Park//Seizure. – –№77. –Р. 7-14. DOI: 10.1016/j.seizure.2019.12.013. PMID: 31882201.
- Moraes M.F.D. Epilepsy as a dynamical system, a most needed paradigm shift in epileptology/ M.F.D. Moraes, D. de Castro Medeiros, F.A.G. Mourao, S.A.V. Cancado, V.R. Cota// Epilepsy& – 2021. –№121(Pt. B). –Р.106838. DOI: 10.1016/j.yebeh.2019.106838. PMID: 31859231.