СЫВОРОТОЧНАЯ КОНЦЕНТРАЦИЯ ИЛ-1β У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ 2 ТИПА С НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНЬЮ ПЕЧЕНИ
Михальчишин Г.П.1, Боднар П.Н.2, Кобыляк Н.Н.3
1Доцент, кандидат медицинских наук, 2 профессор, доктор медицинских наук, 3 аспирант, Национальный медицинский университет имени О.О. Богомольца, кафедра эндокринологии
СЫВОРОТОЧНАКЯ КОНЦЕНТРАЦИЯ ИЛ-1β У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ 2 ТИПА С НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНЬЮ ПЕЧЕНИ
Аннотация
В исследовании по типу "случай-контроль" изучается уровень ИЛ-1β у больных сахарным диабетом 2 типа (СД2) в зависимости от наличия неалкогольной жировой болезни печени (НАЖБП). В исследование включены 85 больных. Установлено, что у больных с НАЖБП наблюдается повышенный уровень провоспалительного цитокина ИЛ-1β по сравнению с контрольной группой. Концентрация ИЛ-1β статистически достоверно увеличивается параллельно с прогрессированием инсулинорезистентности и распространенностью ожирения у лиц с НАЖБП.
Ключевые слова: сахарный диабет типа 2, неалкогольная жировая болезнь печени, ИЛ-1β, инсулинорезистентность, ожирение.
Mykhalchyshyn G.P.1, Bodnar P.N.2, Kobyliak N.N.3
1Associate professor, PhD, 2 professor, MD, 3 postgraduate student, National Bogomolets Medical University, Department of Endocrinology
SERUM IL-1β CONCENTRATIONS IN PATIENTS WITH DIABETES MELLITUS TYPE 2 AND NONALCOHOLIC FATTY LIVER DISEASE
Abstracts
In "case-control" study we determined level of IL-1β in patients with type 2 diabetes mellitus (T2DM), depending on the availability of non-alcoholic fatty liver disease (NAFLD). The study included 85 patients. Found that proinflammatory cytokine IL-1β is increased in NAFLD compared to the control group. The concentration of IL-1β was significantly increased due to the progression of insulin resistance and the prevalence of obesity in patients with NAFLD.
Keywords: diabetes mellitus type 2, nonalcoholic fatty liver disease, IL-1β, insulin resistance, obesity.
Сахарный диабет типа 2 (СД2) является распространенным и гетерогенным заболеванием. Неалкогольная жировая болезнь печени (НАЖБП) это неспецифическое, интегральное и многофакторное поражение печени при СД2. В ее развитии прослеживаются стадии стеатоза печени, стеатогепатита, фиброза и стеатогенного цирроза.
Патогенез НАЖБП тесно связан с синдромом инсулинорезистентности (ИР), накоплением триглицеридов (ТГ) и формированием жирового гепатоза – первого этапа, или "толчка" заболевания. В дальнейшем происходит высвобождение из жировой ткани и синтез в гепатоцитах de novo жирных кислот, которые при избыточном накоплении в клетках печени индуцируют развитие перекисного окисления липидов (ПОЛ) и генерацию реактивных форм кислорода (РФК) - теория «второго толчка». Дальше стеатоз переходит в стеатогепатит, с последующей прогрессией к фиброзу при избыточном образовании экстрацеллюлярного матрикса. Факторами, вызывающими воспаление, считаются липотоксичнисть, нарушение функции внутриклеточных структур (митохондрий, микросом), а гибель гепатоцитов и развитие фиброза провоцирует - ПОЛ, РФК, секреция цитокинов [1].
К семейству цитокинов ИЛ-1 относятся представители, среди которых часть обладает выраженной провоспалительной активностью - ИЛ-1α, ИЛ-1β и ИЛ-18, а остальные являются противовоспалительными медиаторами - антагонист рецептора ИЛ-1 (IL-1Ra) и ИЛ-37 [2]. Мы обратили внимание на ИЛ-1β роль которого в патогенезе НАЖБП остается до конца невыясненной и противоречивой. Целью нашего исследования является изучение сывороточной концентрации ИЛ-1β у больных СД2 и НАЖБП в зависимости от выраженности ожирения и ИР.
Материалы и методы. Мы провели исследования по типу "случай-контроль" критериями включения в которое были согласие больного, возраст старше 18 лет, наличие НАЖБП подтвержденной ультрасонографическими и лабораторными методами. В основною группу вошло 60 (70,5%) больных СД2 с НАЖБП. Средний возраст их составил 53,27±8,39 лет, длительность СД - 5,97±3,88 лет. Контрольную группу составили 25 (29,5%) больные СД2 без НАЖБП. Их средний возраст составил 53,57±7,16 лет, а длительность заболевания - 5,0±2,81 года.
В исследование не включали пациентов злоупотребляющих алкоголем, а также тех, кто имел признаки хронического вирусного гепатита, ассоциированного с HBV-, HCV-, HDV-инфекциями, аутоиммунного и лекарственного гепатитов, болезни Коновалова-Вильсона и идиопатического гемохроматоза.
Схема обследования пациентов включала биохимические методы исследования, которые позволили оценить функциональное состояние печени, показатели липидного и углеводного обмена. Оценка уровня ИP проводилась с помощью структурной математической модели на основе определения концентрации глюкозы плазмы и инсулина натощак - HOMA (homeostasis model assesment), с определением индекса НОМА-IR по формуле:
НОМА-IR = иммунореактивный инсулин (мкЕД/мл)×глюкоза плазмы натощак / 22,5
Концентрацию провоспалительного цитокина ИЛ-1β определяли иммуноферментным методом с использованием коммерческих тест-систем «Протеиновый контур» (Россия) и выражали в пг/мл.
Статистический анализ выполняли с помощью стандартного пакета программ SPSS версии 20.0 и Microsoft Excel. Количественные изменения представлены в виде средней величины и стандартного отклонения средней величины (М±SD), качественные в виде %. Для оценки различия количественных показателей использовали однофакторный дисперсионный анализ (One-Way ANOVA) и t критерий Стьюдента для независимых выборок. При анализе качественных переменных применяли критерий χ2.
Результаты и их обсуждение. Данные обследования представлены в табл. 1. Группы больных, принявшие участие в исследование были однотипными по возрасту и полу. Между основной и контрольной группами не отмечалось статистически достоверной разницы по продолжительности СД2 (р=0,068). По нашим данным наблюдалось достоверное увеличение распространенности ожирения среди исследуемых больных. В основной группе оно составило 85%, а в контроле - 56,0% (р=0,004). Наблюдалось повышение ИМТ, а также его статистически достоверный рост параллельно с наличием у больных НАЖБП (р<0,001).
Таблица 1 - Основные антропометрические, биохимические и метаболические показатели у обследуемых больных (M ± SD).
|
Показник |
Контрольная группа (n=25) |
НАЖБП (n=60) |
p
|
|
|
ИЛ-1β, пг/мл |
26,84±10,35 |
39,95±16,65 |
0,001 |
|
|
ИМТ, кг/м2 |
30,56±3,12 |
37,4±7,65 |
<0,001 |
|
|
Индекс НОМА-IR |
4,41±2,65 |
7,05±2,95 |
<0,001 |
|
|
АЛТ, Ед/л |
24,45±5,4 |
72,79±15,65 |
<0,001 |
|
|
АСТ, Ед/л |
23,03±5,21 |
67,05±14,08 |
<0,001 |
|
|
Триглицериди, ммоль/л |
2,15±0,68 |
3,37±2,53 |
0,020 |
|
|
Холестерин, ммоль/л |
5,99±0,62 |
6,15±1,36 |
0,590 |
|
р - оценка достоверности различий рассчитана с использованием t критерия Стьюдента для независимых выборок.
У всех больных выявлены нарушения углеводного обмена. Среднее значение HOMA-IR было выше у больных СД2 с НАЖБП, а превышение значения индекса HOMA-IR более 3,0, что свидетельствует о ИР, обнаружено у 56,0% лиц контрольной группы против 95,0% пациентов основной группы (р<0,001).
Исследование уровня трансаминаз и липидного профиля у больных продемонстрировало определенные особенности в зависимости от наличия НАЖБП (табл. 1). Наблюдалось достоверное увеличение показателей АЛТ и АСТ параллельно с ростом уровня ТГ и тенденция к повышению общего холестерина по сравнению с контрольной группой.
Исследование уровня ИЛ-1β в сыворотке крови показало достоверное повышение данного цитокина у больных СД2 с НАЖБП. Цитокины, члены семейства ИЛ-1, участвуют в метаболизме глюкозы, в развитии ИР и ожирения. У мышей с генетически детерминированным ожирением экспрессия ИЛ-1β значительно выше в подкожной / висцеральной жировой ткани по сравнению с печенью [3], а сам цитокин контролирует чувствительность к инсулину гепатоцитов [4]. ИЛ-1β на транскрипционном уровне уменьшает экспрессию субстрата инсулинового рецептора IRS-1 через ERK-зависимые и независимые механизмы, тем самым провоцируя развитие ИР [5]. Введение мышам с диет-индуцированным ожирением нейтрализующих анти-ИЛ-1β антител XOMA 052 приводило к повышению чувствительности периферических тканей к инсулину и улучшение β-клеточной функции [6].
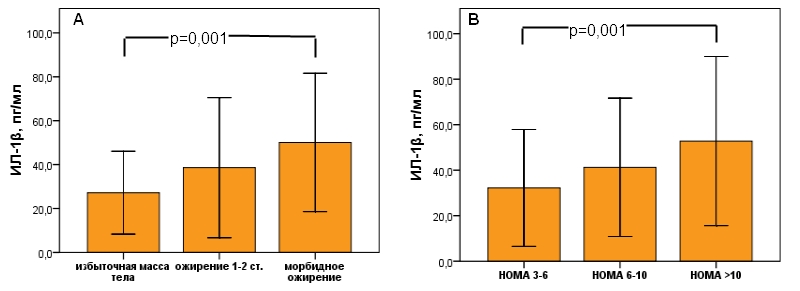
Рис. 1 - Уровень ИЛ-1β у больных НАЖБП в зависимости от выраженности ожирения (рис. 1А) и ИР (рис. 1В).
р - оценка достоверности различий между исследуемыми группами рассчитана с использованием однофакторного дисперсионного анализа (one-way ANOVA).
На рисунке 1 представлены уровни цитокина у больных СД2 с НАЖБП в зависимости от выраженности ожирения и ИР. Нами отмечено достоверное увеличение сывороточного уровня ИЛ-1β параллельно с прогрессированием ожирения (рис. 1А) и ИР (рис. 1В). У больных с морбидным ожирением его уровень составил 50,08±15,79пг/мл что достоверно выше чем при ожирении 1-2 степени (38,6±15,96пг/мл) или избыточном весе (27,2±9,44пг/мл) (р=0,001).
Распределив больных СД2 с НАЖБП на три кластера в зависимости от величины индекса НОМА-IR, мы констатировали максимальную концентрацию ИЛ-1β у лиц с его значением >10, что статистически достоверно выше по сравнению с больными у которых индекс НОМА был в диапазоне 6-10 и соответственно 3-6 (52,8±18,58пг/мл против 41,27±15,19пг/мл против 32,21±12,85пг/мл, р=0,001).
Выводы: у больных СД2 с НАЖБП наблюдается повышенный уровень провоспалительного цитокина ИЛ-1β по сравнению с контрольной группой. Его концентрация статистически достоверно увеличивается параллельно с прогрессированием ИР и распространенностью ожирения у лиц с НАЖБП.
Список литературы
Боднар П.М., Михальчишин Г.П., Кобиляк Н.М. Неалкогольна жирова хвороба печінки у хворих на цукровий діабет типу 2: патогенез, діагностика та лікування (лекція) // Ендокринологія. – 2012. – Т.17, №1. – с. 94–101.
Dinarello C.A. Interleukin-1 in the pathogenesis and treatment of inflammatory diseases. // Blood. – 2011. – 117. – p. 3720–3732.
Moschen A.R., Molnar C., Enrich B. et al. Adipose and liver expression of IL-1 family members in morbid obesity and effects of weight loss. // Mol Med. – 2011. – Vol.17., №7-8. – p. 840-845.
Nov O., Kohl A., Lewis E.C. et al. Interleukin-1beta may mediate insulin resistance in liver-derived cells in response to adipocyte inflammation. // Endocrinology. – 2010. – Vol. 151. – p. 4247–4256.
Somm E., Cettour-Rose P., Asensio C. et al. Interleukin-1 receptor antagonist is upregulated during diet-induced obesity and regulates insulin sensitivity in rodents. // Diabetologia. – 2006. – Vol. 49. – p. 387–393.
Owyang A.M., Maedler K., Gross L. et al. XOMA 052, an anti-IL-1{beta} monoclonal antibody, improves glucose control and {beta}-cell function in the diet-induced obesity mouse model. // Endocrinology. – 2010. – Vol. 151. – p. 2515–2527.
