ВОЗМОЖНОСТИ ПРИМЕНЕНИЯ НАНОЧАСТИЦ ОКСИДА ЖЕЛЕЗА В ПРОВЕДЕНИИ ГИПЕРТЕРМИИ
Безукладова С.В.1, Науменко В.Ю.2, Акопджанов А.Г.3, Шимановский Н.Л.4
1Студент, Национальный Исследовательский Университет Московский Энергетический Институт,2 доктор технических наук, профессор кафедры экспериментальной и теоретической физики, Российский государственный медицинский университет,3 инженер, Российский государственный медицинский университет,4 Член-корреспондент РАМН, доктор медицинских наук, профессор кафедры фармакологии и радиобиологии,Российский государственный медицинский институт.
ВОЗМОЖНОСТИ ПРИМЕНЕНИЯ НАНОЧАСТИЦ ОКСИДА ЖЕЛЕЗА В ПРОВЕДЕНИИ ГИПЕРТЕРМИИ
Аннотация
В статье рассмотрена возможность применения наночастиц Fe3O4 в проведении гипертермии. Применение нанотехнологии с использованием частиц оксида железа позволяет получать эффективные препараты для магнитной гипертермической терапии различных типов опухолей.
Ключевые слова: ферримагнитные наночастицы, гипертермия,онкология.
Bezukladova S.V.1,Naumenko V.Yu2,Akopdzhanov A.G.3, ShimanovskiyN.L4
1Student,Moscow Power Engineering Institute,2 Dr. Sc. in technology, professor of department theoretical and experimental physical of Russian State Medical University, Moscow,3engineer, Russian State Medical University, Moscow,4 doctor of medical science, professor of department pharmacological and radiobiology of Russian State Medical University, Moscow.
MAGNETIC IRON OXIDE NANOPARTICLES IN MAGNETIC FLUIDE HYPERTERMIA
Abstract
The article considers the possibility of use Fe3O4 nanoparticles in process of hyperthermia. Nanotechnology using iron oxide particles can get effective drugs for magnetic hyperthermia treatment of various types of tumors.
Keywords: ferrimagnetic nanoparticles, hyperthermia, oncology.
Наночастицы магнитных материалов, а также системы, в которых магнитные наночастицы распределены в немагнитной среде, представляют огромный интерес для современной онкологии, поскольку они обладают уникальными физическими свойствами, например, такими как суперпарамагнетизм, ферримагнетизм, имеют высокую магнитную чувствительность и характеризуются низкой температурой Кюри и т.д. Наиболее перспективным материалом можно считать сложный оксид железа – магнетит Fe3O4, методики получения которого достаточно изучены, в том числе и с учетом требований различных биологических сред [1].
Магнетит Fe3O4 (FeO х Fe2O3) относится к классу веществ называемых ферритами, отрицательные ионы кислорода которого образуют кубическую гранецентрированную решетку, в которой на каждую молекулу Fe3O4 приходится один двухвалентный (Fe+2) и два трехвалентных (Fe+3) иона железа [2]. В результате образуются две магнитные подрешетки, одна из которых состоит из половины трехвалентных ионов железа, а вторую составляют оставшиеся трехвалентные и двухвалентные ионы. Магнитные моменты подрешеток направлены антипараллельно, поэтому магнитные моменты трехвалентных ионов компенсируются, а моменты двухвалентных образуют спонтанную намагниченность.
При нагревании и достижения температуры Кюри (ТК) тепловое движение атомов разрушает созданное обменным взаимодействием упорядоченное расположение моментов атомов. Следовательно, чем больше обменное взаимодействие в ферромагнетике, тем выше должна быть ТК, при которой разрушается магнитный порядок. Магнетит характеризуется достаточно высокой температурой Кюри ТК ~ 850 К [2,3]. Выше температуры ТК вещество перестает быть ферромагнетиком (становится парамагнетиком) и ведет себя подобно многим другим парамагнитным телам.[3]
В настоящее время наиболее широкое применение в биомедицине получили растворы, содержащие частицы наноразмерного оксида железа, что обусловлено их низкой токсичностью и стабильностью магнитных характеристик [4,5].
Для биомедицинского применения наночастиц необходимо выполнение ряда требований: образовать устойчивую коллоидную систему в водных растворах и других биосовместимых растворителях; иметь возможность вариации параметров раствора (концентрации солей, рН и температуры) в интервалах, которые определяются целью исследования в каждом конкретном случае. Однако ввиду высокой реакционной активности для наночастиц практически не существует инертной среды. Одной из особенностей поведения наночастиц в растворе является их склонность к агрегации, поэтому практическое использование растворов наночастиц сопряжено с их стабилизацией (нанесение покрытия на поверхность магнитного «ядра», добавление стабилизаторов, подбор растворителей и т.д.). Применяемые покрытия можно разделить на органические и неорганические. Наиболее распространенными органическими покрытиями наночастиц являются декстран, полиэтиленгликоль (ПЭГ), крахмал, поливинилэтанол, гепарин, высшие карбоновые кислоты [6].
Предлагаемый нами в качестве действующего вещества сложный оксид железа – магнетит (Fe3O4) – был получен химическим методом [7] при осаждении магнетита щелочью из водного раствора солей двухвалентного железа таким образом, чтобы размер частиц в коллоидном растворе не превышал 50нм. В качестве основной химической реакции для получения наполнителя магнитной жидкости выбрана так называемая реакция Элмора [8], при этом исходные реактивы представляют собой соли трех- и двухвалентного железа:
2 Fe Cl 3 + FeCl 2 + 8 NH 4 OH = Fe 3 O 4 + 8 NH 4 Cl + 4 H 2 O.
В случае полной нейтрализации соли железа (III) направление процесса кристаллизации получаемого гидроксида железа зависит главным образом от рН и температуры [8]. Изменение условий (температуры и рН раствора) позволяет существенно изменять как фазовый состав, так и размер образующихся наночастиц. Увеличение значения рН приводит к росту размера кристаллов и возникновению частиц α-оксида железа шарообразной формы. Стабилизация размера частиц магнетита достигается добавлением специального ПАВа, при интенсивном перемешивании раствора, например декстрана (C6H14) или близкого к нему по структуре маннитола (С6Н14О4), что создает возможность использования его в медицинских целях [8, 9, 10].
Полученные результаты и их обсуждение.
Дисперсный состав наночастиц в полученных нами коллоидных растворах изучали при помощи просвечивающего электронного микроскопа высокого разрешения JEOL JEM-1011. Полученные микрофотографии коллоидного раствора, содержащие наночастицы оксида железа, и их распределение по размеру приведены на рис.1.

Pис.1 - ПЭМ наночастиц оксида железа
Обработка экспериментальных результатов распределения наночастиц по размеру проводился с помощью программы Scan Soft 2000.
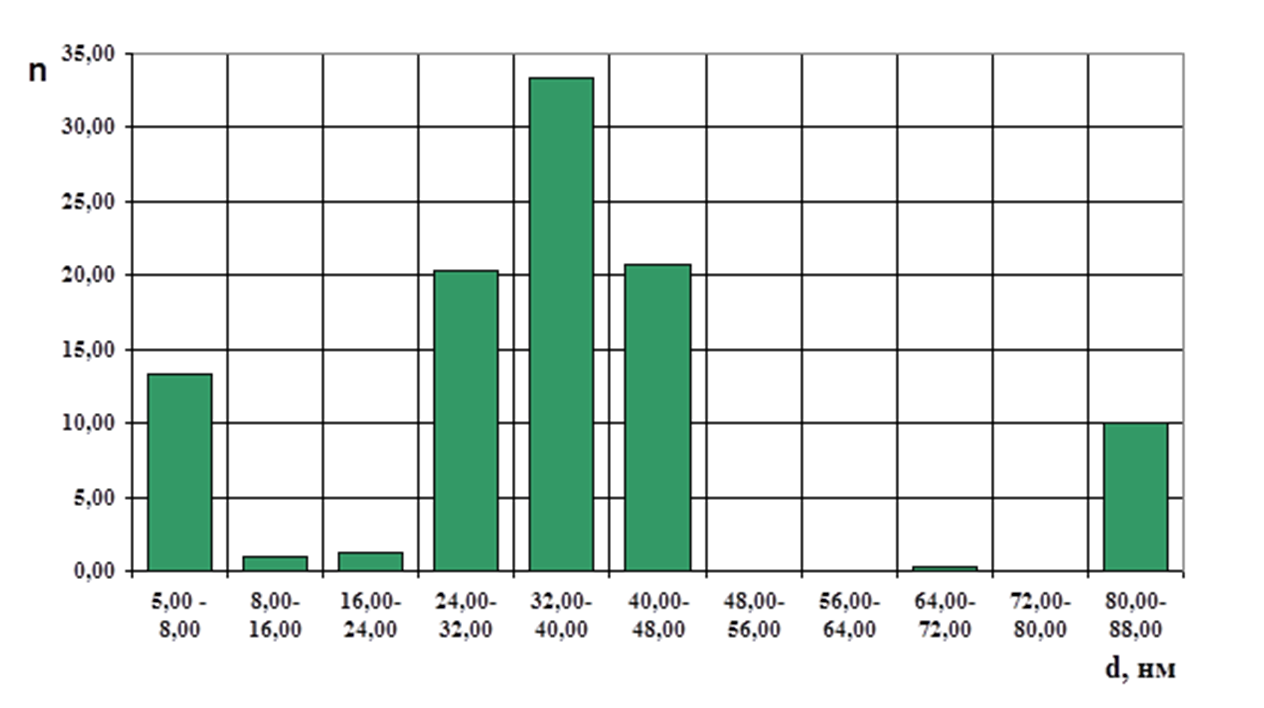
Рис. 2 - Распределение наночастиц по размеру
Для определения распределения по размеру с учетом хелатной оболочки использовали метод фотонной корелляционной спектроскопии (Malvern Zetasizer nano zs) .Результат распределения приведен на рис.3.
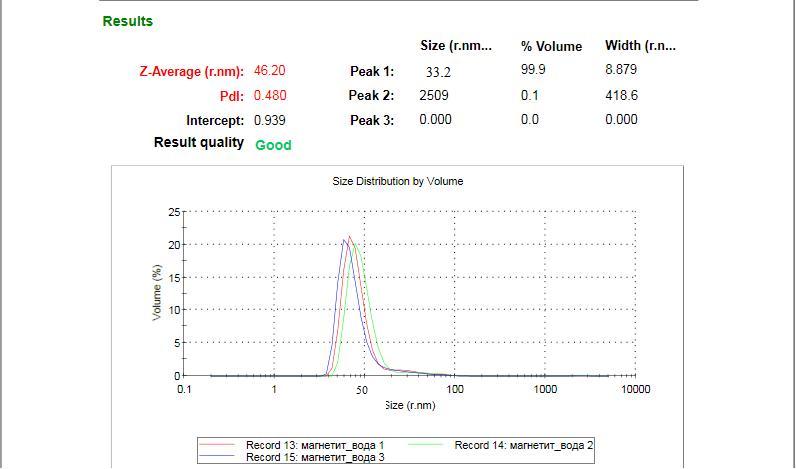
Рис.3 - Результаты исследования распределения по размерам с помощью фотонной корелляционной спектроскопии.
Магнитные свойства полученных наночастиц оксида железа изучались с помощью метода протонной релаксометрии. Были получены кривые спада времен спин-решеточной Т1 и Т2 спин-спиновой релаксации, на основание которых рассчитывались значения релаксирующих способностей полученных растворов (рис.4).

Рис.4 - Обратная зависимость времен релаксации от концентрации раствора наночастиц крупной фракции.
Значение релаксирующей способности :
Для крупной фракции Т2:α=47,1 л/(ммоль*сек), Т1:α= 9,42 л/(ммоль*сек)
Для мелкой фракции Т2:α=22,1 л/(ммоль*сек), Т1:α=12,1л/(ммоль*сек).
По результатам проведенных экспериментальных исследований можно сделать вывод о том, что сверхмалые наночастицы со средним размером 5-7 нм обладают выраженными суперпарамагнитными свойствами, а с увеличением размера наночастиц до 30-70 нм, преобладает ферримагнитное состояние. Наночастицы сверхмалого размера предложены для создания Т1 и Т2 контрастного средства, со способностью длительно циркулировать в кровеносном русле, а ферримагнитные наночастицы в качестве средства для гипертермии с возможностью накапливать их в очаге заболевания с помощью внешнего магнитного поля.
Биосовместимость препарата определялась с помощью МТТ теста(рис.5)
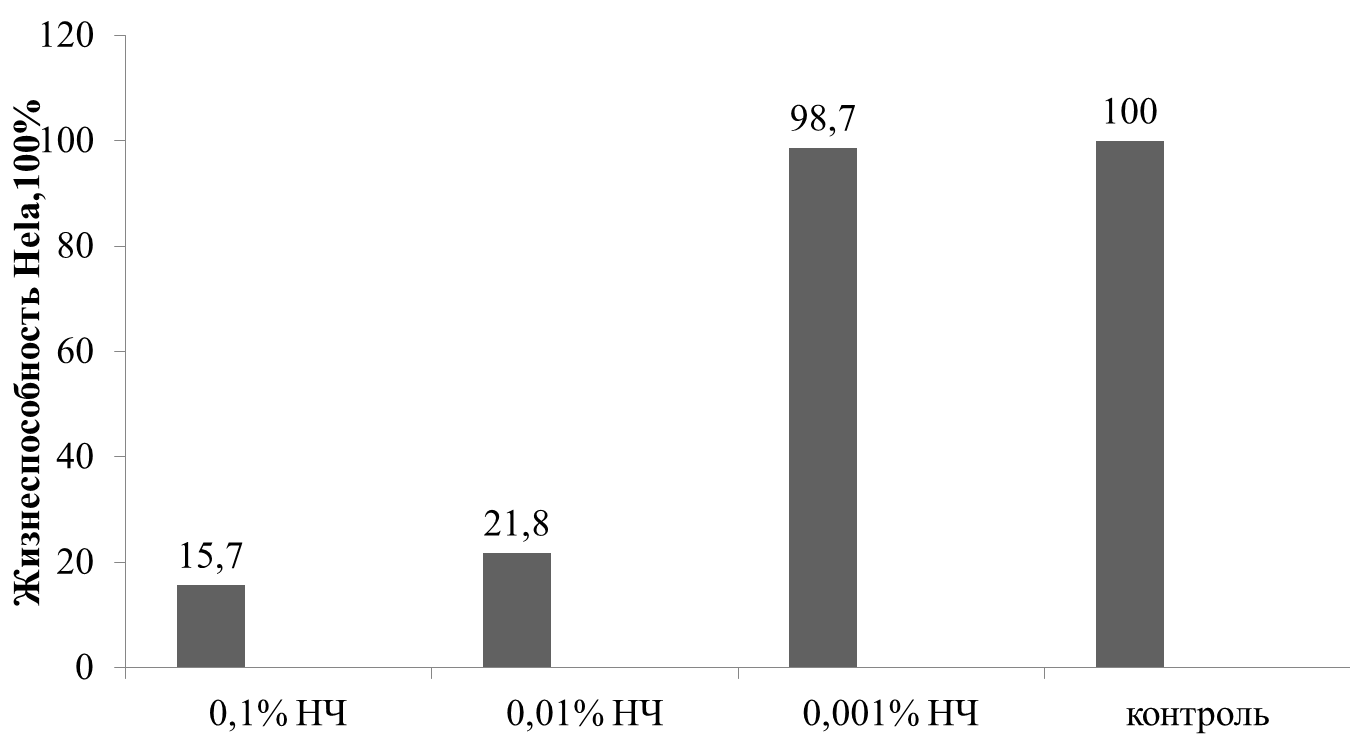
Рис.5 - Влияние наночастиц Fe3O4 на жизнеспособность Hela.
Из полученных результатов следует вывод, что наночастицы обладают токсическими свойствами, которые необходимо учитывать при проведение дальнейших исследований. Допустимая концентрация вводимого препарата составила 0,5 мл на литр крови.
Исследование возможности применения наночастиц сложного оксида железа для гипертермии проводилось путем облучения культур клеток Hela. После энкубации с наночастицами Fe3O4 в течение 2 часов, облучение проводилось с помощью высокочастотного генератора на частоте 42,19 ГГц в течение 30 минут. После облучения образцы окрашивались и фиксировались, а жизнеспособность клеток определялась с помощью анализа микрофотографии (Canon 450 d,рис 6,7).
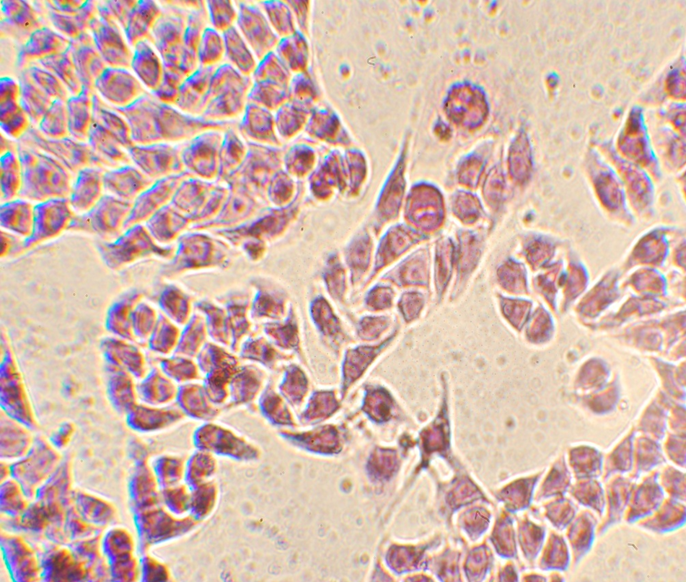
Рис.6 - Клетки HeLa с НЧ оксида железа, не подвергавшиеся гипертермии(различимы 95 живых клеток).
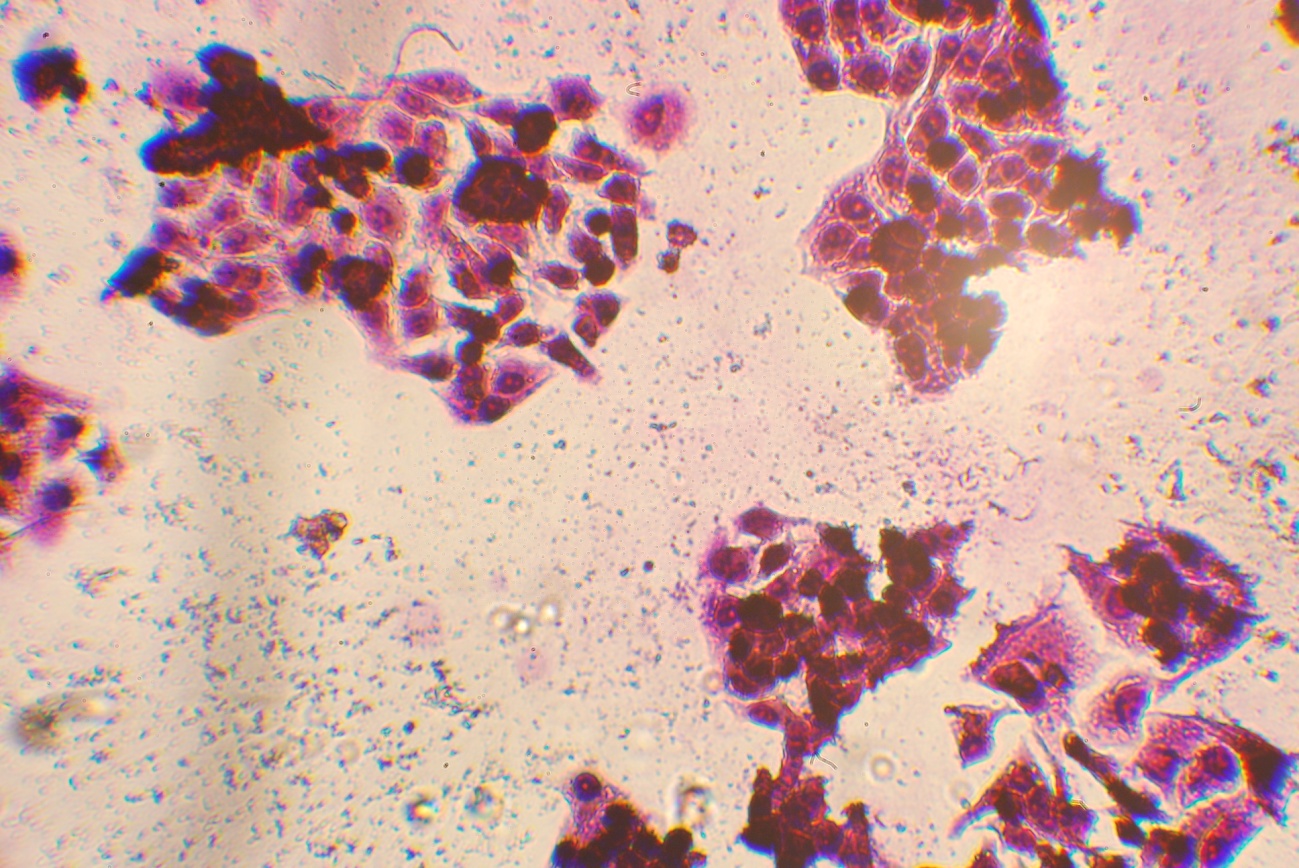
Рис.7 - Клетки HeLa с НЧ оксида железа после проведения гипертермии(различимы 25 живых клеток).После облучения, клетки HeLa образуют агрегаты и погибают.
Выводы
Использование магнитных наночастиц на основе сложных оксидов железа в онкологии весьма перспективно. Наночастицы оксида железа благодаря своим магнитным свойствам могут стать инструментом, как для визуализации, так и для лечения этих новообразований .
Исследования показали, что для успешного применения наночастиц в магнитной гипертермии необходимо, чтобы они обладали ферримагнитными свойствами. Результаты релаксометрии позволили определить оптимальный средний размер наночастиц, характерный для ферримагнитного состояния, который составил 30-70 нм.
Наночастицы магнетита, необходимого размера возможно получить с помощью химического метода, при использование биосовместимых стабилизаторов, например декстрана. Контроль токсичности возможно осуществлять с помощью выбора концентрации стабилизатора.
Экспериментально показана, эффективность гипертермического воздействия на онкологические клетки внешнего излучения частотой 42,19 ГГц, при использование наночастиц сложного оксида железа с ферримагнитными свойствами.
Список литературы
Шимановский Н.Л., Епинетов М.А., Мельников М.Я. Молекулярная и нанофармакология. М.: Наука. 2010. 624 с
Губин С.П., Кокшаров Ю.А., Хомутов Г.Б., Юрков Г.Ю. Магнитные наночастицы: методы получения, строение и свойства. //Успехи химии. – 2005. № 74(6). С. 539-574.
Науменко В.Ю., А.Г.Акопджанов, А.В.Бабич, И.В.Выков, Н.Л.Шимановский. Возможности применения наноразмерных частиц оксида железа для гипертермической терапии опухолей. Биомедицинская радиоэлектроника, 2011, 12, с.19-27.
Berry C., Curtis A. Functionalisation of magnetic nanoparticles for applications in biomedicine // J. Phys. D. Appl. Phys. 2003. V. P. 36.
Lu A.-H., Salabas E.L., Schuth F. Magnetic nanoparticles: synthesis, protection, functionalization, and application // Angew. Chem. Int. Ed. 2007. V. 46. P. 1222—1244.
Koneracka M., Kopcansky P., Antalik M. et al. Immobilization of proteins and enzymes to fine magnetic particles // J. Magn. Magn. Mater. 1999. V. 201. P. 427.
Акопджанов А.Г., Н.Л.Шимановский, М.А.Епинетов, Н.В.Медведева, А.И.Сергеев, Э.В.Манвелов, В.Ю.Науменко, В.О.Панов. Получение и магнитно-резонансные контрастные свойства наночастиц сложного оксида железа. Астраханский мед.ж., 2010, 1, с.159- 161
Шабанова Н.А., Попов В.В., Саркисов П.Д. Химия и технология нанодисперсных оксидов. М.: ИКЦ «Академкнига» 2006. С. 309.
M. Taupitz, S. Wagner, J. Schnorr, et al.// Investigative Radiology. 2004. V. 39. P. 394.
Kin Man Ho, Pei Li. // American Chemical Society 2008. V. 24(5). Р. 1801.
