КЛИНИКО-МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА РЕАКТИВНЫХ ИЗМЕНЕНИЙ ОКОЛООПУХОЛЕВЫХ УЧАСТКОВ СЛИЗИСТОЙ ОБОЛОЧКИ ЖЕЛУДКА У БОЛЬНЫХ РАКОМ ЖЕЛУДКА
Сеньчукова М.А.
Кандидат медицинских наук, доцент, Оренбургская государственная медицинская академия
КЛИНИКО-МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА РЕАКТИВНЫХ ИЗМЕНЕНИЙ ОКОЛООПУХОЛЕВЫХ УЧАСТКОВ СЛИЗИСТОЙ ОБОЛОЧКИ ЖЕЛУДКА У БОЛЬНЫХ РАКОМ ЖЕЛУДКА
Аннотация
Проанализированы морфологические особенности слизистой оболочки желудка на участках, прилежащих к опухоли и их связь с факторами опухолевой прогрессии у 109 радикально оперированных больных раком желудка. Установлено, что риск лимфогенного метастазирования достоверно выше при диффузном типе РЖ, опухолях больше 5 см в диаметре и наличии в подслизистой основе слизистой оболочки желудка дилятированных капилляров. Общая и безрецидивная 2-х летняя выживаемость были достоверно лучше при кишечном типе рака желудка, размерах опухоли меньше 5 см, при отсутствии дилятированных сосудов в подслизистой основе слизистой оболочки желудка и при наличии антибактериальной терапии за 1 – 2 месяца до операции в связи с предварительным диагнозом гастрит или язва желудка.
Ключевые слова: рак желудка, слизистая оболочка желудка, факторы прогноза
Senchukova M.A.
PhD of medical sciences, associate professor, Orenburg State Medical Academy
CLINICAL-MORPHOLOGICAL CHARACTERISTICS OF THE REACTIVE CHANGES OF THE GASTRIC MUCOSA ADJACENT TO THE TUMOR IN PATIENTS WITH GASTRIC CANCER
Abstract
The clinico-morphological specific features of the gastric mucosa located near to the tumor and its relationship with the factors of tumor progression in 109 radically operated patients with gastric cancer were analyzed. It was found that the risk of regional nodal metastasis was significantly higher for diffuse type of gastric cancer, the tumors greater than 5 cm in diameter, and the presence in gastric submucosa dilated capillaries. The overall and relapse-free 2-year survivals were significantly better at the intestinal type of gastric cancer, tumor size less than 5 cm, in the absence of dilated blood vessels in the gastric submucosa and in the presence of antibiotic therapy for 1 - 2 months before the surgery in connection with the preliminary diagnosis of a gastritis or a stomach ulcer
Keywords: gastric cancer, gastric mucosa, prognostic factors
Введение
Несмотря на снижение заболеваемости и смертности, рак желудка (РЖ) во всем мире продолжает оставаться одной из важнейших медицинских и социально-экономических проблем [8]. Результаты лечения этой патологии во многом определяются агрессивным потенциалом опухолевых клеток, в первую очередь склонностью опухоли к лимфогенному и гематогенному метастазировании. Проведенные исследования показали, что характер воспалительной инфильтрации стромы опухоли, пролиферативный потенциал опухолевых клеток, нарушение процессов апоптоза, клеточной адгезии, интенсивность ангиогенеза в опухоли могут служить важными критериями прогноза при раке желудка [4, 5, 6, 9, 13, 16]. Однако сложно представить, что поведение опухоли определяется только ее биологическими свойствами и не зависит от реакции тканей и систем организма на неопластический процесс. В ряде работ показано, что при раке толстой кишки, раке молочной железы на прилежащих к опухоли участках стромы органа наблюдаются выраженные реактивные изменения, а именно – полиморфно-клеточная инфильтрация, формирование лимфоидных узелков, дилятация сосудов [2, 3], которые могут иметь определенное прогностическое значение. При РЖ формирование в прилежащих к опухоли участках подслизистой основы (ПО) слизистой оболочки желудка (СОЖ) дилятированных сосудов капиллярного типа, образованных эндотелиальным клетками с бластным фенотипом, коррелирует со склонностью опухоли к лимфогенному метастазированию [7]. Однако, несмотря на отдельные исследования в этой области, до настоящего времени нет целостного представления о прогностической роли реактивных изменений прилежащих к опухоли участков СОЖ в прогрессии РЖ. Изучение этого вопроса и послужило целью настоящее исследование.
Материалы и методы
Исследованы морфологические особенности СОЖ у 109 радикально оперированных больных РЖ в возрасте от 33 до 81 года (средний возраст 61,8 + 0,97). Мужчин было 69 (63,3%), женщин – 40 (36,7%). Рак желудка у всех больных выявлен впервые и до проведения операции пациенты специального лечения не получали. У 17 (15,6%) больных опухоль локализовалась в верхней трети желудка, у 31 (28,4%) - в средней трети, у 58 (53,2%) - в нижней трети и у 3 больных (2,8%) имел место тотальный рак желудка. Стадия T1N0M0 выявлена у 19 (17,4%), T2N0M0 – у 24 (22%), T3N0M0 – у 18 (16,5%) и T2-4N1-2M0 – у 48 (44,1%) больных. Гистологическая структура опухоли была представлена высоко дифференцированной аденокарциномой у 36 больных (33,0%), умеренно дифференцированной - у 18 (16,5%), низкодифференцированной и недифференцированным раком - у 27 (24,8%) и перстневидно-клеточным раком – у 28 (25,7%) пациентов.
Материал для морфологического исследования забирали в течение 30 мин после удаления операционного препарата, отступя 3 – 5 см от видимого края опухоли и подвергали стандартной гистологической обработке с окраской гистопрепаратов гематоксилином Майера и эозином и пикрофуксином по ван Гизону. Гистологические препараты изучались методом световой микроскопии (Микроскоп Оптика В-350, сопряженный с камерой ScopeTek DCM500). В соответствии с модифицированной Сиднейской Системой [11] оценивали выраженность атрофических, диспластических изменений и неполной кишечной метаплазии (mild, moderate, marked) в СОЖ. Проводили подсчет клеток полиморфно-клеточного инфильтрата (ПКИ) на условную единицу площади (УЕП) и полуколичественным методом (нет, единичные, множественные) определяли количество лимфоидных фолликулов (ЛФ) в собственной пластинке СОЖ и расширенных сосудов капиллярного типа в ПО СОЖ. Для оценки плотности сосудов в собственной пластинке СОЖ гистологические препараты окрашивали иммуногистохимически с использованием антител к CD34 Ab-1(Clone QBEnd/10) в соответствии с протоколом фирмы изготовителя (Thermo Scientific) на Autostainer 480 (Австрия). В качестве системы визуализации применялась UltraVision LP Detection System HRP Polymer & DAB Plus Chromogen.
Полученные данные сопоставлены с клиническими особенностями РЖ: стадией заболевания, размерами, локализацией, гистологической структурой опухоли, наличием в анамнезе антибактериальной терапии (АТ) в связи с предварительным диагнозом гастрит или язва желудка, общей и безрецидивной двухлетней выживаемостью.
Статистическая обработка результатов исследования проводилась с использованием пакета прикладных программ Statistica 6.0. Сравнение показателей между группами проводили параметрическим и непараметрическими методами (Kruskal-Wallis и Mann-Whitney тесты). Взаимосвязь между различными показателями определяли, используя параметрический метод (Pearson) и непараметрические методы (ранговой корреляции по Spearman и гамма). Достоверность различий частот признаков в изучаемых группах оценивали с помощью критерия χ2. Сравнение показателей выживаемости между группами больных проводили с использованием Long-Rank теста. Различия между показателями считали достоверными при p<0,05.
Результаты и обсуждение
Проведенный анализ не выявил достоверных отличий в выраженности атрофических, диспластических изменений, неполной кишечной метаплазии, количестве ЛФ и уровне ПКИ в СОЖ при различных гистологических типах рака желудка (табл. 1) и стадиях заболевания (табл. 2).
Независимо от клинических особенностей заболевания во всех группах преобладали больные с выраженными атрофическими изменениями СОЖ и со средней и тяжелой степенью дисплазии желудочного эпителия. Выраженность атрофических изменений СОЖ увеличивалась с возрастом больных. При слабо выраженной атрофии средний возраст больных составил 47,7+4,7 лет, при умеренной – 59,7+1,8 лет и при выраженной – 63,3+1,1 лет (р1-2=0,04, р1-3=0,005 и р2-3=0,08). У мужчин выраженная метаплазия встречалась достоверно чаще, чем у женщин: у 23 из 69 мужчин и у 4 из 40 женщин (33,3% и 10% соответственно, р=0,013). Была отмечена прямая зависимость между количеством ЛФ и уровнем ПКИ в СОЖ (r=0,457, p<0,0001). В группе, где ЛФ отсутствовали, уровень ПКИ составил 7,78+0,76 клеток на УЕП, при единичных ЛФ – 8,88+0,55 клеток и при множественных – 11,70+0,51 клеток на УЕП (р1-3<0,0001, p2-3=0,0002). При ПКИ больше 14 клеток на УЕП размеры опухоли были достоверно больше, чем при более низких значениях (до 81 клеток на УЕП – 4,4+0,4 см, от 8 до 142 – 4,2+0,3 см и более 143 клеток на УЕП – 5,76+0,6 см, р1-2=0,01, р1-3=0,03).
Таблица 1 - Морфологические особенности СОЖ при различных гистологических типах рака желудка
|
Степень выраженности |
Степень дифференцировки опухоли |
||||||||
|
1 n = 36 |
2 n = 18 |
3 n = 27 |
4 n = 28 |
||||||
|
n |
% |
n |
% |
n |
% |
n |
% |
||
|
Атрофия
|
1 |
- |
- |
1 |
5.5 |
1 |
3.7 |
2 |
7.1 |
|
2 |
15 |
41,7 |
3 |
16.7 |
6 |
22,2 |
5 |
17.8 |
|
|
3 |
21 |
58,3 |
14 |
77.8 |
20 |
74,1 |
21 |
75.1 |
|
|
Метаплазия |
1 |
19 |
52,8 |
5 |
27.8 |
13 |
48,2 |
17 |
60,7 |
|
2 |
10 |
27,7 |
6 |
33.3 |
6 |
22,2 |
6 |
21,4 |
|
|
3 |
7 |
19,5 |
7 |
38.9 |
8 |
29,6 |
5 |
17,9 |
|
|
Дисплазия |
1 |
2 |
5,6 |
0 |
0 |
1 |
3,7 |
0 |
0 |
|
2 |
13 |
36,1 |
6 |
33,3 |
14 |
51,8 |
13 |
46,4 |
|
|
3 |
21 |
58,3 |
12 |
76,7 |
12 |
44,5 |
15 |
53,6 |
|
|
Лимфоидные фолликулы |
1 |
7 |
21,9 |
2 |
11,1 |
1 |
4,2 |
6 |
22,2 |
|
2 |
12 |
37,5 |
4 |
22,2 |
10 |
41,7 |
9 |
33,3 |
|
|
3 |
13 |
40,6 |
12 |
66,7 |
13 |
54,1 |
12 |
44,5 |
|
|
ПКИ |
9,8+3,5 |
11,6+3,9 |
10,9+4,4 |
9,3+3,8 |
|||||
|
Примечание: 1 - Высокодифференцированная аденокарцинома; 2 - Умеренно Дифференцированная аденокарцинома; 3 - Низкодифференцированная аденокарцинома и недифференцированный рак желудка; 4 - Перстневидно-клеточный рак |
|||||||||
Таблица 2 - Морфологические особенности СОЖ в зависимости от стадии рака желудка
|
Степень выраженности |
Стадия рака желудка |
||||||
|
T1-2N0M0 n = 43 |
T3N0M0 n = 18 |
T2-4N1-2M0 n = 48 |
|||||
|
n |
% |
n |
% |
n |
% |
||
|
Атрофия
|
1 |
0 |
0 |
1 |
5,6 |
3 |
6,2 |
|
2 |
16 |
37,2 |
2 |
11,1 |
11 |
22,9 |
|
|
3 |
17 |
62,9 |
15 |
83,3 |
34 |
70,8 |
|
|
Метаплазия |
1 |
22 |
51,2 |
9 |
50 |
23 |
47,9 |
|
2 |
10 |
23,2 |
5 |
27,8 |
13 |
27,1 |
|
|
3 |
11 |
25,6 |
4 |
22,2 |
12 |
25 |
|
|
Дисплазия |
1 |
2 |
4,6 |
1 |
5,5 |
0 |
0 |
|
2 |
14 |
32,6 |
7 |
38,9 |
25 |
52,1 |
|
|
3 |
27 |
62,8 |
10 |
55,6 |
23 |
47,9 |
|
|
Лимфоидные фолликулы |
1 |
8 |
19,5 |
1 |
7,2 |
7 |
15,2 |
|
2 |
14 |
34,1 |
8 |
57,1 |
13 |
28,3 |
|
|
3 |
19 |
46,4 |
5 |
35,7 |
26 |
56,5 |
|
|
ПКИ |
10,5+3,8 |
9,8+3,9 |
9,9+3,9
|
||||
Важнейшим фактором прогноза при РЖ является наличие метастазов в регионарных лимфатических узлах (РЛУ). Этот показатель коррелировал с размером (r=0,628, p=0,0001), гистологической структурой опухоли (r=0,392, p=0,0003), наличием в подслизистой основе СОЖ дилятированных капилляров (r=0,523, p=0,00004), общей (r=-0,863, p<0,0001) и безрецидивной (r=-0,702, p<0,0001) 2-х летней выживаемостью. У больных с регионарными метастазами был достоверно больше размер опухоли (табл. 3), чаще выявлялись дилятированные капилляры в ПО СОЖ (табл. 4) и показатели общей и безрецидивной 2-х летней выживаемости (табл. 5) были достоверно хуже. При наличии метастазов в РЛУ диффузный тип РЖ встречался также достоверно чаще.
Таблица 3 - Распределение больных раком желудка в зависимости от стадии заболевания и размера первичной опухоли
|
Размер опухоли в см |
Стадия рака желудка |
||
|
T1-2N0M01 n = 43 |
T3N0M02 n = 18 |
T2-4N1-2M03 n = 48 |
|
|
M+a min -max |
3,15+0,37 1,0 - 15 |
5,0+0,48 3 - 10 |
6,11+0,32 2,5 – 12,0 |
|
Уровень значимости (р) |
р1-2 = 0,005; р1-3 < 0,0001; р2-3 = 0,08 |
||
Таблица 4 - Распределение больных раком желудка в зависимости от стадии заболевания и наличия в подслизистой основе слизистой оболочки желудка дилятированных капилляров
|
Наличие дилятированных капилляров в ПО СОЖ |
Стадия рака желудка |
|||||
|
T1-2N0M01 n = 33 |
T3N0M02 n = 14 |
T2-4N1-2M03 n = 32 |
||||
|
n |
% |
n |
% |
n |
% |
|
|
Отсутствуют |
21 |
63,6 |
12 |
85,7 |
8 |
25 |
|
Присутствуют |
12 |
36,4 |
2 |
14,3 |
24 |
75 |
|
Уровень значимости (р) |
р1-2 = 0,244; р1-3 = 0,004; р2-3 < 0,0001 |
|||||
Таблица 5 - Показатели общей и безрецидивной 2-х летней выживаемости больных раком желудка в зависимости от стадии заболевания
|
Показатели 2-х летней выживаемости |
Стадия рака желудка |
||
|
T1-2N0M01 n = 42 |
T3N0M02 n = 17 |
T2-4N1-2M03 n = 48 |
|
|
Общая (%)
|
100 |
88,2 |
67,4 |
|
Уровень значимости (р) |
р1-2 = 0,142; р1-3 < 0,0001; р2-3 = 0,180 |
||
|
Безрецидивная (%)
|
100 |
58,8 |
52,2 |
|
Уровень значимости (р) |
р1-2 < 0,0001; р1-3 < 0,0001; р2-3 = 0,852 |
||
Обращает на себя внимание тот факт, что при стадии T1-2N0M0 у достаточно большого процента больных (36,4%) в подслизистой основе СОЖ выявлялись дилятированные капилляры. Это может свидетельствовать о морфологической и функциональной неоднородности сосудов, участвующих в неоангиогенезе, что подтверждается результатами исследований отдельных авторов [10, 12, 18]. Что же касается плотности сосудов микроциркуляторного русла в СОЖ на прилежащих к опухоли участках по данным ИГХ, то достоверных отличий по этому показателю в группе больных с метастазами в РЛУ и без метастазов мы не выявили.
В связи с тем, что достоверно более низкие показатели 2-х летней выживаемости наблюдались только при стадиях T3N0M0 – T2-4N1-2M0 решено проанализировать факторы, влияющие на выживаемость в этой группе больных (n=54). Установлено, что безрецидивная 2-х летняя выживаемость значимо коррелировала с гистологическим типом опухоли (r=-0,514, p=0,0009), наличием дилятированных капилляров в ПО СОЖ (r=-0,489, p= 0,01) и наличием АТ в анамнезе (r=0,590, p=0,005), и мало зависела от размеров опухоли (r=-0,199, p= 0,169). В тоже время на общую 2-х летнюю выживаемость влияли размер (r=-0,582, p=0,0001), гистологическая структура опухоли (r=-0,564, p=0,0009), наличие дилятированных сосудов в ПО СОЖ (r=-0,593, p=0,004) и АТ терапии в анамнезе (r=0,743, p=0,005). Данные по показателям общей и безрецидивной выживаемости в зависимости от указанных факторов представлены в табл. № 6-9:
Таблица 6 - Показатели 2-х летней выживаемости больных раком желудка стадии T3N0M0 – T2-4N1-2M0 в зависимости от гистологической структуры опухоли
|
Показатели 2-х летней выживаемости |
Гистологическая структура опухоли |
||||
|
Высокодифференцированная аденокарцинома n=10 |
Умеренно дифференцированная аденокарцинома n=9 |
Низкодифференцированная аденокарцинома n=23 |
Перстневидно-клеточный рак
n=12 |
||
|
Общая (%)
|
100 |
100 |
59,9 |
57,8 |
|
|
Уровень значимости (р) |
р1-3 = 0,04; р1-4=0,04 |
||||
|
Безрецидивная (%)
|
87,5 |
77,8 |
40,9 |
45,4 |
|
|
Уровень значимости (р) |
р1-3= 0,03; р1-4 =0,06; р2-3 = 0,07; р2-4=0,15 |
||||
Таблица 7 - Показатели 2-х летней выживаемости больных раком желудка стадии T3N0M0 – T2-4N1-2M0 в зависимости от размеров опухоли
|
Показатели 2-х летней выживаемости |
Размеры опухоли |
|
|
До 5 см (n=22)
|
Больше 5 см (n=28)
|
|
|
Общая |
95,5% |
51,7% |
|
Уровень значимости (р) |
р = 0,001 |
|
|
Безрецидивная |
68,2% |
46,3% |
|
Уровень значимости (p) |
p=0,09 |
|
Таблица 8 - Показатели 2-х летней выживаемости больных раком желудка стадии T3N0M0 – T2-4N1-2M0 в зависимости от наличия дилятированных капилляров в подслизистой основе СОЖ
|
Показатели 2-х летней выживаемости |
Наличие дилятированных капилляров в ПО СОЖ |
|
|
Нет (n=13)
|
Есть (n=21) |
|
|
Общая |
92,3% |
59,1% |
|
Уровень значимости (р) |
р = 0,03 |
|
|
Безрецидивная |
75,2% |
42,3% |
|
Уровень значимости (р) |
p=0,03 |
|
Таблица 9 - Показатели 2-х летней выживаемости больных раком желудка стадии T3N0M0 – T2-4N1-2M0 в зависимости от наличия АТ в анамнезе
|
Показатели 2-х летней выживаемости |
Антибактериальная терапия в анамнезе |
|
|
Есть (n=14)
|
Нет (n=33) |
|
|
Общая |
92,3% |
65,7% |
|
Уровень значимости (р) |
р = 0,048 |
|
|
Безрецидивная |
78,6% |
51,5% |
|
Уровень значимости (р) |
p=0,06 |
|
Согласно представленным данным показатели общей и безрецидивной 2-х летней выживаемости были достоверно или значимо лучше при кишечном типе РЖ, размерах опухоли до 5 см, отсутствии дилятированных капилляров в ПО СОЖ и наличии АТ в анамнезе. В последнем случае, чтобы исключить влияние на показатели выживаемости гистологического типа опухоли и распространенности опухолевого процесса мы сопоставили результаты лечения в зависимости от этих факторов (табл. 10-11).
Таблица 10. - Показатели 2-х летней выживаемости больных раком желудка стадии T3N0M0 – T2-4N1-2M0 в зависимости от наличия АТ в анамнезе и гистологического типа рака опухоли
|
Гистология |
Наличие АТ в анамнезе |
|||
|
Есть |
Нет |
|||
|
n |
Выживаемость |
n |
Выживаемость |
|
|
Общая |
||||
|
Кишечный тип |
5 |
100% |
12 |
91,7% |
|
Диффузный тип |
9 |
77,7% |
23 |
50% |
|
Уровень значимости (р) |
р3=0,291 |
|||
|
Безрецидивная |
||||
|
Кишечный тип |
5 |
100% |
12 |
75% |
|
Диффузный тип |
9 |
66,7% |
23 |
30,7% |
|
Уровень значимости (р) |
Р3=0,132 |
|||
Таблица 11 - Показатели 2-х летней выживаемости больных раком желудка стадии T3N0M0 – T2-4N1-2M0 в зависимости от наличия АТ в анамнезе и количества лимфоузлов с метастазами
|
Стадия N |
Наличие АТ в анамнезе |
|||
|
Есть |
Нет |
|||
|
n |
Выживаемость |
n |
Выживаемость |
|
|
Общая |
||||
|
N01 |
4 |
75% |
13 |
83,3 |
|
N12 |
3 |
100% |
10 |
100% |
|
N23 |
7 |
85,7 |
12 |
16,7 |
|
Уровень значимости (р) |
р3= 0,014 |
|||
|
Безрецидивная |
||||
|
N01 |
4 |
50% |
13 |
61,5% |
|
N12 |
3 |
100% |
10 |
70% |
|
N23 |
7 |
85,7% |
12 |
16,7% |
|
Уровень значимости (р) |
Р3 =0,014 |
|||
Из полученных данных следует, что у больных с кишечным типом РЖ наличие в анамнезе АТ мало влияло на показатели общей и безрецидивной 2-х летней выживаемости и значительно улучшало их – при диффузном. Из-за небольшого числа наблюдений различия между группами статистически недостоверны. Что же касается связи результатов выживаемости с распространенностью опухолевого процесса, то значимые различия по общей и безрецидивной выживаемости наблюдались только при стадии N2. При проведении анализа морфологических особенностей СОЖ в зависимости от наличия АТ в анамнезе было установлено, что у больных, получавших ее достоверно ниже уровень ПКИ (10,96+3,83 и 8,83+3,58 клеток на УЕП соответственно при отсутствии и наличии АТ в анамнеза, р=0,006) и значительно реже встречаются выраженные атрофические изменения СОЖ (56,7% и 76,4% случаев соответственно при наличии и отсутствии АТ в анамнезе, р=0,061, диаграмма №1).
Диаграмма 1
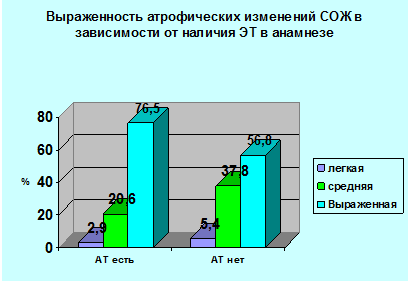
По выраженности кишечной метаплазии, дисплазии желудочного эпителия достоверных отличий в этих группах не получено. Несколько реже наблюдались множественные ЛФ в СОЖ у больных с наличием АТ в анамнезе (38,2% и 57,1% соответственно при наличии и отсутствии АТ в анамнезе, р=0, 118).
Мы полагаем, что улучшение отдаленных результатов лечения у больных стадии T3N0M0 – T2-4N1-2M0 при наличии АТ в анамнезе могут быть объяснены противовоспалительным эффектом проводимой антибактериальной терапии. Известно, что при выраженной воспалительной инфильтрации стромы опухоли и окружающих тканей наблюдается активация процессов неоангиогенеза цитокинами воспаления, что в итоге может способствовать опухолевой прогрессии. Это подтверждают клинические исследования последних лет, которые свидетельствуют о том, что воспалительная инфильтрация стромы опухоли и окружающих тканей может иметь важное прогностическое значение и влиять на отдаленные результаты лечения [1, 2 ,6]. Применение АТ вызывает локальное подавление миграции воспалительных клеток и продукции провоспалительных цитокинов, нейтрализациию активных форм кислорода [14, 15, 17], что может быть причиной полученных различий в лечении больных получавших и не получавших АТ.
Заключение
Таким образом, проведенное исследование показала, что факторами, ассоциированными с лимфогенным метастазированием РЖ, являются размер и гистологический тип опухоли, наличие расширенных сосудов капиллярного типа в подслизистой основе СОЖ. У больных с регионарными метастазами достоверно больше размер опухоли, чаще встречается диффузный тип РЖ и чаще выявляются дилятированные капилляры в ПО СОЖ. Кроме указанных факторов, непосредственно влияющих на отдаленные результаты лечения РЖ, наличие АТ в анамнезе, в связи с предварительным диагнозом гастрит или язва желудка, также достоверно влияло на общую и безрецидивную 2-х летнюю выживаемость больных РЖ, особо значимо улучшая их при диффузном типе РЖ и при стадии N2. Полученные различия в выживаемости больных могут быть объяснены противовоспалительным эффектом АТ, который, на наш взгляд, может способствовать снижению риска лимфогенного и гематогенного метастазирования. Учитывая, что РЖ обычно ассоциирован с инфекцией Helicobacter pylori, ее возможная роль в прогрессии рака желудка требует дополнительных исследований.
Список литературы
Адамян Л.В., Глякин Д.С., Самойлова А.В., Гунин А.Г. Воспалительный процесс в этиологии и патогенезе рака эндометрия // Проблемы репродукции. – 2007. № 1. – С. 21 – 25.
Вторушин С.В., Завьялова М.В. Зависимость гематогенного метастазирования с поражением легких в зависимости от выраженности воспалительной инфильтрации в строме первичного опухолевого узла у больных с разным состоянием менструальной функции // Сибирский онкологический журнал. – 2008. – приложение № 1. – С. 61-62.
Ганцев Ш.Х, Хуснутдинов Ш.М., Парфенов А.Ю. Обоснование объема мультиорганных операций при колоректальном раке // Креативная хирургия и онкология. – 2011. – №1. – С. 4 – 11.
Каракешишева М.Б Интенсивность и клеточный состав инфильтрата слизистой оболочки желудка при предраковых изменениях и раке желудка // Сибирский онкологический журнал. -2005.-Т 16,№4. - С. 63-64.
Луд, А.Н. Значение молекулярно-биологических маркеров при раке желудка и пищевода // Российский биотерапевтический журнал. − 2007. − № 3. − С. 38-42.
Пасечников В.Д., Чуков С.З. Ранний рак верхних отделов пищеварительного тракта // Consilium medicum. - 2002. - Прил. "Диспепсия". - С. 13-18.
Сеньчукова М.А., Стадников А.А., Шевлюк Н.Н., Боков Д.А Морфологическая характеристика сосудов подслизистой оболочки желудка на участках, прилежащих к опухоли, у больных раком желудка // Вопросы онкологии. – 2010. – том 56, №2. – с.40 – 41.
Состояние онкологической помощи населению России в 2007/ Под редакцией Чиссова В.И., Старинского В.В., Петровой Г.В. – М., 2008. – 182 с.
Степанов И.В., Завьялова М.В., Григорьева Е.С., Букурова Ю.А., Афанасьев С.Г., Чердынцева Н.В. Клиникоморфологические и молекулярно-генетические особенности интестинального и диффузного типов карцином желудка // Сибирский онкологический журнал. – 2010. – т. 40, № 4. – С. 56 – 66.
Ding S., Li C., Lin S., Yang Y., Liu D., Han Y., Zhang Y., Li L., Zhou L., Kumar S.. Comparative evaluation of microvessel density determined by CD34 or CD105 in benign and malignant gastric lesions //Hum Pathol. – 2006. – Vol. 37. – № 7. – Р. 861-6.
Dixon M., Genta R., Yardley J. et al. Classification and grading of gastritis // Am.J.Surg.Pathol. – 1996. – №20. – Р. 1161-81.
Eberhard A., Kahlert S., Goede V., Hemmerlein B., Plate K.H., Augustin H.G. Heterogeneity of Angiogenesis and Blood Vessel Maturation in Human Tumors: Implications for Antiangiogenic Tumor Therapies // Cancer Res. – 2000. - № 60. – Р. 1388 – 411.
Erenoglu C., Akin M.L., Uluutku H., Tezcan L., Yildirim S., Batkin A. Angiogenesis predicts poor prognosis in gastric carcinoma // Dig Surg. – 2000. – Vol.17. – № 6. – Р. 581-586.
Hirata T., Ogawa E., Takenaka K., Kawashita F. Подавление кларитромицином синдрома системного воспалительного ответа после операций по поводу рака легкого и молочной железы // Инфекции в хирургии. – 2009. - № 4. – С. 34 – 42.
Mikasa K., Sawaki M., Kita E., Hamada K., Teramoto S., Sakamoto M., Maeda K., Konishi M., Narita N. Significant survival benefit to patients with advanced non-small-cell lung cancer from treatment with clarithromycin // Chemotherapy. – 1997. – Vol.43. – № 4. – P. 288-296.
Manikandan P., Vidjaya Letchoumy P., Prathiba D., Nagini S. Proliferation, angiogenesis and apoptosis-associated proteins are molecular targets for chemoprevention of MNNG-induced gastric carcinogenesis by ethanolic Ocimum sanctum leaf extract // Singapore Med J. – 2007. – Vol.48. – №7. – Р. 645 – 641.
Morris TC, Kettle PJ, Drake M, Jones FC, Hull DR, Boyd K, Morrison A, Clarke P, O'Reilly P, Quinn J. Clarithromycin with low dose dexamethasone and thalidomide is effective therapy in relapsed/refractory myeloma // Br J Haematol. – 2008. – Vol. 143. – № 3. – P. 349-54.
Yan-Dong Wang, Pei Wu, Jia-Ding Mao, He Huang, Fan Zhang Relationship between vascular invasion and microvessel density and micrometastasis // World J Gastroenterol. = 2007. - Vol.13. – № 46. – Р. 6269-6273.
