ЭКОЛОГИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ ОЗЕРА АРАКУЛЬ (ЧЕЛЯБИНСКАЯ ОБЛАСТЬ) ПО РЕЗУЛЬТАТАМ МОНИТОРИНГОВЫХ ИССЛЕДОВАНИЙ 2007 И 2020 ГОДОВ
ЭКОЛОГИЧЕСКАЯ ОЦЕНКА СОСТОЯНИЯ ОЗЕРА АРАКУЛЬ (ЧЕЛЯБИНСКАЯ ОБЛАСТЬ) ПО РЕЗУЛЬТАТАМ МОНИТОРИНГОВЫХ ИССЛЕДОВАНИЙ 2007 И 2020 ГОДОВ
Научная статья
Сибиркина А.Р.1, *, Лихачев С.Ф.2, Двинин Д.Ю.3, Войтович Г.А.4, Трофимова Л.В.5, Маркова Л.М.6, Мулюкова О.Н.7
1-7 Челябинский государственный университет, Челябинск, Россия
* Корреспондирующий автор (sibirkina_alfira[at]mail.ru)
АннотацияВ статье представлены результаты физико-химического анализа воды озера Аракуль, установлено, что вода имеет нейтральную и слабощелочную реакцию среды, что определяет многие физико-химические процессы. Проведенные исследования воды на наличие цист патогенных простейших и возбудителей кишечных инфекций (сальмонеллы, шигеллы) свидетельствует о благоприятной бактериальной обстановке. Показано, что вода озера отличается низким содержанием соединений фенолов, нефтепродуктов и СПАВ, основных ионов тяжелых металлов – меди, свинца, кадмия, железа общего и соединений марганца. Повышенное содержание ионов цинка определяется геологическим строением подстилающих пород и трансграничным переносом с атмосферными осадками.
Ключевые слова: озеро Аракуль, биопродукционные показатели, гидрохимические показатели, ионы тяжелых металлов.
AN ECOLOGICAL ASSESSMENT OF THE STATE OF LAKE ARAKUL (CHELYABINSK REGION) BASED ON THE RESULTS OF MONITORING STUDIES IN 2007 AND 2020
Research article
Sibirkina A.R.1, *, Likhachev S.F.2, Dvinin D.Yu.3, Voytovich G.A.4, Trofimova L.V.5, Markova L.M.6, Mulyukova O.N.7
1-7 Chelyabinsk State University, Chelyabinsk, Russia
* Corresponding author (sibirkina_alfira[at]mail.ru)
AbstractThe article presents the results of the physical and chemical analysis of the water in Lake Arakul. The study establishes that the water has a neutral and slightly alkaline medium reaction, which determines many physical and chemical processes. The conducted studies of the water for the presence of cysts of pathogenic protozoa and pathogens of intestinal infections (Salmonella, Shigella) indicate a favorable bacterial environment. The study demonstrates that the lake water is characterized by a low content of phenol compounds, petroleum products, and synthetic surfactants, the principal ions of heavy metals such as copper, lead, cadmium, total iron, and manganese compounds. The increased content of zinc ions is determined by the geological structure of the underlying rocks and transboundary transport with atmospheric precipitation.
Keywords: Lake Arakul, bio-production indicators, hydrochemical indicators, heavy metal ions.
В связи с интенсивным развитием народного хозяйства возникает важная задача охраны водных ресурсов от загрязнения вредными веществами, предупреждения и прогнозирования поступления вредных веществ в природные водоемы [1]. Не является исключением и озеро Аракуль, расположенное на севере Челябинской области в Каслинском районе, недалеко от населенных пунктов, таких как город Верхний Уфалей, город Снежинск и посёлок Вишнёвогорск. В переводе с башкирского означает «промежуточное озеро» или «озеро между гор». Особо охраняемая природная территория Челябинской области - гидрологический памятник природы (с 21.01.1969 г.). В южной части озеро Аракуль соединяется с озером Малый Каган, а в северной, через речку Аракульку, впадающую в Вязовку, с озером Силач и далее с Каслинской системой озер (Иртяш, Большой Кисегач, Малый Кисегач, Куташи, Малые Касли, Большие Аллаки, Малые Аллаки, Киреты, Сунгуль, Малое Травяное).
Учитывая все возрастающее влияние антропогенного фактора на озеро, возникает острая необходимость изучения условий, в которых формируются ресурсы и состав воды. В соответствии с вышеизложенным, основная цель работы – проведение экологической оценки воды озера Аракуль для получения своевременной и комплексной информации о состоянии особо охраняемой природной территории.
Материалы и методы исследованийОзеро Аракуль расположено в Восточно-Предгорном районе с преобладание озер тектонического происхождения [2], [3]. Озеро занимает углубление округло-продолговатой формы, которое представляет собой древнетектоническое нарушение, видоизмененное экзогенными процессами. Чаша озера преимущественно сложена сланцами аракульской толщи (гранат-слюдяно-кварцевые, слюдяно-кварцевые, амфиболовые, амфибол-слюдяно-кварцевые), гнейсами (биотитовыми, амфиболовыми), реже встречаются кварциты (графитовые). К юго-западной части озера примыкает гранитная интрузия, а с юго-востока серпентинитовый массив. Сланцевые толщи легко подвергаются эрозии, как менее плотные. Водоем относится к эрозионно-тектоническому типу.
Площадь водного зеркала составляет 3,0 кв. км, площадь водосбора – 21,6 кв. км. Отметка уровня воды 299 м (БС). Наибольшая его длина 2,9 км, а ширина примерно 2,3 км. Средняя глубина 7,3 м, а максимальная 12,0 м. По значению максимальной глубины озеро относится к группе глубоких. Объем водной массы составляет 21,9 млн. куб. м. Форма озерной котловины ассиметрично-продолговато-овальная в плане. По соотношению средних и максимальных глубин (показатель равен 0,52) озерная котловина данного водоема занимает переходное положение между параболоидом (пределы показателя 0,3-0,5) и полуэллипсоидом (пределы показателя 0,5-0,7). Длина береговой линии 8,8 км. Береговая линия изрезанная, что характерно для горных озер эрозионно-тектонического происхождения, в юго-восточном секторе береговая линия изрезана сильнее, чем в других.
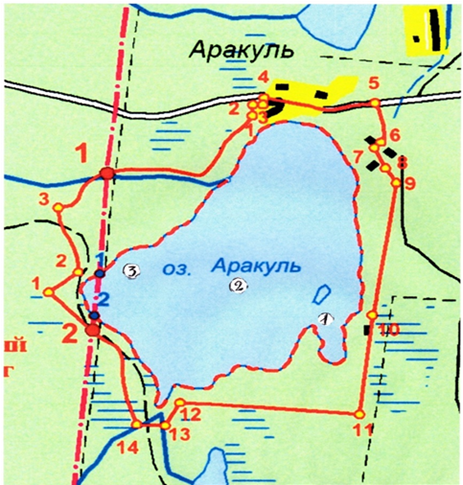
Контрольные станции отбора проб показаны на рис. 1. Отбор проб для анализов производился ежемесячно в период с мая по октябрь 2020 г. На водоеме были установлены 3 постоянные контрольные станции отбора проб (ПП). Координаты контрольных станций (ПП): ПП 1: 55°59.714' N, 60°32.051' E; ПП 2: 55°59.658' N, 60°31.398' E; ПП 3: 55°59.834' N, 60°30.629' E.
Рис. 1 – Контрольные станции отбора проб на озере Аракуль:
граница памятника природы; граница охранной зоны памятника природы; граница муниципальных образований; условные точки границы памятника природы; узловые точки границы охранной зоны памятника природы; поворотные точки границы охранной зоны памятника природы; контрольная станция
Гидрохимические пробы отбирали фторопластовым пробоотборником в соответствии с ГОСТ 17.1.3.07-82 «Охрана природы. Гидросфера. Правила контроля качества воды водоемов и водотоков».
Анализ проб воды осуществлялся в аккредитованном центре Общество с ограниченной ответственностью «Уральская комплексная лаборатория промышленного и гражданского строительства» согласно «Федеральному перечню методик выполнения измерений, допущенных к применению при выполнении работ в области мониторинга загрязнения окружающей природной среды» (РД 52.18.595-96).
Результаты и их обсуждениеФормирование биохимического состава природных водоемов зависит от факторов, как непосредственно влияющих на водную среду, так и определяющих условия, в которых протекает взаимодействие живых организмов и веществ с водой [4]. О наличии биологического загрязнения природных водоемов судят по наличию в воде цист патогенных простейших, являющихся промежуточным этапом развития паразитов во время перехода от носителя к носителю, формы, находящейся в ожидании вплоть до заражения. Исследования 2020 г. показали, что ни в один из исследованных периодов в воде озера Аракуль цист патогенных простейших не обнаружено. Также в воде озера отсутствуют возбудители кишечных инфекций (сальмонеллы, шигеллы), что свидетельствует о благоприятной бактериальной обстановке (табл. 1).
Таблица 1 – Основные биопродукционно-гидрохимические показатели озера Аракуль, май-октябрь 2020 г.
| Концентрация | Ед. измер. | Месяц | Контрольная станция | Р/хоз. норм. | ||
| ПП 1 | ПП 2 | ПП 3 | ||||
| Цисты патогенных простейших | экз./25 дм3 | 23.06.2020 | 0 | 0 | 0 | Не допуск. |
| 22.07.2020 | 0 | 0 | 0 | |||
| 25.08.2020 | 0 | 0 | 0 | |||
| 14.09.2020 | 0 | 0 | 0 | |||
| Возбудители кишечных инфекций (сальмонеллы, шигеллы) | отсутствие / наличие | 23.06.2020 | отсутствие | отсутствие | отсутствие | Не допуск. |
| 22.07.2020 | отсутствие | отсутствие | отсутствие | |||
| 25.08.2020 | отсутствие | отсутствие | отсутствие | |||
| Фенолы | мг/дм3 | 22.05.2020 | Менее 0,0005 | Менее 0,0005 | Менее 0,0005 | Не более 0,001 |
| 23.06.2020 | Менее 0,0005 | Менее 0,0005 | Менее 0,0005 | |||
| 22.07.2020 | Менее 0,0005 | Менее 0,0005 | Менее 0,0005 | |||
| 25.08.2020 | Менее 0,0005 | Менее 0,0005 | Менее 0,0005 | |||
| 14.09.2020 | Менее 0,0005 | Менее 0,0005 | Менее 0,0005 | |||
| 12.10.2020 | Менее 0,0005 | Менее 0,0005 | Менее 0,0005 | |||
| ПАВ анионные | мг/дм3 | 22.05.2020 | Менее 0,01 | Менее 0,01 | Менее 0,01 | Не норм. |
| 23.06.2020 | Менее 0,01 | Менее 0,01 | Менее 0,01 | |||
| 22.07.2020 | Менее 0,01 | Менее 0,01 | Менее 0,01 | |||
| 25.08.2020 | Менее 0,01 | Менее 0,01 | Менее 0,01 | |||
| 14.09.2020 | Менее 0,01 | Менее 0,01 | Менее 0,01 | |||
| 12.10.2020 | Менее 0,01 | Менее 0,01 | Менее 0,01 | |||
| ПАВ катионные | мг/дм3 | 22.05.2020 | Менее 0,05 | Менее 0,05 | Менее 0,05 | Не норм. |
| 23.06.2020 | Менее 0,05 | Менее 0,05 | Менее 0,05 | |||
| 22.07.2020 | Менее 0,05 | Менее 0,05 | Менее 0,05 | |||
| 25.08.2020 | Менее 0,05 | Менее 0,05 | Менее 0,05 | |||
| 14.09.2020 | Менее 0,05 | Менее 0,05 | Менее 0,05 | |||
| 12.10.2020 | Менее 0,05 | Менее 0,05 | Менее 0,05 | |||
| Нефтепродукты | мг/дм3 | 22.05.2020 | Менее 0,02 | Менее 0,02 | Менее 0,02 | Не более 0,05 |
| 23.06.2020 | Менее 0,02 | Менее 0,02 | Менее 0,02 | |||
| 22.07.2020 | Менее 0,02 | Менее 0,02 | Менее 0,02 | |||
| 25.08.2020 | Менее 0,02 | Менее 0,02 | Менее 0,02 | |||
| 14.09.2020 | Менее 0,02 | Менее 0,02 | Менее 0,02 | |||
| 12.10.2020 | Менее 0,02 | Менее 0,02 | Менее 0,02 | |||
| Железо общее | мг/дм3 | 22.05.2020 | 0,077±0,021 | 0,078±0,022 | 0,077±0,021 | Не более 0,1 |
| 23.06.2020 | 0,068±0,020 | 0,055±0,018 | 0,058±0,018 | |||
| 22.07.2020 | Менее 0,050 | 0,089±0,023 | Менее 0,050 | |||
| 25.08.2020 | Менее 0,050 | Менее 0,050 | Менее 0,050 | |||
| 14.09.2020 | Менее 0,050 | Менее 0,050 | Менее 0,050 | |||
| 12.10.2020 | 0,063±0,019 | 0,067±0,020 | 0,064±0,019 | |||
| Медь | мг/дм3 | 22.05.2020 | Менее 0,0010 | Менее 0,0010 | Менее 0,0010 | Не более 0,001 |
| 23.06.2020 | Менее 0,0010 | Менее 0,0010 | Менее 0,0010 | |||
| 22.07.2020 | Менее 0,0010 | Менее 0,0010 | Менее 0,0010 | |||
| 25.08.2020 | Менее 0,0010 | Менее 0,0010 | Менее 0,0010 | |||
| 14.09.2020 | Менее 0,0010 | Менее 0,0010 | Менее 0,0010 | |||
| 12.10.2020 | Менее 0,0010 | Менее 0,0010 | Менее 0,0010 | |||
| Цинк | мг/дм3 | 22.05.2020 | 0,0116±0,0039 | 0,033±0,011 | 0,0181±0,0062 | Не более 0,01 |
| 23.06.2020 | 0,048±0,016 | 0,083±0,028 | 0,044±0,015 | |||
| 22.07.2020 | 0,047±0,016 | 0,030±0,010 | 0,035±0,012 | |||
| 25.08.2020 | 0,048±0,016 | Менее 0,0050 | 0,056±0,019 | |||
| 14.09.2020 | 0,049±0,017 | 0,056±0,019 | Менее 0,0050 | |||
| 12.10.2020 | 0,0128±0,0044 | 0,0103±0,0035 | 0,0083±0,0028 | |||
Окончание таблицы 1 – Основные биопродукционно-гидрохимические показатели озера Аракуль, май-октябрь 2020 г.
| Концентрация | Ед. измер. | Месяц | Контрольная станция | Р/хоз. норм | ||
| ПП 1 | ПП 2 | ПП 3 | ||||
| Марганец | мг/дм3 | 22.05.2020 | Менее 0,0020 | Менее 0,0020 | 0,0080±0,016 | Не более 0,01 |
| 23.06.2020 | 0,0157±0,0031 | 0,0104±0,0021 | Менее 0,0020 | |||
| 22.07.2020 | Менее 0,0020 | Менее 0,0020 | 0,0075±0,0015 | |||
| 25.08.2020 | 0,0157±0,0031 | Менее 0,0020 | Менее 0,0020 | |||
| 14.09.2020 | Менее 0,0020 | Менее 0,0020 | Менее 0,0020 | |||
| 12.10.2020 | 0,0073±0,0015 | 0,0097±0,0019 | Менее 0,0020 | |||
| Свинец | мг/дм3 | 22.05.2020 | Менее 0,0020 | 0,0056±0,0015 | Менее 0,0020 | Не более 0,006 |
| 23.06.2020 | Менее 0,0020 | Менее 0,0020 | Менее 0,0020 | |||
| 22.07.2020 | Менее 0,0020 | Менее 0,0020 | Менее 0,0020 | |||
| 25.08.2020 | Менее 0,0020 | Менее 0,0020 | Менее 0,0020 | |||
| 14.09.2020 | Менее 0,0020 | Менее 0,0020 | Менее 0,0020 | |||
| 12.10.2020 | Менее 0,0020 | Менее 0,0020 | Менее 0,0020 | |||
| Кобальт | мг/дм3 | 22.05.2020 | Менее 0,0025 | Менее 0,0025 | Менее 0,0025 | Не более 0,0005 |
| 23.06.2020 | Менее 0,0025 | Менее 0,0025 | Менее 0,0025 | |||
| 22.07.2020 | Менее 0,0025 | Менее 0,0025 | Менее 0,0025 | |||
| 25.08.2020 | Менее 0,0025 | Менее 0,0025 | Менее 0,0025 | |||
| 14.09.2020 | Менее 0,0025 | Менее 0,0025 | Менее 0,0025 | |||
| 12.10.2020 | Менее 0,0025 | Менее 0,0025 | Менее 0,0025 | |||
| Никель | мг/дм3 | 22.05.2020 | Менее 0,0050 | Менее 0,0050 | Менее 0,0050 | Не более 0,01 |
| 23.06.2020 | Менее 0,0050 | Менее 0,0050 | Менее 0,0050 | |||
| 22.07.2020 | Менее 0,0050 | Менее 0,0050 | Менее 0,0050 | |||
| 25.08.2020 | Менее 0,0050 | Менее 0,0050 | Менее 0,0050 | |||
| 14.09.2020 | Менее 0,0050 | Менее 0,0050 | Менее 0,0050 | |||
| 12.10.2020 | Менее 0,0050 | Менее 0,0050 | Менее 0,0050 | |||
| Кадмий | мг/дм3 | 22.05.2020 | Менее 0,00020 | Менее 0,00020 | Менее 0,00020 | Не более 0,0008 |
| 23.06.2020 | Менее 0,00020 | Менее 0,00020 | Менее 0,00020 | |||
| 22.07.2020 | Менее 0,00020 | Менее 0,00020 | Менее 0,00020 | |||
| 25.08.2020 | Менее 0,00020 | Менее 0,00020 | Менее 0,00020 | |||
| 14.09.2020 | Менее 0,00020 | Менее 0,00020 | Менее 0,00020 | |||
| 12.10.2020 | Менее 0,00020 | Менее 0,00020 | Менее 0,00020 | |||
| 25.08.2020 | Менее 0,02 | Менее 0,02 | Менее 0,02 | |||
| 14.09.2020 | Менее 0,02 | Менее 0,02 | Менее 0,02 | |||
| 12.10.2020 | Менее 0,02 | Менее 0,02 | Менее 0,02 | |||
Серьезной проблемой становится нефтяное загрязнение, нефтепродукты поступают в воды с хозяйственно-бытовыми стоками, некоторые количества углеводородов поступают в воду в результате прижизненных и посмертных выделений растительными и животными организмами. В 2007 г. соединений нефтепродуктов в воде озера не было обнаружено, а в 2020 г. их содержание составляло менее 0,02 мг/дм3 (табл. 1), т.е. уже 40 % от допустимых не более 0,05 мг/дм3. Основная причина повышение уровня нефтяного загрязнение – это проезд автотранспорта к прибрежной территории, появление стихийных мест отдыха с установкой палаточных городков в водоохраной зоне, использование плавательных средств с бензиновыми и дизельными двигателями.
Обширную группу соединений, различных по своей структуре и относящихся к разным классам, образуют СПАВ, в настоящее время показатель не нормируется ПДК. Для процесса естественного самоочищения от СПАВ наиболее благоприятна нейтральная или слабощелочная среды, а вода озера Аракуль относится к слабощелочной: рН воды в 2007 г составлял 7,4-8,1; в 2020 г. – 6,3-7,7, что и нашло отражение в содержании СПАВ в воде озера. В 2007 г. содержание СПАВ в воде озера не было обнаружено, в 2020 г. – находилось в пределах менее 0,01 мг/дм3 для анионных ПАВ, и менее 0,05 мг/дм3 для катионных ПАВ (табл. 1).
В природных водах в результате естественных процессов метаболизма водных организмов, при биохимическом распаде и трансформации органических веществ могут образовываться фенолы, относящиеся к токсичным загрязняющим веществам третьего класса опасности. Антропогенным источником поступления фенолов в водные объекты являются сточные воды. В 2007 г. содержание фенолов в воде озера находилось в пределах от 0,6 до 0,8 ПДК (табл. 1), в 2020 г. в водах озера содержание растворимых форм фенолов несколько уменьшилось и составляло менее 0,0005 мг/дм3 (0,5 ПДК).
К приоритетным загрязнителям водных экосистем относятся соединения тяжелых металлов [5], данные о содержании тяжелых металлов в воде озера Аракуль в 2020 г. приведены в таблице 1. В 2007 г. содержание железа общего составило 0,018 мг/дм3 или 0,2 ПДК. В 2020 г. среднее содержание железа общего составило 0,064 мг/дм3, при этом в 44,4 % проб содержание составило менее 0,050 мг/дм3, в остальных пробах – не превысило значений 0,089 мг/дм3 (0,5-0,9 ПДК), т.е. наблюдается увеличение концентрации в 2,5-4,5 раза. Следует отметить, что ионы железа всегда присутствуют в природных водах, за счет, выщелачивая из горных пород, слагающих дно водоема. Главными источниками соединений железа в поверхностных водах являются процессы химического выветривания горных пород, сопровождающиеся их механическим разрушением и растворением. В процессе взаимодействия с содержащимися в природных водах минеральными и органическими веществами образуется сложный комплекс соединений железа, находящихся в воде в растворенном, коллоидном и взвешенном состоянии [6]. Являясь биологически активным элементом, ионы железа в определенной степени влияет на интенсивность развития фитопланктона и качественный состав микрофлоры в водоеме. Механизм вредоносного действия железа на рыб заключается в том, что железо в виде гидроксида Fe(OH)3 осаждается на слизистой оболочке жабр, закупоривает и разъедает их. Этот процесс приводит к массовой гибели рыб и других гидробионтов по причине кислородного голодания [6], [7].
В природных водах Урала содержание меди колеблется от 0,001 до 0,09 мг/дм3, ПДК меди составляет 0,001 мг/дм3. По данным исследований 2007 г. содержание растворимых соединений меди составляло от 0,0001 до 0,0053 мг/дм3 (до 5,3 ПДК). В 2020 г. наблюдается значительное снижение уровня содержания ионов меди, в 100 % проб за весь период исследования содержание не превысило значений менее 0,0010 мг/дм3, т.е. превышений нормативов не выявлено. Наблюдаемое снижение концентраций ионов меди в воде озера в 2020 г. может быть следствием проведенных мероприятий по стабилизации экологической ситуации в районе исследования или интенсивным развитием фитопланктона, который активно сорбирует медь [8]. Повышенные, но не летальные концентрации меди способны стимулировать рост сине-зеленых водорослей в водоеме, тем самых вызывают «цветение» водоема. Последнее сопровождается сильными заморными явлениями. Физиологическая активность меди связана главным образом с включением ее в состав активных центров окислительно-восстановительных ферментов, хронический избыток соединений меди вызывает остановку роста, снижение содержания гемоглобина, поражению печени, почек и мозга гидробионтов [7], [8].
В природных водах уральских озер цинк встречается редко, тем не менее, в 83,3 % проб 2020 г. содержание ионов цинка составило от 0,013 до 0,083 мг/дм3 или 1,3-8,3 ПДК. Лишь в 16,7 % проб 2020 г. содержание ионов цинка находилось в пределах от менее 0,005 мг/дм3 до 0,008 мг/дм3 (0,5-0,8 ПДК). Высокие уровни содержания соединений цинка в воде озера наблюдались и в 2007 г. до 0,013 мг/дм3 (до 1,3 ПДК), что ниже современного содержание в 6,4 раза. Цинк попадает в озерные воды в результате протекающих процессов разрушения и растворения горных пород и минералов, относится к числу активных микроэлементов, влияющих на рост и нормальное развитие растительных организмов, в повышенной концентрации опасен для гидробионтов, накапливаясь и в печени и скелете [6], [7]. Токсическое действие связано с нарушением синтеза металлопротеинов и других металлорганических соединений.
Для водных растений и микроорганизмов широко доступны ионы марганца, содержание которого в гидрокарбонатных водах озер Урала колеблется в пределах 0,001-0,050 мг/дм3. За период с 2007 г., когда концентрации ионов марганца в воде озера достигали уровня 0,022 мг/дм3 (2,2 ПДК), и по настоящее время содержание ионов марганца уменьшилось в 1,4 раза. Исследования 2020 г. показали, что содержание ионов марганца для 61,1 % проб составило менее 0,002 мг/дм3, т.е. всего 0,2 ПДК, для 27,8 % проб – не превышало значений 0,0073-0,0097 мг/дм3 и только для двух проб в июне зафиксировано превышение до 1,6 ПДК. Марганец относится к одним из наиболее распространенных элементов в земной коре и отличается высокой лабильностью, способен легко переходить в воду, его миграция в водные объекты высока как за счет прямых поступлений, так и за счет опосредованных вторичными факторами, например, кислотными осадками. Значительные количества марганца поступают в природную поверхностную воду в процессе разложения водных животных и растительных организмов [9]. Концентрация марганца в поверхностных водах подвержена сезонным колебаниям, факторами, определяющими изменения концентраций марганца, являются соотношение между поверхностным и подземным стоком, интенсивность потребления его при фотосинтезе, разложение фитопланктона, микроорганизмов и высшей водной растительности, а также процессы осаждения его на дно водных объектов [6]. Для водных организмов соединения марганца относительно мало токсичны – ЛК50 для дафнии 50 мг/ дм3, для форели - 100 мг/ дм3, карпа - 650 мг/ дм3 [7].
Практически повсеместно в природных водах встречаются водорастворимые соединения свинца (первый класс опасности). В типичных гидрокарбонатных водах содержание их изменяется от следов до 0,05 мг/дм3. Следует отметить, что за период с 2007 г. произошло значительное снижение концентрации ионов свинца, по данным мониторинга 2007 г. содержание растворимых соединений свинца находилось в пределах 0,741 мг/дм3 (0,2 ПДК) до 7,509 мг/дм3 (1,3 ПДК). В 2020 г. в 94,4 % проб содержание соединений свинца не превышало 0,002 мг/дм3, а в 5,6 % (1 проба) содержание соединений свинца составило 0,9 ПДК. Для водных растений свинец токсичен практически во всех концентрациях. Механизм действия основан на связывании ионов свинца с остатками цистеина в HS-содержащих ферментах, приводящее к ингибированию их активности, а также в образовании устойчивых комплексов с карбонильными и фосфатными группами белков и нуклеиновых кислот. При попадании в организм гидробионтов соединения свинца концентрируется в костях (до 95% поступившего свинца), откуда позже высвобождаются через выделительную систему, приводя к осложнению интоксикации организма. Негативное действие соединений свинца связано с влиянием на почки, печень, нервную систему и органы кровообразования, нарушение синтеза небелковой части гемоглобина [7], [10].
Соединения кадмия в природные воды поступают при выщелачивании почв, в результате разложения водных организмов, способных накапливать соединения кадмия. За счет процессов сорбции, выпадения в осадок гидроксида и карбоната кадмия и потребления их водными организмами происходит понижение концентрации растворенных соединений кадмия. Высокая токсичность соединений кадмия влияет на процессы жизнедеятельности животных, оказывая нефротоксическое, цитотоксическое и гепатотоксическое действия, в результате угнетения активности тиоловых ферментов за счет соединения ионов кадмия с HS-группами ферментов и снижения скорости синтеза белка в печени [6], [7]. Исследования 2020 г. показали, за период с 2007 г. по 2020 г. произошло увеличение концентрации водорастворимых форм соединений кадмия в 2,5 раза, но уровень содержания соответствует нормативам качества воды. В 2007 г. содержание соединений кадмия составляло от 0,000023 до 0,00008 мг/дм3 (0,1-0,1 ПДК). В 2020 г. концентрации соединений кадмия за весь период отбора проб и во всех точках составили менее 0,00020 мг/дм3, или 0,25 ПДК.
Выводы
- Содержание в воде ионов тяжелых металлов (меди, свинца, кадмия) значительно ниже предельно допустимых, следовательно, отсутствует сток промышленных вод в озерные воды.
- Отсутствие промышленных стоков в озерные воды подтверждается и концентрациями общего железа и марганца, содержание которых в воде значительно ниже их ПДК.
- Повышенные концентрации ионов цинка могут быть следствием геологического строения подстилающих пород, либо трансграничным переносом атмосферными осадками.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Шамсиев М. Н. Исследование процесса распространения загрязнения при фильтрации воды под гидросооружением со шпунтом / М. Н. Шамсиев, А. Н. Зиннатуллина, Р. И. Ибятов // Водные ресурсы. – 2018. – Т. 45. - № 4. - С. 416–420. DOI: 10.1134/S0321059618040193.
- Андреева М. А. Озера Среднего и Южного Урала. / М. А. Андреева. – Челябинск: Южно-Уральское кн. изд-во, 1973. - 269 с.
- Челябинская область. Атлас. / под ред. проф. В. В. Латюшина. - Изд. 3-е. – Челябинск: Абрис, 2010. - 32 с.
- Огрызкова О.С. Сезонные изменения миграции содержания марганца в воде Новосибирского водохранилища. / О.С. Огрызкова, А.Н. Эйрих, Т.Г. Серых, Е.Ю. // Изв. АГУ. - 2014. - С. 176–180.
- Сибиркина А.Р. Техногенное загрязнение медью водосборной площади бассейна реки Иртыш в пределах территории Казахстана. / А.Р. Сибиркина // Геохимия. - 2000. - №2. - С. 187-196.
- Мур Д.В. Тяжелые металлы в природных водах: Контроль и оценка влияния. / Дж. В. Мур, С. Рамамурти; Пер. с англ. Д. В. Гричука и др.; Под ред. Ю. Е. Саета. М.: Мир, 1987. - 285, [1] с.
- Афанасьева Л.С. Экологическая химия: учебник для студ. сред. проф. учеб. заведений / Л.С. Афанасьева. М.: Издательский центр «Академия», 2006. - 224 с.
- Новиков В.В. Содержание разных форм меди и цинка в воде, донных отложениях и прибрежных почвах волгоградского водохранилища у города Волжский. / В.В. Новиков, М.Ю. Пучков, В.П. Зволинский. // Современные проблемы науки и образования. - 2013. - №3; [Электронный ресурс]. – URL: http:// https://www.science-education.ru/ru/article/view?id=9558 (дата обращения 26.02.2021)
- Дударева И.А. Марганец в воде и донных отложениях нижнего течения реки Иртыш. / И.А. Дударева, Г.С. Алимова, А.Ю. Токарева. // Успехи современного естествознания. – 2017. – № 8. – С. 70-74; [Электронный ресурс]. – URL: http://natural-sciences.ru/ru/article/view?id=36523 (дата обращения: 31.10.2020).
- Вредные химические вещества. Неорганические соединения I-IV групп: Справ. изд./ Под ред. В.А. Филова и др. Л.: Химия,1988. - 512 с.
Список литературы на английском языке / References in English
- SHamsiev M. N. Issledovanie processa rasprostraneniya zagryazneniya pri fil'tracii vody pod gidrosooruzheniem so shpuntom [Study of the process of contamination spreading during water filtration under a hydraulic structure with a tongue] / M. N. SHamsiev, A. N. Zinnatullina, R. I. Ibyatov // Vodnye resursy [Water resources]. – 2018. – Vol. 45. - № 4. - P. 416–420. DOI: 10.1134/S0321059618040193. [in Russian]
- Andreeva M. A. Ozera Srednego i YUzhnogo Urala. [Lakes of the Middle and Southern Urals]. / M. A. Andreeva. – CHelyabinsk: South Ural pr. publishing house, 1973. - 269 p. [in Russian]
- CHelyabinskaya oblast'. Atlas. [Chelyabinsk region. Atlas]. / ed. prof. V. V. Latyushina. - 3-rd edition. – Chelyabinsk: Abris, 2010. - 32 p. [in Russian]
- Ogryzkova O.S. Sezonnye izmeneniya migracii soderzhaniya marganca v vode Novosibirskogo vodohranilishcha. [Seasonal changes in the migration of manganese content in the water of the Novosibirsk reservoir] / O.S. Ogryzkova, A.N. Ejrih, T.G. Seryh, E.YU. // Izv. AGU. - 2014. - P. 176–180. [in Russian]
- Sibirkina A.R. Tekhnogennoe zagryaznenie med'yu vodosbornoj ploshchadi bassejna reki Irtysh v predelah territorii Kazahstana. [Technogenic pollution by copper of the catchment area of the Irtysh river basin within the territory of Kazakhstan]. / A.R. Sibirkina // Geohimiya [Geochemistry]. - 2000. - №2. - P. 187-196. [in Russian]
- Mur D.V. Tyazhelye metally v prirodnyh vodah: Kontrol' i ocenka vliyaniya. [Heavy metals in natural waters: Monitoring and impact assessment] / Dzh. V. Mur, S. Ramamurti; transl. from Eng. D. V. Grichuka et al.; ed. YU. E. Saeta. M.: Mir, 1987. – 285 p. [in Russian]
- Afanas'eva L.S. Ekologicheskaya himiya.: uchebnik dlya stud. sred. prof. ucheb. zavedenij. [Environmental chemistry: textbook for students. Wednesday prof. study. Institutions] / L.S. Afanas'eva. M.: Publishing center «Akade-miya», 2006. - 224 p. [in Russian]
- Novikov V.V. Soderzhanie raznyh form medi i cinka v vode, donnyh otlozheniyah i pribrezhnyh pochvah volgogradskogo vodohranilishcha u goroda Volzhskij. [The content of various forms of copper and zinc in water, bottom sediments and coastal soils of the Volgograd reservoir near the city of Volzhsky] / V.V. Novikov, M.YU. Puchkov, V.P. Zvolinskij. // Sovremennye problemy nauki i obrazovaniya [Modern problems of science and education]. - 2013. - №3; [Electronic resource]. – URL: http:// https://www.science-education.ru/ru/article/view?id=9558 (accessed 26.02.2021) [in Russian]
- Dudareva I.A. Marganec v vode i donnyh otlozheniyah nizhnego te-cheniya reki Irtysh. [Manganese in water and bottom sediments of the lower reaches of the Irtysh River]. / I.A. Dudareva, G.S. Alimova, A.YU. Tokareva. // Uspekhi sovremennogo estestvoznaniya [Successes of modern natural science]. – 2017. – № 8. – P. 70-74; [Electronic resource]. – URL: http://natural-sciences.ru/ru/article/view?id=36523 (accessed: 31.10.2020). [in Russian]
- Vrednye himicheskie veshchestva. Neorganicheskie soedineniya I-IV grupp: Sprav. izd. [Harmful chemicals. Inorganic compounds of group’s I-IV: Ref. ed.]. / ed. V.A. Filova et al. L.: Himiya, 1988. - 512 p. [in Russian]