УСТАНОВЛЕНИЕ ЗОН ГЕТЕРОФАЗНЫХ РЕАКЦИЙ
Пушкин А.А.1, Римкевич В.С.2
1ORCID: 0000-0002-4579-0507, Кандидат физико-математических наук, 2ORCID: 0000-0001-7391-6835, Кандидат геолого-минералогических наук, Институт геологии и природопользования дальневосточного отделения Российской академии наук
УСТАНОВЛЕНИЕ ЗОН ГЕТЕРОФАЗНЫХ РЕАКЦИЙ
Аннотация
Данная работа посвящена вопросу установления зон гетерофазных реакций. Определение зон реакций для каждой температуры производится нами по минимуму погрешностей аппроксимаций экспериментальных данных различными функциями. В качестве пробных функций выбраны четыре вида уравнений: степенная функция, экспоненциальный закон и уравнения Авраами и Праута-Томпкинса. В случае равенства погрешностей аппроксимаций для двух функций предпочтение отдается функции, погрешность константы скорости для которой меньше. В качестве примера рассматривается реакция фторирования анортозитов гидродифторидом аммония. Результат определения зон реакций для данного примера согласуется с результатом определения по традиционному критерию (по величине энергии активации).
Ключевые слова: зона реакции, погрешность аппроксимации, погрешность константы скорости, гидродифторид аммония, энергия активации.
Pushkin A.A.1, Rimkevich V.S.2
1PhD in Physics and Mathematics, 2PhD in Geology and Mineralogy, Institute of geology and nature management of Far Eastern Branch of RAS
THE DETERMINATION OF HETEROPHASE REACTIONS ZONES
Abstract
This work is devoted to the question of heterophase reactions zones identification. The determination of the reactions zones is executed by us by minimum of errors of experimental data approximations by various functions. The four functions are selected as probes: the power function, exponential law and Avraami and Prout-Tompkins equations. Preference is given to the function with less rate constants errors in the case of equality of approximation errors. The reaction of fluorination of anorthosites by ammonia hydrodifluoride is given as an example. The result of reactions zones determination is agreed with result received by the traditional criterion (by value of activation energy).
Keywords: reaction zone, approximation error, rate constant error, ammonia hydrofluoride, activation energy.В Институте геологии и природопользования ДВО РАН разрабатывается фторидная технология переработки силикатного сырья. С целью проведения термодинамических (apriori) [1, с. 108] и кинетических (aposteriori) [2, с. 37] расчетов гетерофазных реакций в ходе технологического процесса создана расчетная программа на языке программирования Visual Basic.
Известно, что скорость гомофазных реакций определяется столкновениями между частицами. Результаты столкновений зависят от энергий частиц, точнее, от разницы между энергией активированного комплекса и средней энергией частиц. От столкновений скорость реакции зависит и в случае гетерофазных реакций. Если скорость реакции не только зависит, но и определяется столкновениями, то говорят, что такая реакция протекает в кинетической зоне. В случае, когда ход реакции определяется диффузией, говорят, что реакция протекает в диффузионной зоне.
Таким образом, гетерофазные реакции протекают в две стадии: диффузия частиц через межфазную границу и химическое взаимодействие между частицами. Каждая из стадий оказывает сопротивление протеканию реакции. Сопротивлением реакции называется величина, обратная её скорости. Поэтому эффективное сопротивление гетерофазной реакции между веществами А и В складывается из сопротивления кинетической и диффузионной стадий и, следовательно, справедливо соотношение
Если первое слагаемое в выражении (1) много больше второго, то сопротивление кинетической стадии много больше сопротивления стадии диффузии, следовательно, скорость много меньше, а продолжительность - много больше. Тогда продолжительность этой стадии определяет продолжительность двухстадийной реакции и, следовательно, реакция протекает в кинетической зоне.
Если первое слагаемое значительно меньше второго, то сопротивление кинетической стадии много меньше, скорость много больше и продолжительность много меньше продолжительности стадии диффузии. Следовательно, продолжительность гетерофазной реакции в этом случае определяется продолжительностью стадии диффузии, т.е., реакция протекает в диффузионной зоне.
Если оба слагаемых сопоставимы по величине, то реакция протекает в переходной зоне (обе стадии оказывают одинаковые сопротивления ходу реакции и одинаковое влияние на ход реакции). В переходной зоне справедливо отношение равенства скоростей диффузии и химической реакции. Рассмотрим диффузию вещества А через контактную площадку S между зернами веществ А и В (см. рис. 1). Скорость диффузии в переходном слое из закона Фика (произведение коэффициента диффузии на градиент концентрации и на площадь контактной площадки) приравняем к скорости химической реакции
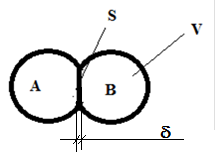
Рис. 1 - Контакт двух зерен веществ А и В: d - толщина переходного слоя в зоне контакта, S – площадь контакта
![]() (2)
(2)
где D – коэффициент диффузии, S – площадь контакта зерен, V - объем зерна В, СА и СВ – концентрации фаз А и В.
Полагая, что концентрация вещества А уменьшается до 0 в пределах толщины переходного слоя δ, представим градиент в виде простой дроби
![]() (3)
(3)
где δ – толщина зоны контакта.
Сократив на концентрацию вещества А, разделив обе части на объем V и сгруппировав множители, производя замену отношения коэффициента диффузии D к толщине зоны контакта δ коэффициентом массоотдачи β, а отношение контактной площадки S к объему зоны контакта V – удельной поверхностью контакта f, получим в переходной области выражение
![]() (4)
(4)
В кинетической зоне левая часть выражения (4) значительно больше, чем правая, а первое слагаемое в правой части (1) значительно больше, чем второе. Процессы, протекающие в кинетической стадии, подчиняются степенному закону: скорость реакции связана с концентрацией формулой ![]() , где w – скорость реакции, С – концентрация вещества, m – порядок реакции, k – константа скорости.
, где w – скорость реакции, С – концентрация вещества, m – порядок реакции, k – константа скорости.
В этом случае, вследствие высокой скорости диффузии частицы имеют возможность контакта между собой, постоянно сталкиваясь.
В диффузионной зоне первое слагаемое в формуле (1) много меньше, чем второе, а, следовательно, и правая часть формулы (4) много больше, чем левая.
Процессы диффузии протекают медленно и занимают большую часть времени реакции. Диффузионные процессы описываются одним из следующих топохимических уравнений, экспоненциальным ![]() , Праута-Томпкинса
, Праута-Томпкинса ![]() или Авраами
или Авраами ![]() . Во всех этих уравнениях α – степень превращения вещества.
. Во всех этих уравнениях α – степень превращения вещества.
Следовательно, эффективная константа скорости гетерофазной реакции в диффузионной зоне зависит от диффузионных характеристик. Если в формуле (1) пренебречь первым слагаемым, то выражение для эффективной константы скорости с учетом формулы (3) приобретет вид
![]() (6)
(6)
Таким образом, гетерофазная реакции может определяться как столкновениями молекул, так и диффузией. Традиционным методом определения зоны реакции считается количественное сравнение энергий активации. Считается, что если энергия активации имеет величину меньше или порядка 20кДж/моль, то реакция протекает в диффузионной зоне. Если реакция имеет энергию активации порядка (50 – 200кДж/моль), то она протекает в кинетической зоне [4, с. 346].
В данной работе для решения вопроса о механизме реакции мы вычисляем погрешность аппроксимации экспериментальных данных теоретическими кривыми. Используются четыре типа кривых: степенная, Авраами, экспоненциальная и Праута-Томпкинса. Параметры кривых (константы скорости, порядки реакции) вычисляются путем обработки экспериментальных данных. Численно погрешность аппроксимации мы оцениваем как корень квадратный из суммы квадратов разности между экспериментальными значениями ![]() и теоретическими значениями
и теоретическими значениями ![]() для каждой из кривых, деленной на количество точек n:
для каждой из кривых, деленной на количество точек n:
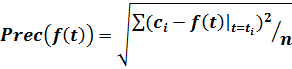 (7)
(7)
Расчеты проводились при помощи расчетной программы. Отбор функций, которые дают лучшую аппроксимацию, осуществляется автоматически по двум параметрам: первый параметр – погрешность аппроксимации, второй – погрешность константы скорости. В случае равенства погрешностей аппроксимации, программа предпочтение отдает той функции, погрешность константы скорости у которой меньше.
Выбранная функция определяет механизм реакции для данной температуры, а по механизму реакции – определяем зону реакции: при степенном законе – кинетическая, а при других трех уравнениях – диффузионная.
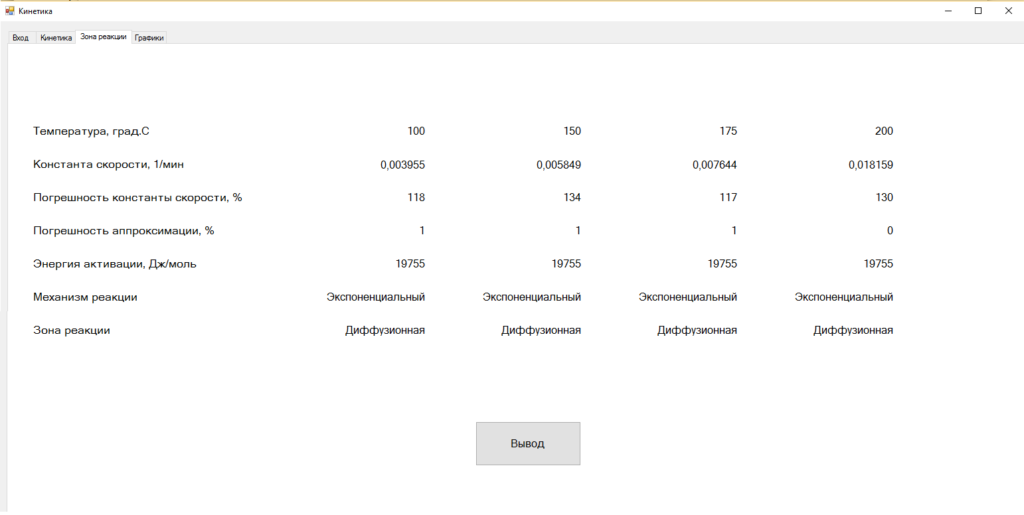
Данные о константах скоростей, порядках реакций, погрешностях аппроксимаций и констант скоростей для всех четырех кривых помещаются на вкладку Кинетика. Результаты отбора (по одной функции для каждой температуры) выносятся на вкладку Зона реакции (рис. 2).
Рис. 2 - Вкладка Зона реакции программы Кинетика с результатами расчета реакции спекания анортозитов Котозерского массива Карелии с гидродифторидом аммония
На рис. 2 показано, что реакция спекания анортозитов с гидродифторидом аммония протекает при всех температурах по экспоненциальному закону, а, следовательно, зона реакции - диффузионная. Энергия активации также одна для всех температур 19,8кДж/моль. Константы скоростей монотонно возрастают от 0,003955 мин-1 при 1000С до 0,018159 мин-1 при 2000С.
По результатам данного эксперимента можно отметить, что, согласно традиционному критерию, при энергии активации 19,8 кДж/моль зона реакции также диффузионная.
В заключение отметим, что экспоненциальный механизм реакции означает медленное протекание диффузии. Медленное настолько, что зародыш, образовавшийся на поверхности зерна, успевает полностью превратиться в продукт реакции, прежде чем произойдет образование нового зародыша.
Математически экспоненциальный закон напоминает пуассоновское распределение, для которого вероятность появления 0 событий к моменту времени t равна ![]() , где произведение константы скорости
, где произведение константы скорости ![]() на время t представляет собой параметр Пуассона [5, с. 175].
на время t представляет собой параметр Пуассона [5, с. 175].
В нашем случае полезным исходом является появление частицы продукта. Тогда вероятность отсутствия полезного исхода равна 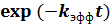 . Вероятность же хотя бы одного полезного исхода равна
. Вероятность же хотя бы одного полезного исхода равна ![]() , что и приводит нас к экспоненциальному закону протекания реакции.
, что и приводит нас к экспоненциальному закону протекания реакции.
При законе Авраами разность скоростей диффузии и скорости химической реакции не так велика. Уравнение Авраами представляет собой комбинацию экспоненциальной функции, характерной для диффузии, и степенной функции, характерной для химического взаимодействия частиц. Об этом говорит порядок реакции m, присутствующий в формуле в качестве характеристики химической реакции. Заметим, что порядок реакции m присутствует также в степенном законе, но отсутствует в экспоненциальном законе и в уравнении Праута-Томпкинса. Так что, возможно, уравнение Авраами характеризует гетерофазную реакцию не в диффузионной зоне, а в переходной.
Далее обратимся к уравнению Праута-Томпкинса. Оно представляет собой сумму геометрической прогрессии с первым членом ![]() и знаменателем
и знаменателем ![]() . Представим сумму в виде ряда
. Представим сумму в виде ряда
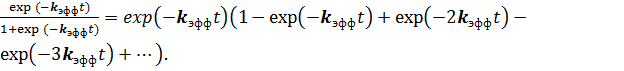 (8)
(8)
Первый, экспоненциальный, множитель этого выражения означает вероятность отсутствия благоприятного исхода в зародыше первого порядка, а первые два члена ряда описывают вероятность благоприятного исхода в зародыше второго порядка. Далее, если сгруппировать второй и третий члены ряда и вынести 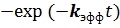 за скобки, то получится вероятность благоприятного исхода в зародыше третьего порядка и т.д. Поэтому процесс, описываемый уравнением Праута-Томпкинса, описывает появление частиц продукта в зародышах второго и более высоких порядков при отсутствии частицы продукта в первом порядке.
за скобки, то получится вероятность благоприятного исхода в зародыше третьего порядка и т.д. Поэтому процесс, описываемый уравнением Праута-Томпкинса, описывает появление частиц продукта в зародышах второго и более высоких порядков при отсутствии частицы продукта в первом порядке.
Список литературы / References
- Пушкин А.А., Римкевич В.С. Автоматизация расчетов изменений термодинамических потенциалов в ходе химических реакций// Международный научно-исследовательский журнал. 2015. №6 (37). Часть 1. С. 108-119.
- Пушкин А.А., Римкевич В.С. Автоматизация расчетов кинетических параметров химических реакций// Инновационная наука. 2016. №2. В 5 частях. Часть 5. С.37-42.
- В.В.Бочкарев. Теория химико-технологических процессов органического синтеза. Гетерофазные и гетерогенно–каталитические реакции. Учебное пособие. – Томск: Издательство ТПУ, 2005. – 118с.
- А.Г.Стромберг, Д.П.Семченко. Физическая химия. – М.: Высшая школа, 1999. –528с.
- В.Феллер. Введение в теорию вероятностей и её приложения. В 2-х томах. Т.1: Пер. с англ. – М.: Мир, 1984. –528с.
Список литературы на английском языке / References in English
- Pushkin A., Rimkevich V.S. Avtomatizatsiya raschetov izmenenii termodinamicheskih potentsialov v hode himicheskih reaktsii [Automatization of calculations of thermodynamic potentials change during chemical reactions]//Mezhdunarodny nauchno-issledovatelskii Zhurnal [International research-scientifical journal]. №6 (37). Part 1. P. 108-119. [in Russian]
- Pushkin A., Rimkevich V.S. Avtomatizatsiya raschetov kineticheskih parametrov himicheskih reaktsii [Automatization of calculations of kinetic parameters of chemical reactions]//Innovatsionnaya nauka [Innovation science]. 2016. №2. In 5 parts. Part 5. P. 37-42. [in Russian]
- V.Bochkarev. Teoriya himiko-tehnologicheskogo sinteza. Heterofaznie I heterogenno-kataliticheskie reaktsii. Uchebnoe posobie [The theory of chemical technological synthesis. Heterophase and heterogeneous catalytic reactions. Tutorial]. – Tomsk: Izdatelstvo TPU [Publisher of TPU], 2005. 118p. [in Russian]
- G.Stromberg, D.P.Semchenko. Fizicheskaya himiya [Physical chemistry]. – M.: Vysshaya shkola [High school], 1999. – 528p. [in Russian]
- Feller. Vvedenie v teoriyu veroyatnostei i eio prilozheniya V 2-uh chastiyah [Introduction in theory of probability and her applications. In 2 parts]. V. 1: Perevod s angliiskogo [Translation from English]. – M.: Mir [Peace], 1984. – 184p. [in Russian]