ОСОБЕННОСТИ ПАТОМОРФОЛОГИИ ИНФАРКТОВ МОЗГА ПРИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА И ЦЕРЕБРАЛЬНОМ АТЕРОСКЛЕРОЗЕ
Ануфриев П.Л.¹, Аблякимов Р.Э.²
¹ORCID: 0000-0002-5327-2275, Кандидат медицинских наук, Научный центр неврологии в г. Москве; ²Аспирант, Научный центр неврологии в г. Москве
ОСОБЕННОСТИ ПАТОМОРФОЛОГИИ ИНФАРКТОВ МОЗГА ПРИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА И ЦЕРЕБРАЛЬНОМ АТЕРОСКЛЕРОЗЕ
Аннотация
В результате патологоанатомического исследования показано, что одни и те же эмбологенные формы ишемической болезни сердца при наличии выраженного атеростеноза мозговых артерий могут обусловливать развитие инфарктов как в результате тромбоэмболии артерий мозга, так и по механизму сосудистой мозговой недостаточности. Установлены отличительные признаки этих инфарктов, подтверждающие возможность дифференциальной диагностики у больных с ишемической болезнью сердца и церебральным атеросклерозом инсультов двух патогенетических подтипов - кардиогенного эмболического и гемодинамического.
Ключевые слова: инфаркт мозга, ишемическая болезнь сердца, церебральный атеросклероз.
Anufriev P.L.¹, Ablyakimov R.E.²
¹ ORCID: 0000-0002-5327-2275, MD, Research Center of Neurology in Moscow; ²Postgraduate student, Research Center of Neurology in Moscow
PATHOMORPHOLOGICAL FEATURES OF BRAIN INFARCTIONS AT CORONARY HEART DISEASE AND CEREBRAL ATHEROSCLEROSIS
Abstract
As a result of a pathoanatomical research it is shown that the same embologenic forms of coronary heart disease in the presence of the expressed atherostenosis of brain arteries can cause development of heart attacks both as a result of a thromboembolism of arteries of a brain, and on the mechanism of vascular brain insufficiency. The distinctive symptoms of these brain infarctions confirming a possibility of differential diagnostics at patients with coronary heart disease and cerebral atherosclerosis of strokes of two pathogenetic subtypes - cardiogenic embolic and hemodynamic are established.
Keywords: brain infarction, coronary heart disease, cerebral atherosclerosis.
Инсульты ишемического характера являются одной из наиболее значимых причин заболеваемости и летальности в нашей стране и за рубежом. В связи с необходимостью разработки методов целенаправленного лечения и адекватного предупреждения инсульта в настоящее время активно развивается учение о его патогенетических подтипах [1, С. 276], [2, Р. 35], [3, P. 2], [4, P. 2981], [5, P. 1]. Инсульты весьма часто отмечаются у лиц с ишемической болезнью сердца (ИБС), причем такие нозологические единицы как инфаркт миокарда, постинфарктный кардиосклероз и мерцательная аритмия ассоциируются с набольшим риском возникновения инсультов кардиогенного эмболического подтипа вследствие тромбоэмболии мозговых артерий из полостей сердца с развитием инфарктов [6, C. 86], [7, P. 152], [8, P. 577]. Имеются данные о том, что указанные формы ИБС могут определять возникновение инфарктов, выступая в качестве экстрацеребральной причины ухудшения гемодинамики мозга на фоне уже имеющегося дефицита кровотока в нем, связанного с атеросклеротическим стенозом (атеростенозом) мозговых артерий [9, P. 149], [10, P. 1008]. Недостаточная изученность этих инфарктов и определяемых ими инсультов не позволяет сформировать единое мнение о целесообразности выделения последних в самостоятельный патогенетический подтип.
С целью определения особенностей патогенеза и морфологии инфарктов мозга, возникающих при ИБС и атеросклеротических изменениях мозговых артерий исследовано 40 секционных случаев. В каждом случае изучены коронарные артерии и сердце, вне- и внутричерепные артерии, включая дугу аорты; устанавливалось количество атеросклеротических бляшек (АСБ) и степень обусловленного ими атеростеноза, наличие тромбоэмболов и АСБ с изъязвлениями и тромбами (эмбологенные АСБ), оценивались характеристики всех инфарктов мозга (величина, локализация, давность). Для уточнения характера изменений мозговых артерий и сердца при атеросклерозе выполнено микроскопическое исследование гистологических срезов, залитых в парафин и окрашенных гематоксилином и эозином, по методам ван Гизона и Вейгерта (идентификация коллагеновых и эластических волокон), Клювера-Барреры и Ниссля (изучение состояния миелина, глиальных элементов и нейронов). Микроскопия применялась также для дифференциальной диагностики атеросклеротических малых глубинных инфарктов и таких же инфарктов, возникающих при артериальной гипертензии, имевшейся практически во всех случаях. Так, вблизи гипертонических инфарктов имелись артерии с резко суженными просветами в результате плазморрагии или гиалиноза; в пределах инфарктов артерии не определялись или имелись отдельные фрагменты их некротизированных стенок. В атеросклеротических инфарктах располагались сосуды со своеобразной перекалибровкой просвета в сторону его уменьшения, определяемой склерозом внутренней оболочки, пролиферацией ее элементов с образованием дополнительной эластической мембраны. При проведении исследования учитывались данные предшествующего клинико-инструментального исследования сердца, клинические и патологоанатомические признаки сердечной недостаточности. Для статистической оценки полученных результатов использован критерий Манна-Уитни с уровнем значимости р<0,05.
Всего обнаружено 98 инфарктов головного мозга (от 1 до 6 в каждом случае). В 23 наблюдениях имелось 30 инфарктов разной величины и давности, причиной которых оказалась тромбоэмболия артерий мозга из сердца (рис. 1).
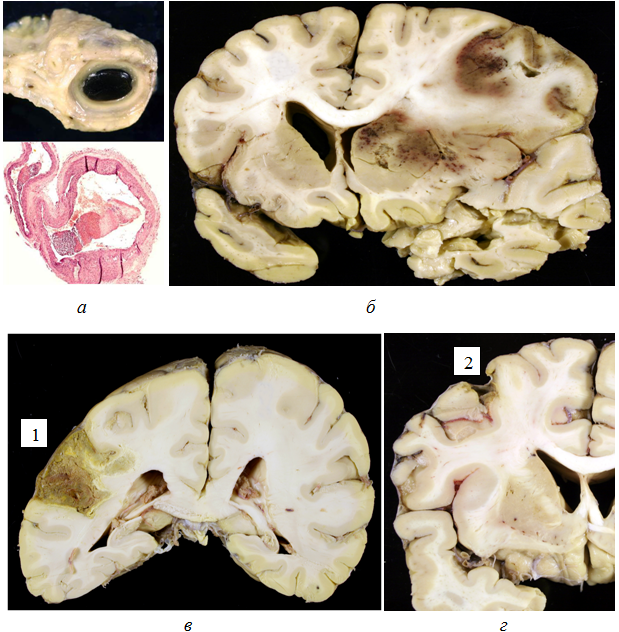
Рис. 1 – Инфаркты мозга при эмболии из сердца: а – церебральные артерии с тромбоэмболами в просветах; б – большой свежий инфаркт (с геморрагическим компонентом) в лобной и височной долях, базальных ядрах полушария; в – средний организующийся инфаркт (1) в нижней теменной дольке; г – организованный малый корковый инфаркт (2) в средней лобной извилине.
Примечание: а, снизу – микрофото, окраска гематоксилином и эозином, увеличение 40.
Формирование тромбов в полостях сердца определялось острым инфарктом миокарда, постинфарктным крупно- или мелкоочаговым кардиосклерозом, а также мерцательной аритмией (постоянная и пароксизмальная формы), установленной в результате клинического обследования и подтвержденной выявлением выраженного склероза миокарда в области проводящих кардиомиоцитов. Эмболия интракраниального отдела внутренней сонной артерии (ВСА) и средней мозговой артерии (СМА) привела к развитию 11 больших инфарктов. Они были свежими, захватывали кору и белое вещество лобной, височной и теменной долей полушария мозга, базальные ядра. Вследствие эмболии отдельных веточек СМА, передней мозговой артерии (ПМА), одной из мозжечковых артерий, возникли соответственно 10, 2 и 4 средних инфаркта. Эти инфаркты располагались в пределах одной доли полушария мозга или дольки мозжечка, имели разную давность. Эмболия терминальных участков одной из корковых ветвей СМА определила возникновение 3 малых поверхностных инфарктов, которые локализовались в пределах коры полушария мозга, занимая площадь 1-2 см². Все большие и 5 средних инфарктов (более половины всех инфарктов) имели геморрагический компонент в виде множественных петехиальных кровоизлияний или кровоизлияния типа гематомы. В артериях, расположенных проксимально по отношению к области тромбоэмболической окклюзии, часто обнаруживались АСБ неэмбологенного характера, суживающие просвет не более чем на 25%. 29 инфарктов (97%) определили развитие инсультов; малый инфаркт не имел клинической симптоматики (немой инфаркт).
В 17 случаях выявлено 68 инфарктов (из 98), которые возникли при множественном атеростенозе внечерепных и/или внутричерепных артерий на фоне острой сердечной недостаточности, обусловленной инфарктом миокарда, либо декомпенсации хронической сердечной недостаточности, связанной с крупноочаговым постинфарктным кардиосклерозом и/или мерцательной аритмией. Чаще всего выявлялись малые глубинные (лакунарные) инфаркты размерами от 0,5х0,5 см до 1,5х1,5 см (рис. 2).
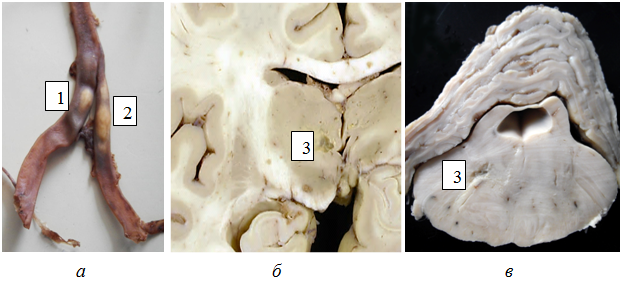
Рис. 2 – Инфаркты мозга при множественном атеростенозе церебральных артерий: а – атеросклеротические бляшки (1, 2) в левой и правой позвоночных артериях; б – лакунарный инфаркт (3) в таламусе; в – лакунарный инфаркт (3) в мосту мозга.
22 лакунарных инфаркта локализовались в перивентрикулярном белом веществе и семиовальном центре, т.е. в области смежного кровоснабжения корковых и центральных ветвей СМА и/или ПМА, 19 - в белом веществе заднего края мозжечка или глубоких отделах продолговатого мозга, моста и среднего мозга, т.е. в области смежного кровоснабжения верхней и нижней задней артерий мозжечка или парамедианных, коротких и длинных огибающих ветвей позвоночной, базилярной, задней мозговой артерий (ЗМА). 19 средних и малых корковых инфарктов обнаружены в участках смежного кровоснабжения поверхностных веточек ПМА и СМА или СМА и ЗМА. Кроме того, выявлено 8 больших и средних инфарктов, расположенных в бассейне одной артерии (ПМА, СМА, ЗМА или верхней мозжечковой артерии) и возникших при множественном атеростенозе только интракраниальных сосудов. Максимальная степень выраженности атеростеноза на стороне инфаркта колебалась от 50 до 90%, причем его появление определилось не только кардиогенным фактором редукции кровоснабжения определенного участка мозга, но и, по-видимому, недостаточностью коллатерального кровообращения по виллизиеву кругу в связи с частым сочетанием стенозов на стороне инфаркта с контралатеральными стенозами. 39 инфарктов (57%) небольшой давности привели к развитию 28 инсультов (отдельные инсульты обусловливались несколькими инфарктами); 29 организованных лакунарных инфарктов были немыми.
Полученные результаты демонстрируют двоякую роль одних и тех же форм ИБС (мерцательная аритмия, инфаркт миокарда, постинфарктный кардиосклероз) в развитии инфарктов мозга при церебральном атеросклерозе. В одних случаях они приводят к тромбоэмболии мозговых артерий, в других – «запускают» механизм сосудистой мозговой недостаточности, выступая в качестве экстрацеребрального фактора ухудшения кровоснабжения мозга на фоне уже имеющейся недостаточности притока крови к нему, связанной с выраженным атеростенозом (сужение просвета артерий на 50% и более). При этом инфаркты, формирующиеся по механизму сосудистой мозговой недостаточности, возникают, главным образом, в наиболее удаленных от основного источника питания зонах мозга, которыми являются области смежного кровоснабжения тех или иных мозговых артерий. Инфаркты, возникшие при тромбоэмболии мозговых артерий из сердца, часто имеют геморрагический компонент и развиваются вне областей смежного кровоснабжения, преимущественно в бассейне ВСА и ее ветвей. Кроме наличия «эмболической» формы ИБС, облигатным признаком этих инфарктов является отсутствие эмбологенных АСБ и выраженного атеростеноза артерий, расположенных проксимально к области окклюзии. Установленные отличительные патоморфологические признаки инфарктов мозга, которые возникают при сосудистой мозговой недостаточности и эмболии из сердца, согласуются с критериями дифференциальной диагностики гемодинамического и кардиогенного эмболического инсультов, выделенных в патогенетические подтипы инсульта в одной из классификаций [1, C. 276]. Частота инсультов данных подтипов в проведенном исследовании оказалась практически одинаковой – 51% и 49% соответственно. Тот факт, что организующиеся инфаркты, обусловливающие гемодинамические инсульты, нередко сочетались с немыми лакунарными инфарктами большой давности, позволяет рассматривать последние не только как одну из причин дисциркуляторной энцефалопатии, но и в качестве предикторов ишемических инсультов указанного патогенетического подтипа.
Список литературы / References
- Суслина З.А., Гулевская Т.С., Максимова М.Ю. и др. Нарушения мозгового кровообращения: диагностика, лечение, профилактика. - М.: МЕДпресс-информ, 2016. – 536 с.
- Adams H.P., Bendixen B.H., Kappelle L.J. et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment // Stroke. – 1993. – V. 24. – P. 35-41.
- Amarenco P., Bogousslavsky J., Caplan L. et al. The ASCOD Phenotyping of Ischemic Stroke (Updated ASCO Phenotyping) // Dis. – 2013. – V. 36. – P. 1-5.
- Ay H., Benner T., Arsava E.et al. A computerized algorithm for etiologic classification of ischemic stroke: The Causative Classification of Stroke System // – 2007. – V. 38. – P. 2979-2984.
- Gao S., Wang Y., Xu A. et al. Chinese ischemic stroke subclassification // Neurol. – 2011. – V. 2. – P. 1-5.
- Шевченко Ю.Л., Одинак М.М., Кузнецов А.Н. и др. Кардиогенный и ангиогенный церебральный эмболический инсульт (физиологические механизмы и клинические проявления). - М.: ГЭОТАР-Медиа, 2006. – 272 с.
- Arboix A., Alió J. Cardioembolic stroke: clinical features, specific cardiac disorders and prognosis // Current Cardiol. Rev. – 2010. – V. 6. – P. 150-161.
- Ois A., Cuadrado-Godia E., Rodríguez-Campello А. et al. Relevance of stroke subtype in vascular risk prediction // Neurology. – 2013. – V. 81. – P. 575-580.
- Caplan L., Wong K., Gao S. et al. Is hypoperfusion an important cause of strokes? If so, how? // Dis. – 2006. – V. 21. – P. 145-153.
- Klijn C.J., Kappelle L.J. Haemodynamic stroke: clinical features, prognosis, and management // Lancet Neurol. – – V. 9. – P. 1008-1017.
Список литературы на английском языке / References in English
- Suslina Z.A., Gulevskaya T.S., Maksimova M.Yu. et al. Narusheniya mozgovogo krovoobrashheniya: diagnostika, lechenie, profilaktika [Cerebrovascular disease: diagnosis, treatment, prevention]. - M.: MEDpress-inform, 2016. – 536 p. [in Russian]
- Adams H.P., Bendixen B.H., Kappelle L.J. et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment // Stroke. – 1993. – V. 24. – P. 35-41.
- Amarenco P., Bogousslavsky J., Caplan L. et al. The ASCOD Phenotyping of Ischemic Stroke (Updated ASCO Phenotyping) // Dis. – 2013. – V. 36. – P. 1-5.
- Ay H., Benner T., Arsava E.et al. A computerized algorithm for etiologic classification of ischemic stroke: The Causative Classification of Stroke System // – 2007. – V. 38. – P. 2979-2984.
- Gao S., Wang Y., Xu A. et al. Chinese ischemic stroke subclassification // Neurol. – 2011. – V. 2. – P. 1-5.
- Shevchenko Yu.L., Odinak M.M., Kuznecov A.N. et al. Kardiogennyj i angiogennyj cerebral'nyj embolicheskij insul't (fiziologicheskie mehanizmy i klinicheskie projavleniya) [Cardiogenic and angiogenic cerebral embolic stroke (physiological mechanisms and clinical implications)]. M.: GEOTAR-Media, 2006. – 272 p. [in Russian]
- Arboix A., Alió J. Cardioembolic stroke: clinical features, specific cardiac disorders and prognosis // Current Cardiol. Rev. – – V. 6. – P. 150-161.
- Ois A., Cuadrado-Godia E., Rodríguez-Campello А. et al. Relevance of stroke subtype in vascular risk prediction // Neurology. – 2013. – V. 81. – P. 575-580.
- Caplan L., Wong K., Gao S. et al. Is hypoperfusion an important cause of strokes? If so, how? // Dis. – 2006. – V. 21. – P. 145-153.
- Klijn C.J., Kappelle L.J. Haemodynamic stroke: clinical features, prognosis, and management // Lancet Neurol. – – V. 9. – P. 1008-1017.
