ЗАГРУЗКА КАЛЬЦИЕВОГО КРАСИТЕЛЯ В ДВИГАТЕЛЬНЫЕ НЕРВНЫЕ ОКОНЧАНИЯ ТЕПЛОКРОВНЫХ ЧЕРЕЗ КУЛЬТЮ НЕРВА
Жиляков Н.В. 1, Хазиев Э.Ф. 2, Судаков И.А. 3, Казаков А.Г. 4, Александров М.В. 4, Самигуллин Д.В. 5
1 магистрант, Казанский (Приволжский) федеральный университет, 2 ORCID: 0000-0002-1552-5526, кандидат биологических наук, младший научный сотрудник, Учреждение Российской академии наук Казанский институт биохимии и биофизики Казанского научного центра РАН, Казанский (Приволжский) федеральный университет, 3 студент, Казанский (Приволжский) федеральный университет, 4 магистрант, Казанский национальный исследовательский технический университет им. А.Н. Туполева, НИИ прикладной электродинамики, фотоники и живых систем, 5 ORCID: 0000-0001-6019-5514, кандидат биологических наук, старший научный сотрудник, Казанский институт биохимии и биофизики Казанского научного центра РАН, Казанский (Приволжский) федеральный университет, доцент, Казанский национальный исследовательский технический университет им. А.Н. Туполева, НИИ прикладной электродинамики, фотоники и живых систем
Работа поддержана грантами: РФФИ № 16-04-01051 (СДВ), №16-34-00817 и № 15-04-02983 (ХЭФ); Президиума РАН "Механизмы интеграции молекулярных систем при реализации физиологических функций". Работа частично выполнена за счет средств субсидии, выделенной в рамках государственной поддержки Казанского (Приволжского) федерального университета в целях повышения его конкурентоспособности среди ведущих мировых научно-образовательных центров.
ЗАГРУЗКА КАЛЬЦИЕВОГО КРАСИТЕЛЯ В ДВИГАТЕЛЬНЫЕ НЕРВНЫЕ ОКОНЧАНИЯ ТЕПЛОКРОВНЫХ ЧЕРЕЗ КУЛЬТЮ НЕРВА
Аннотация
Одним из наиболее доступных способов измерения пресинаптического уровня кальция является оптический метод регистрации. Он основан на применении флуоресцентных красителей, связывающих кальций, и изменяющих интенсивность или длину волны своего свечения в зависимости от количества свободного кальция в клетке. Существует несколько способов загрузки клеток кальциевым красителем. Наиболее широко распространены такие методы, как введение красителя через микропипетку и применение форм красителей, проникающих через мембрану. Однако, эти способы трудно применимы для работы с нервно-мышечным препаратом из-за возникающих методических проблем. В данной работе мы представляем метод загрузки кальций-чувствительного красителя, непроникающего сквозь клеточные мембраны, через культю нерва в двигательные окончания аксона теплокровных.
Ключевые слова: кальций, флуоресцентные красители, нервно-мышечное соединение
Zhilyakov N.V. 1, Khaziev E.F. 2, Sudakov I.A. 3, Kazakov A.G. 4, Alexandrov M.V. 4, Samigullin D.V. 5
1 Master student, Kazan (Volga region) Federal University, 2 ORCID: 0000-0002-1552-5526, PhD in Biology, Junior Researcher, Russian Academy of Sciences, Kazan Institute of Biochemistry and Biophysics, Kazan Scientific Center of the Russian Academy of Sciences, Kazan (Volga region) Federal University, 3 Student, Kazan (Volga region) Federal University, 4 Master student, Kazan National Research Technical University named after AN Tupolev, Institute of Applied Electrodynamics, photonics and living systems, 5 ORCID: 0000-0001-6019-5514, PhD in Biology, Senior Researcher, Kazan Institute of Biochemistry and Biophysics, Kazan Scientific Center of the Russian Academy of Sciences, Kazan (Volga region) Federal University, associate professor, Kazan National Research Technical University named after AN Tupolev, Institute of Applied Electrodynamics, photonics and living systems
LOADING MAMMALIAN NERVE ENDINGS WITH CALCIUM DYE THROUGH THE NERVE STUMP
Abstract
One of the most accessible methods to measure presynaptic calcium level is an optical recording. It is based on the use of calcium-binding fluorescent dyes, which change their intensity or emission wavelength depending on the amount of free calcium in the cell. There are several methods of staining cells with calcium dye. The most popular delivery methods of the dye are the injection through micropipette and the application of acetoxymethyl ester forms of dyes. However, these ways are not applicable for neuromuscular junction due to methodological problems. In this paper we present the method of loading nerve endings of warm-blooded animals with calcium-sensitive dye through the stump of the nerve.
Keywords: calcium, fluorescence dyes, neuromuscular junction
Введение
Флуоресцентные индикаторы позволяют изучать динамику кальция и применяются для исследования изменения внутриклеточной концентрации свободного кальция. Все современные химические флуоресцентные кальциевые индикаторы синтезированы на основе BAPTA (pH-нечувствительном гомологе EGTA) и имеют модульную структуру, состоящую из связывающего участка и флуоресцентного красителя [1,2]. В зависимости от целей эксперимента и используемого оборудования подбирают индикаторы с определенной комбинацией связывающих участков и красителей. Механизм действия кальциевого флуоресцентного индикатора основан на связывании буфера с кальцием, что при освещении светом с длиной волны возбуждения вызывает изменение конформации красителя с испусканием кванта света. Причем длина волны излучения должна быть отлична от длины волны возбуждения [3]. В присутствии ионов кальция флуоресцентный индикатор способен изменять интенсивность флуоресценции или свои спектральные характеристики. Свойства флуоресцентных индикаторов, следует учитывать при выборе красителей для определенных задач (Indicators for Ca2+, www.invitrogen.com). Форма индикатора (соль, эфир, декстран-сопряженная форма), в зависимости от выбранного метода загрузки красителя, влияет на внутриклеточное распределение и удержание индикатора. Соль и декстран-форму загружают, как правило, через микропипетку [4,5]. Проникающие в клетку ацетоксиметиловые эфиры (AM) можно пассивно загружать в клетку, где они расщепляются внутриклеточной эстеразой. Третий метод окрашивания препарата – через культю нерва [6,7,8] – является наиболее оптимальным для работы с нервно-мышечным препаратом теплокровных. В нашей лаборатории этот способ загрузки индикатора успешно применялся для окрашивания нервных окончаний холоднокровных животных [9,10,11]. В настоящем исследовании мы представляем модификацию этой методики для работы на нервно-мышечном окончании теплокровных животных.
Методика
Загрузку красителя выполняли на изолированном нервно-мышечном препарате разгибателя уха levator auris longus (LAL) белой лабораторной мыши [12]. Животных анестезировали и декапетировали в соответствии с требованиями этических норм по работе с лабораторными животными (директива совета ЕС 86/609/EEC от 24 ноября 1986 года). Нервно-мышечный препарат LAL в силу своих морфологических особенностей хорошо применим для микроскопических исследований. Небольшая толщина и малые размеры позволяют использовать оптику Номарского для визуализации нервных окончаний в режиме «светлое поле». Нервные ответвления хорошо визуализируются в обычном стереомикроскопе, что очень важно для загрузки красителей через культю нерва. Небольшие размеры LAL и малая толщина обеспечивают достаточную выживаемость препарата при длительной экспозиции с красителем. В LAL представлены в основном быстрые мышечные волокна [13].
Выделение препарата LAL, очистку от соединительной ткани и инкубацию производили в растворе Рингера следующего состава (мМ): NaCl -137.0, KCl - 5.0, CaCl2 - 2, MgCl2 - 1.0 NaHCO3 -11.0, Na2HPO4 - 1.0, , glucose - 11, pH раствора поддерживали на уровне 7.2-7.4. Использовали кальциевый краситель Oregon Green 488 BAPTA-1 Hexapotassium Salt, cell impermeant, в концентрации 10 мМ, разведенный на дистиллированной воде с добавлением ГЭПЭСА в концентрации 5мМ для стабилизации pH раствора на уровне 7.2 – 7.4 [14].
Выделенный препарат LAL помещали в чашку Петри с раствором Рингера (Рис. 1). Препарат растягивали при помощи микроигл в чашке Петри, дно которой залито смолой Silgard. Чашку Петри закрепляли при помощи стоматологического или пчелиного воска на предметном стекле, как показано на Рис. 2. Для загрузки кальциевого красителя использовали стеклянную микропипетку (Рис. 1). Микропипетку изготавливали на микрокузнице из стеклянных толстостенных заготовок без внутренних микрокапилляров. При изготовлении микропипеток использовали настройки микрокузницы, стандартные для изготовления внутриклеточных микроэлектродов с короткой шейкой. Кончик электрода обламывали при помощи абразивного материала под визуальным контролем и оплавляли на той же микрокузнице. Диаметр внутреннего отверстия получившейся микропипетки должен соответствовать диаметру выбранной для загрузки нервной ветки. Варьируя время оплавления, можно добиться нужного диаметра кончика микропипетки. На тыльную сторону микропипетки надевали силиконовую трубку подходящего диаметра, соединенную посредством переходника, изготовленного из наконечника для пипетки, со шприцем (Рис. 1, Рис. 2).
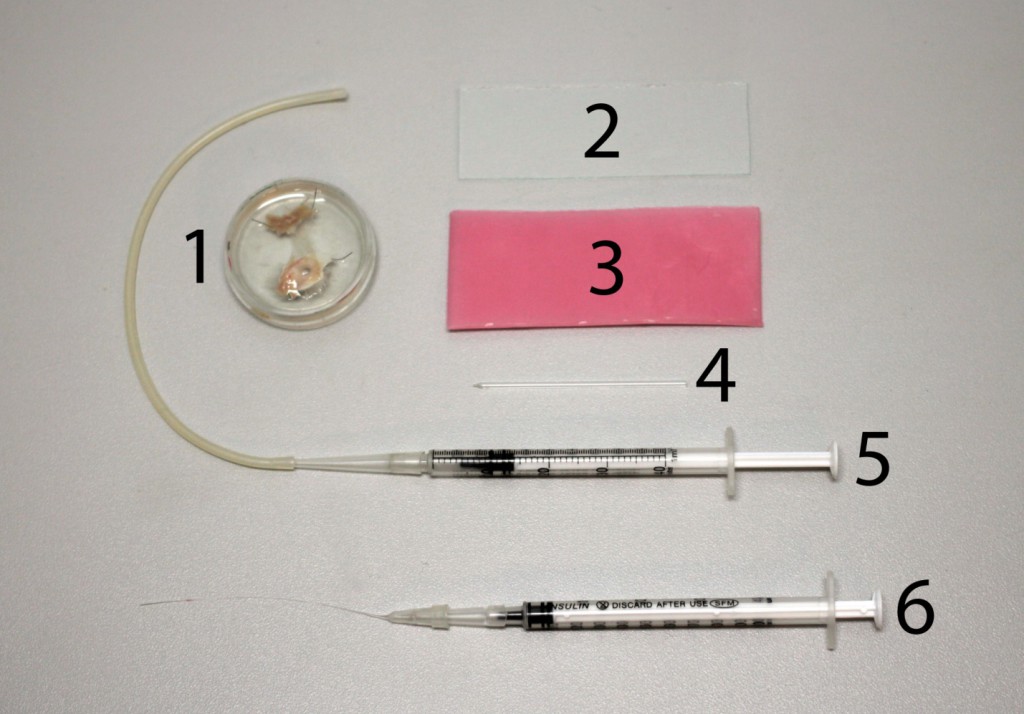
Рис. 1 Фотография препарата в чашке Петри и необходимых материалов и оборудования. 1 - выделенный препарат, помещенный в чашку Петри; 2 – предметное стекло; 3 – стоматологический воск; 4 – стеклянная микропипетка; 5 - шприц с силиконовой трубкой; 6 – шприц с микронаконечником.
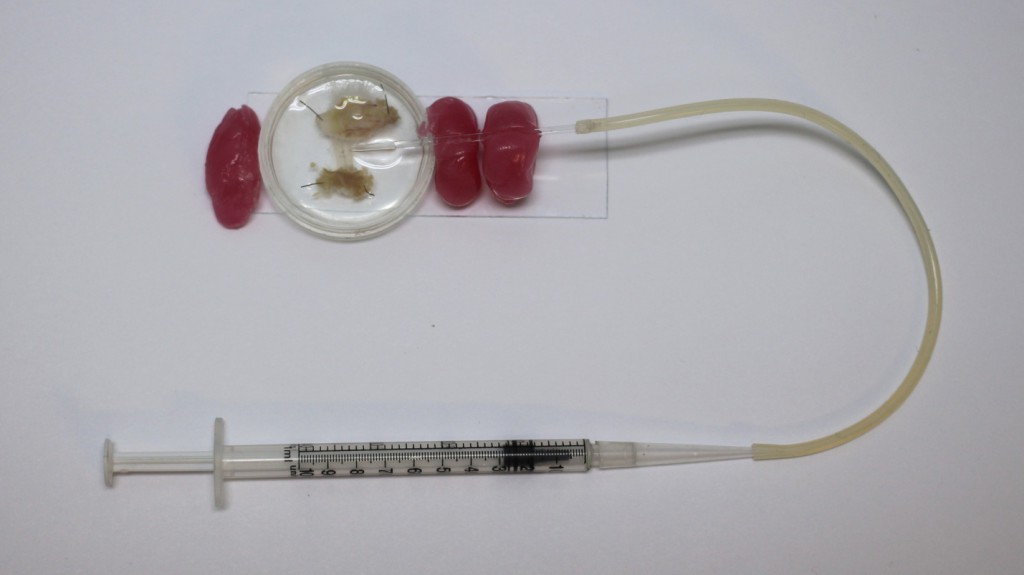
Рис. 2 Фотография препарата с закрепленной воском микропипеткой и шприцом для засасывания культ нерва.
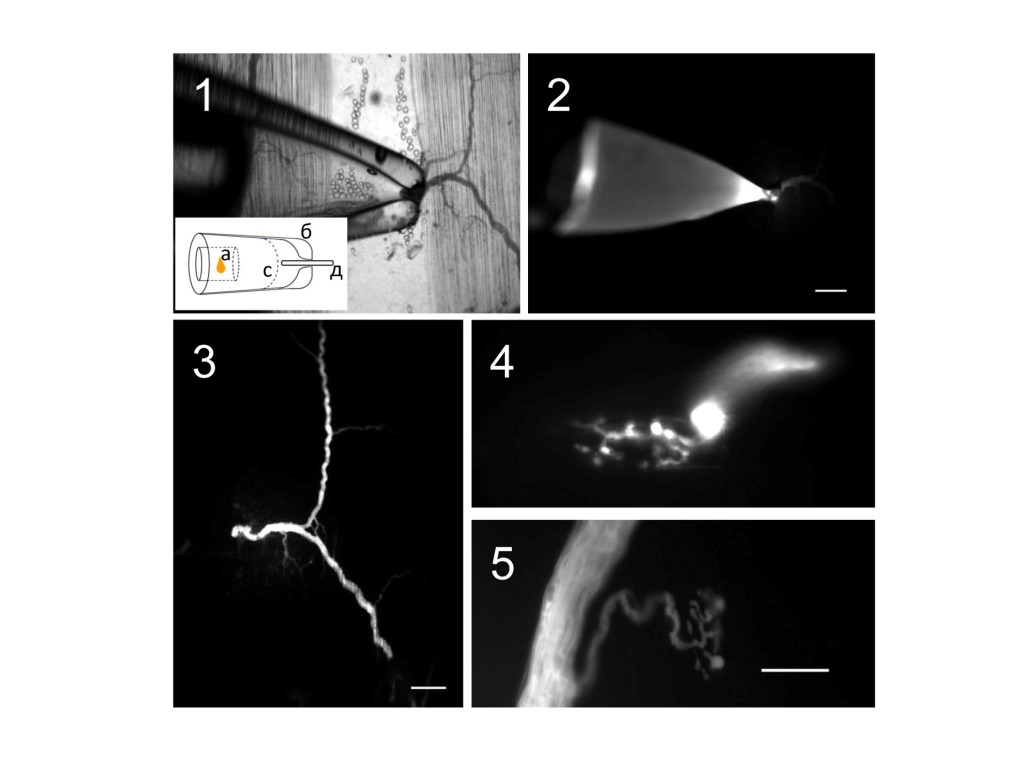
Рис 3. Микрофотографии загрузки нервных окончаний красителем Oregon Green 488 BAPTA-1. 1 – микропипетка с культей нерва и красителем в режиме освещения «светлое поле», на схеме показано изображение микропипетки (б) с введенным в нее микронаконечником (а) культей нерва (д) в растворе (с); 2 – та же область препарата, что и на 1 вкладке в режиме «флуоресценция», размерность шкалы 200 мкм; 3 – сегмент нерва, загруженный красителем после трехчасовой инкубации, режим освещеения «флуоресценция», размерность шкалы 200мкм,; 4, 5 – нервные окончания загруженные красителем в режиме освещения «флуоресценция», размерность шкалы 20 мкм
Под визуальным контролем с помощью стереомикроскопа стеклянную микропипетку подводили к выбранной нервной ветке и воском фиксировали на предметном стекле (Рис. 1, Рис. 2). Непосредственно перед загрузкой красителя микроножницами рассекали нервную ветку. При помощи шприца нерв с небольшим объемом раствора засасывался в микропипетку. Если диаметр микропипетки был подобран правильно, то нерв плотно фиксировался в кончике и в микропипетку не поступал раствор из чашки Петри (Рис 3.1). Затем с тыльного конца микропипетки снимали силиконовую трубку. Для аппликации красителя на культю нерва использовали пластиковый микронаконечник собственного изготовления (Рис. 1). Микронаконечник изготавливали из одноразовых наконечников для микропипеток объемом до 10 мкл. Среднюю часть наконечника нагревали на спиртовке или на микрофене собственного изготовления до температуры, при которой кончик наконечника изгибался под действием силы тяжести. Затем быстро прекращали нагрев и, удерживая наконечник пальцами, растягивали расплавленную часть пластика. После остывания пластика острым лезвием разрезали получившуюся трубку, оставляя около 7-9 см со стороны крепления наконечника. Диаметр кончика получившегося микронаконечника должен быть около 80-100 мкм. Через переходник, изготовленный из наконечника от микропипетки, соединяли получившийся микронаконечник со шприцем (Рис. 1). Затем проверяли, не запаян ли внутренний канал изготовленного микронаконечника. Подавая давление при помощи шприца и опустив наконечник в раствор, наблюдали пузырьки воздуха – это свидетельствовало о том, что внутренний канал микронаконечника не запаян. При помощи шприца набирали в микронакончник раствор красителя (примерно 1-2см). Раствор красителя имеет характерный оранжевый цвет, что позволяет визуально контролировать объем всасываемого раствора. Микронаконечник с раствором красителя вставляли в стеклянную микропипетку под визуальным контролем и при касании мениска раствора, поступившего в микропитпетку вместе с нервом, при помощи шприца производили введение красителя (Рис 3.1). Объем введенного красителя примерно должен соответствовать объему находящегося в пипетке с нервом раствора – это даст конечную концентрацию красителя приблизительно 5 мМ. Раствор красителя должен быть апплицирован на торец нерва как можно быстрее после рассечения нерва, поскольку с течением времени культя нерва коагулируется, что делает невозможным проникновение красителя в нерв.
После аппликации красителя на культю нерва торец стеклянной микропипетки изолировали вазелином, что препятствовало засасыванию раствора из чашки Петри за счет капиллярного эффекта и испарению раствора красителя из микропипетки. Чашку Петри с закрепленной микропипеткой помещали в темное место на 2-3 часа. В процессе инкубации препарата с красителем осуществляли проверку процесса загрузки красителя при помощи флуоресцентнтого микроскопа (Рис. 3.2). Если удавалось обнаружить загруженные в достаточной мере красителем терминали (Рис. 3.4-5), процесс инкубации прекращали. После инкубации микропипетку с красителем снимали с чашки Петри. Поскольку во время процедуры инкубации возможно попадание красителя в чашку Петри и на препарат, то после инкубации препарат помещали в стакан с раствором Рингера для отмывки остатков красителя с культи нерва и препарата на 10-15мин.
После процедуры загрузки красителя все проксимальные участки нерва и нервные ответвления с терминалями окрашивались флуоресцентным красителем (Рис. 3.3-5). Препарат перемещали в рабочую экспериментальную камеру и проводили процедуру регистрации кальциевого транзиента по методике, описанной в работах [9,10,11].
Для стимуляции нерва использовали модифицированный стимулирующий электрод, описанный в работе [15].
Обсуждение
Существуют различные методы загрузки флуоресцентных кальциевых индикаторов в живые клетки. При работе на синапсах ЦНС в культуре нейронов или на срезах в основном применяют методики загрузки через патч-пипетку [16] или используют формы красителей, проникающие сквозь клеточные мембраны – АМ-формы [17]. При работе на периферических синапсах, таких как нервно-мышечное соединение, использование АМ-форм красок связано с рядом трудностей. Краситель проникает как в пресинаптические, так и в постсинаптические клетки (мышечные волокна), что затрудняет разделение кальциевых сигналов от этих клеток между собой, хотя некоторые исследователи применяют этот тип красок при работе на синапсах холоднокровных [18,19]. При такой методике загрузки также трудно контролировать проникновение красителя в клеточные органеллы, хотя эта проблема может быть частично решена за счет выбора температурного режима инкубации препарата с красителем [20]. Использование патч-пипеток при работе на нервно-мышечном препарате невозможно из-за его морфологического строения: малых размеров пресинаптической клетки, наличия соединительной ткани и т.д. Хотя применение этой методики допускается при работе на нервно-мышечных синапсах, выращенных в культурах клеток [21]. В качестве альтернативы применению патч-пипеток при работе на нервно-мышечных окончаниях для введения флуоресцентных красителей в пресинаптические клетки, используют метод микроинъекций при помощи острых внутриклеточных электродов (микропипеток) с большим сопротивлением [22]. Микроинъекция осуществляется либо ионофоретически, подачей тока на микропипетку, либо повышением давления (пневмоинъекция). Этот метод позволяет вводить непроникающую сквозь клеточные мембраны форму красителя непосредственно в пресинаптическую клетку. Однако метод микроинъекций сопряжен с рядом методических трудностей. В силу морфологической особенности строения нервно-мышечного соединения, введение электрода в пресинаптическую клетку требует высокого мастерства исследователя и накладывает ряд требований на применяемое оборудование. Необходимо применять специализированные микроманипуляторы, снабженные режимом прокола клетки, усилители с возможностью аппликации тока или пневмоинъекторы. Повышенные требования к отсутствию вибрации делают необходимым использование виброизолирующих столов для изоляции экспериментального оборудования от внешних воздействий. Процесс микроинъекции – травматичная процедура для клеток и процент выживания препарата после этой процедуры низок [23]. Микроинъекция позволяет ввести краситель в одну пресинаптическую клетку, после чего краска диффундирует в нервный ствол и концентрация красителя в клетке уменьшается. Это отражается на воспроизводимости результатов в процессе экспериментов.
Всех перечисленных выше недостатков лишен метод загрузки красителя через культю нерва, описанный нами в данной статье. Метод основан на транспорте кальциевого красителя за счет диффузии и антероградного транспорта внутри аксона. Данная методика с успехом используется для загрузки кальциевых красителей в нервные окончания холоднокровных [6,7] и нервные окончания дрозофилы [8]. В нашей лаборатории мы используем данный тип загрузки для изучения входа кальция в нервные окончания лягушки [9,10,11]. Одним из основных недостатков данной методики является необходимость длительной экспозиции препарата с красителем. Длительность инкубации препарата определяется скоростью перемещения красителя внутри аксона и расстоянием между нервными окончаниями и местом аппликации красителя. В некоторых случаях инкубация может происходить в течение нескольких дней. При работе с нервно-мышечным препаратом кожно-грудинной мышцы лягушки в нашей лаборатории инкубация составляет около 24 ч. Нервно-мышечный препарат лягушки хорошо переносит такую длительную инкубацию. В случае работы с препаратами теплокровных животных такая длительная инкубация неприемлема, поскольку необходимо обеспечивать жизнедеятельность препарата, постоянную смену раствора, аэрацию и все процедуры проводить в стерильных условиях для исключения микробной контаминации препарата и т.д. В данной работе мы описали методику, позволяющую снизить время инкубации с красителем до 3 часов за счет уменьшения дистанции между отрезком культи нерва и терминальными ответвлениями. Выживаемость препарата при данном методе окрашивания является достаточной для нормальной экспериментальной работы. После загрузки, проведенной данным способом, нервные окончания, находящиеся в проксимальной части препарата (ближе к культе нерва), равномерно окрашиваются красителем. Это позволяет проводить регистрацию флуоресцентных кальциевых сигналов от одного или нескольких нервных окончаний по выбору исследователя (Рис. 3.4-5). При данном способе загрузки краситель проникает только в цитозоль пресинаптической клетки, что исключает ошибки при регистрации сигналов, связанные с влиянием кальциевых сигналов от постсинаптической клетки или от внутриклеточных органелл, возникающие при других способах загрузки.
Литература
- Grynkiewicz, G. A new generation of Ca2+ indicators with greatly improved fluorescence properties / G. Grynkiewicz, M. Poenie, R. Y. Tsien // J. Biol. Chem. – 1985. – Vol. 260. - № 6. – P. 3440-3450.
- Tsien, R. Y. Fluorescent indicators of ion concentrations / R. Y. Tsien // Methods Cell Biol. – 1989. - Vol. 30. – P. 127-156.
- Adams, S. R. How calcium indicators work / S. R. Adams // Cold Spring Harb. Protoc. – 2010. – V. 2010. - № 3.
- Coleman ,W.L. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. / L. Coleman , C.A. Bill, Simsek- F. Duran, G. Lonart, D. Samigullin , M.J Bykhovskaia // J. Physiol. – 2008. – Vol. 586(19)– P. 4649-4673.
- Macleod, T. G Topical Application of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction / G. T. Macleod // Cold Spring Harb Protoc;. – 2012. – P. 786-790.
- Peng, Y. Y. How calcium indicators work / Y. Y Peng, R. S. Zucker// Neuron – 1993. – Vol. 10. - № 3.-P.465-473
- Wu, L. G. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. / L. G. Wu, W. J. Betz // Neuron . – 1996. – Vol. 17 – P. 769-779.
- Macleod, T. G Forward-Filling of Dextran-Conjugated Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction / G. T. Macleod // Cold Spring Harb Protoc. – 2012. – P. 3440-3450.
- Samigullin, D. V. Characteristics of Сalcium Transient in Different Parts of Frog Nerve Terminal in Response to Nerve Impulse / D. V. Samigullin, A. L. Vasin, J. A. Bukharaeva, E. E. Nikolsky // Doklady Biological Sciences. - 2010. – V. 431. – P. 83-85.
- Khaziev, E. F. Decreased entry of calcium into motor nerve endings upon activation of presynaptic cholinergic receptors / E. F. Khaziev, N. F. Fatikhov, D. V. Samigullin, G. Barrett, Je. A. Bukharaeva, E. E. Nikolsky // Doklady Biological Sciences. - 2012.Sep. –Oct. – V. 446. –P. 283–285.
- Samigullin, D.V. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes / D.V. Samigullin, N.F. Fatikhov, E.F. Khaziev, A.I. Skorinkin, E.E. Nikolsky, E.A. Bukharaeva // Front. Synaptic Neurosci. – 2015. – Jan 7;6:29. doi: 10.3389/fnsyn.2014.00029. eCollection 2014.
- Angaut-Petit, D. The levator auris longus muscle of the mouse: a convenient preparation for studies of short- and long-term presynaptic effects of drugs or toxins. / Angaut-Petit D, Molgo J, Connold AL, Faille L. // L. Neurosci Lett. – 1987. – Vol. 82(1) – P. 83-88.
- Erzˇen, I. Fiber Types in the Mouse Levator Auris Longus Muscle: A Convenient Preparation to Study Muscle and Nerve Plasticity / I.Erzˇen, E.Cvetko, S. Obreza,D. Angaut-Petit // J. Biol. Chem. – 2000. – Vol. 59 – P. 692–697.
- Suzuki, S. Ca2+ dynamics at the frog motor nerve terminal / S. Suzuki, M. Osanai, M. Murase, N. Suzuki, K. Ito, T. Shirasaki, K. Narita, K. Ohnuma, K. Kuba, H. Kijima // Pflügers Arch. – 2000. – Vol. 440. - № 3. – P. 351-365.
- Kazakov, A. Prostoj vsasyvajushhij jelektrod dlja jelektricheskoj stimuljacii biologicheskih ob’ektov / M.Aleksandrov, N.V.Zhilyakov, E.F. Khaziev, D.V. Samigullin // Mezhdunarodnyj nauchno-issledovatel'skij zhurnal. - – T. 40. – №9. – S. 13-16.
- Eilers, J. A practical guide: dye loading with patch pipettes. / J Eilers., A. Konnerth // In Imaging in neuroscience and development: a laboratory manual / R. Yuste, A Konnerth. – New York: Cold Spring Harbor Laboratory Press . – 2005. – P. 277 - 281.
- Regehr, W.G. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. / W. G. Regehr // In Imaging in neuroscience and development: a laboratory manual / R. Yuste, A Konnerth. – New York: Cold Spring Harbor Laboratory Press . – 2005. – P. 307 - 314.
- Robitaille, R. MuscarinicCa2_responses resistant to muscarinic antagonists at perisynaptic Schwann cells of the frog neuromuscular junction / R. Robitaille, B.S. Jahromi, M.P. Charlton// J Physiol:. CrossRef Medline . – 1997. – Vol. 504. – P. 337–347.
- Robitaille, R. Presynaptic Calcium Signals and Transmitter Release Are Modulated by Calcium-activated Potassium Channels / R. Robitaille ,M.P. Charlton // The Journal of Neuroscience . – 1992. – Vol. 12(1). – P. 297-305.
- Jahromi, B.S. Transmitter release increases intracellular calcium in perisynaptic Schwann cells in situ. / B.S. Jahromi, R. Robitaille, M.P. Charlton // Neuron – 1992 . – Vol. 8(6) – P. 1069-77.
- Yazejian, B. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses / B. Yazejian, D. A. DiGregorio , J. L.Vergara, R. E. Poage, S. D. Merineyand, A. D.Grinnell // J. Neurosci. – 1997. – Vol. 17(9) – P. 2990–3001.
- David, J. Stimulation-induced changes in [Ca2+] in lizard motor nerve terminals. / J.David, J.N. Barrett, E Barrett // J. Physiol. – 1997. – Vol. 504 – P. 83-96.
- Macleod, G.T. Direct Injection of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction / G. T. Macleod // Cold Spring Harb Protoc . – 2012. – P. 797-801.