ЭФФЕКТИВНОСТЬ ПРЕДСТАВИТЕЛЕЙ СЕМЕЙСТВА BACILLACEAE ПРОТИВ ВОЗБУДИТЕЛЕЙ ГРИБНЫХ БОЛЕЗНЕЙ СОИ
ЭФФЕКТИВНОСТЬ ПРЕДСТАВИТЕЛЕЙ СЕМЕЙСТВА BACILLACEAE ПРОТИВ ВОЗБУДИТЕЛЕЙ ГРИБНЫХ БОЛЕЗНЕЙ СОИ
Аннотация
Цель работы – изучить антибиотическую активность представителей семейства Bacillaceae в отношении актуальных для Красноярского края возбудителей грибных болезней сои. В качестве представителей семейства Bacillaceae использованы 22 штамма Bacillus altitudinis, B. atrophaeus, B. cereus, B. megaterium, B. simplex, B. subtilis, Peribacillus simplex и Bacillus sp., выделенные нами из сельскохозяйственных почв региона. В качестве тест-культур использованы 2 изолята Alternaria sp., 2 изолята Fusarium sp. и 1 изолят Sclerotinia sclerotiorum, выделенные из поражённых заболеваниями растений сои. Проверку антибиотической активности проводили методом встречных культур. В качестве показателя использовали площадь колоний тест-культуры в присутствии штамма-антагониста в % к контрольному варианту (без антагониста). Установлено, что антибиотическая активность изученных штаммов варьирует от отсутствия антагонизма (площадь колонии тест-культуры не отличается от контрольного варианта) до почти полного подавления тест-культуры (площадь колонии 5,4% от контроля) в зависимости от штамма-антагониста и от тест-культуры. Двухфакторный дисперсионный анализ подтвердил статистическую значимость (p<0,001) влияния факторов «Штамм-антагонист», «Тест-культура» и эффекта взаимодействия факторов «Штамм-антагонист»х«Тест-культура» на антибиотическую активность с показателями силы влияния соответственно 57,33%, 15,87% и 26,16%. Корреляционный анализ с последующим факторным анализом матрицы корреляций показал, что изучаемые штаммы продуцируют не менее двух независимых антигрибных фактора. Первый фактор активен в отношении представителей родов Alternaria и Fusarium, второй – в отношении Sclerotinia sclerotiorum. На основании полученных результатов для защиты сои от грибных болезней предложена комбинация штаммов Bacillus atrophaeus СХ6 и Pa2 Bacillus sp.
1. Введение
Сою выращивают по всему миру, ведущими странами являются США, Аргентина, Бразилия, Индия. Мировое производство сои с каждым годом увеличивается , . В России также наблюдается ежегодное увеличение посевных площадей под соей, что свидетельствует о растущем интересе к данной культуре. Так, согласно данным Росстат, только за последние пять лет (2020-2024 г.г.) посевные площади под этой культурой выросли в 1,5 раза, достигнув в 2024 г. 4,3 млн. га. .
По результатам мониторинга, проведённого в 2023 г., и охватившего 64,6% посевной площади под соей, на 13,8% обследованных площадей были распространены заболевания, наиболее вредоносными из которых были грибные болезни: септориоз (возбудитель – Septoria glycines), аскохитоз (возбудитель – Ascochyta sojaecola), пероноспороз (возбудитель – Peronospora manshurica) и фузариоз (возбудители – комплекс грибов р. Fusarium), а также бактериоз .
Несмотря на то, что основную долю рынка средств защиты растений от грибных болезней в России и за рубежом занимают химические фунгициды, в последние десятилетия во всём мире наблюдается устойчивая тенденция к внедрению в систему защитных мероприятий биофунгицидов, представляющих собой препараты на основе живых микроорганизмов и/или их метаболитов. Данные препараты являются относительно дешёвыми и (в отличие от химических фунгицидов) экологически безопасными. Однако широкое внедрение биофунгицидов тормозится нехваткой эффективных штаммов, особенно – адаптированных к почвенно-климатическим условиям конкретных регионов.
Текущий (на 18.09.2024 г.) перечень биологических препаратов, согласно Государственному каталогу пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, включает всего 9 фунгицидов на основе бактерий р. Bacillus, р. Pseudomonas и грибов р. Trichoderma. Данные препараты направлены на предотвращение развития таких болезней как церкоспороз, пероноспороз, фузариозные корневые гнили, фузариозное увядание, антракноз, аскохитоз, фузариоз, плесневение семян, альтернариоз при слабом развитии болезни . В связи с этим поиск новых агентов для разработки биопрепаратов для защиты посевов сои от грибных болезней является актуальной задачей.
Цель исследования – изучить антибиотическую активность представителей семейства Bacillaceae в отношении актуальных для Красноярского края возбудителей грибных болезней сои.
2. Объекты и методы
В работе изучали антибиотическую активность 22 штаммов-антагонистов, выделенных из почв Красноярского края (Bacillus altitudinis, B. atrophaeus, B. cereus, B. megaterium, B. simplex, B. subtilis, Peribacillus simplex и Bacillus sp.) в отношении возбудителей грибных болезней сои. Один из штаммов (RSA 1 (B-13893) B. atrophaeus) ранее был запатентован авторами в качестве основы для биопрепарата против грибных болезней сои (Патент на изобретение RU 2791332 C1 07.03.2023), остальные штаммы на антагонизм против возбудителей болезней сои не тестировались. В качестве тест-культур использовали 2 изолята Alternaria sp. (Alt C20, Alt C24), 2 изолята Fusarium sp. (Fus C7, Fus C15) и 1 изолят Sclerotinia sclerotiorum (Scler C16). Идентификацию бактерий проводили методами MALDI-TOF масс-спектрометрии, по нуклеотидной последовательности гена 16SpРНК; идентификацию грибов проводили по характеру спороношения и совокупности других культурально-морфологических признаков.
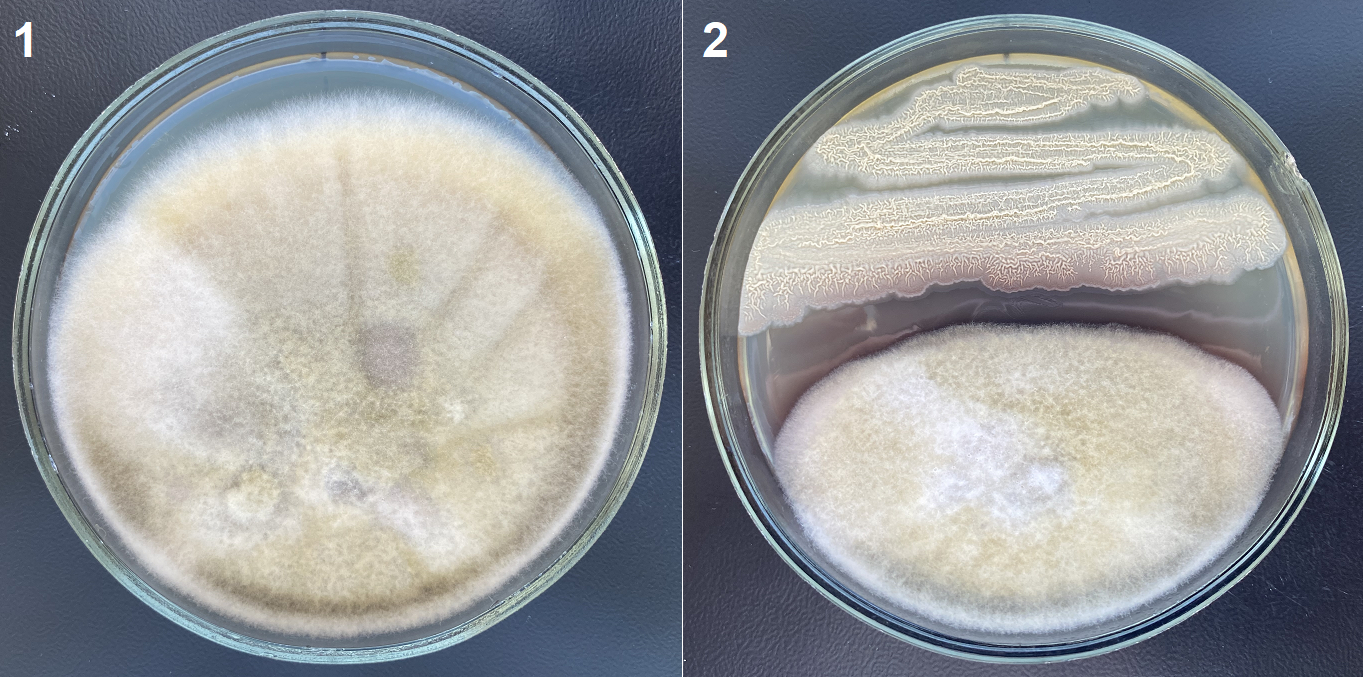
Рисунок 1 - Метод встречных культур на примере Alt C20:
1 – рост тест-культуры в контроле; 2 – рост тест-культуры в присутствии штамма СХ5
3. Результаты и их обсуждение
Зафиксированный в эксперименте антибиотический эффект штаммов-антагонистов варьировал от практически полного подавления роста тест-культуры до отсутствия антибиотического воздействия (табл. 1, рис. 2, 3).
Таблица 1 - Усреднённые по трём повторностям площади колоний тест-культур в присутствии изучаемых штаммов-антагонистов
Штамм, таксономическая принадлежность | Площади колоний тест-культур (в % к контролю) | ||||
Alt C20 | Alt C24 | Fus C7 | Fus C15 | Scler C16 | |
Pa1, Bacillus thuringiensis | 44,4 | 57,6 | 51,1 | 55,4 | 39,2 |
Pa2, Bacillus sp. | 48,6 | 39,6 | 62,3 | 75,9 | 5,4 |
Pa3, Bacillus sp. | 31,9 | 24,5 | 45,8 | 64,4 | 44,9 |
RSA1, (B-13893), Bacillus atrophaeus | 30,1 | 15,0 | 15,8 | 57,6 | 60,7 |
RSA11, Bacillus subtilis/ Bacillus atrophaeus | 28,4 | 40,2 | 49,9 | 53,3 | 43,6 |
RSA12, Peribacillus simplex | 82,3 | 90,5 | 100,0 | 100,0 | 90,2 |
RSA15, Bacillus simplex | 51,3 | 39,7 | 56,0 | 59,1 | 47,1 |
RSA16(1), Bacillus atrophaeus | 39,7 | 33,2 | 51,6 | 56,7 | 33,1 |
RSA16(2), Bacillus atrophaeus | 35,3 | 37,1 | 34,9 | 48,5 | 38,5 |
RSA17, Bacillus cereus group/ Bacillus subtilis | 42,9 | 39,1 | 50,8 | 55,1 | 51,0 |
RSA18, Bacillus atrophaeus | 47,7 | 39,7 | 56,1 | 55,2 | 52,1 |
RSA19, Bacillus atrophaeus | 39,4 | 39,5 | 46,7 | 51,4 | 37,0 |
RSA2, Bacillus altitudinis | 35,2 | 50,8 | 59,4 | 85,9 | 34,0 |
RSA20(1), Bacillus subtilis | 42,5 | 38,7 | 50,5 | 53,8 | 54,7 |
RSA20(2), Bacillus subtilis | 29,1 | 41,9 | 44,1 | 47,8 | 17,6 |
RSA4, Bacillus megaterium | 81,2 | 57,8 | 100,0 | 100,0 | 55,7 |
RSA8, Bacillus atrophaeus | 46,5 | 36,5 | 45,3 | 52,3 | 10,9 |
RSA9, Bacillus atrophaeus | 47,4 | 38,7 | 44,9 | 52,7 | 49,0 |
АЛ3, Bacillus atrophaeus | 43,4 | 33,9 | 46,6 | 55,2 | 32,2 |
АЛ4, Bacillus sp. | 39,5 | 36,6 | 48,6 | 46,9 | 54,6 |
СХ5, Bacillus cereus | 49,2 | 46,2 | 33,1 | 51,8 | 65,6 |
СХ6, Bacillus atrophaeus | 7,2 | 15,2 | 38,0 | 40,3 | 6,2 |

Рисунок 2 - Пример зависимости антибиотического эффекта от штамма-антагониста при использовании одной и той же тест-культуры (Fus C15):
1 – штамм RSA9, подавление роста тест-культуры ярко выражено; 2 – штамм RSA4, подавление роста тест-культуры отсутствует
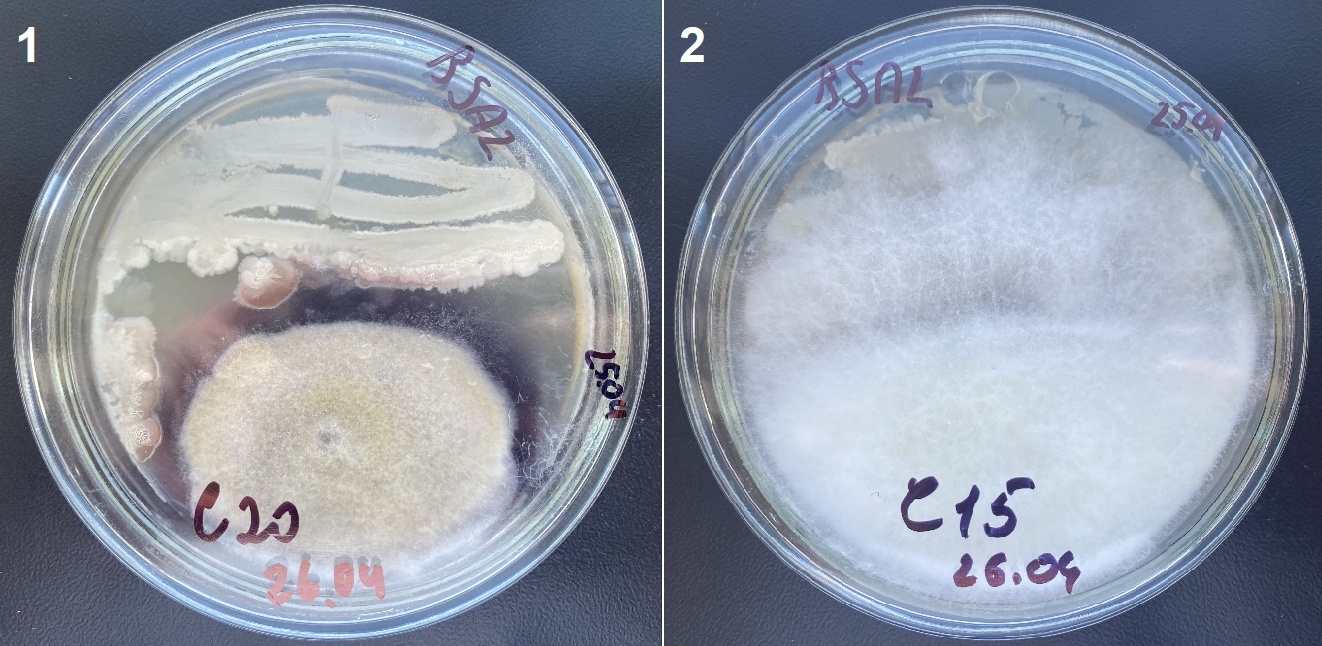
Рисунок 3 - Пример зависимости антибиотического эффекта от тест-культуры при использовании одного и того же штамма-антагониста (RSA2):
1 – тест-культура Alt C20, подавление роста тест-культуры ярко выражено; 2 – тест-культура Fus C15, подавление роста тест-культуры выражено слабо
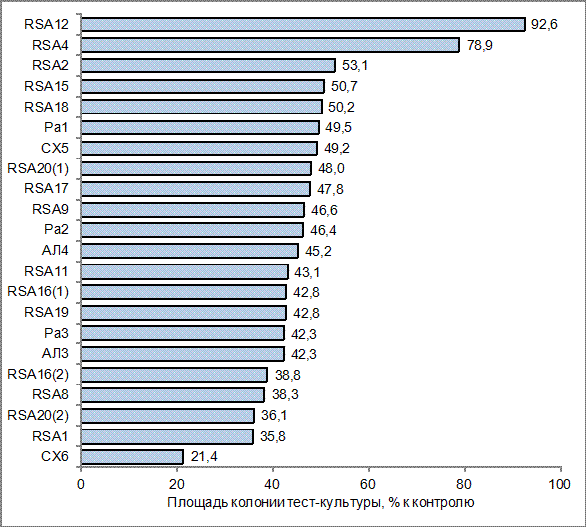
Рисунок 4 - Антибиотический эффект изучаемых штаммов в среднем по тест-культурам
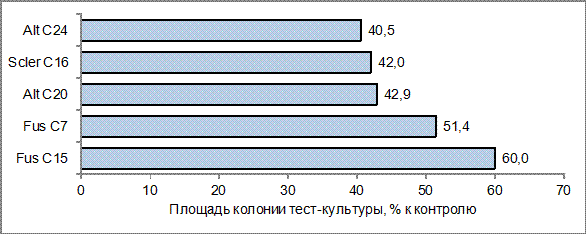
Рисунок 5 - Площадь колоний тест-культур в % к контролю в присутствии антагонистов с усреднением по штаммам
Таблица 2 - Статистическая значимость попарных различий между тест-культурами по средней чувствительности к набору изученных штаммов-антагонистов
Тест-культура | Alt C20 | Alt C24 | Fus C7 | Fus C15 |
Alt C20 | - | <0,001 | <0,001 | <0,001 |
Alt C24 | <0,001 | - | <0,001 | <0,001 |
Fus C7 | <0,001 | <0,001 | - | <0,001 |
Fus C15 | <0,001 | <0,001 | <0,001 | - |
Scler C16 | нет | 0,001 | <0,001 | <0,001 |
Примечание: тест Шеффе
Таблица 3 - Статистическая значимость попарных различий между тест-культурами по средней чувствительности к набору изученных штаммов-антагонистов
Тест-культура | Alt C20 | Alt C24 | Fus C7 | Fus C15 |
Alt C20 | - | <0,001 | <0,001 | <0,001 |
Alt C24 | <0,001 | - | <0,001 | <0,001 |
Fus C7 | <0,001 | <0,001 | - | <0,001 |
Fus C15 | <0,001 | <0,001 | <0,001 | - |
Scler C16 | <0,05 | <0,001 | <0,001 | <0,001 |
Примечание: тест Тьюки
Между тест-культурами выявлены статистически значимые положительные корреляции по чувствительности к изучаемым штаммам-антагонистам. Особенно высокая корреляция (r= 0,832) наблюдалась между Fus C7 и Fus C15. В то же время чувствительность Scler C16 к изучаемым штаммам относительно слабо коррелировала с чувствительностью Alt C20 и Alt C24, и практически не коррелировала с чувствительностью Fus C7 и Fus C15 (табл. 4).
Таблица 4 - Коэффициенты корреляции Пирсона между тест-культурами по чувствительности к антибиотическому действию изучаемых штаммов
Тест-культура | Alt C20 | Alt C24 | Fus C7 | Fus C15 | Scler C16 |
Alt C20 | 1,000 | 0,786 | 0,796 | 0,739 | 0,561 |
Alt C24 | 0,786 | 1,000 | 0,787 | 0,679 | 0,495 |
Fus C7 | 0,796 | 0,787 | 1,000 | 0,832 | 0,304 |
Fus C15 | 0,739 | 0,679 | 0,832 | 1,000 | 0,366 |
Scler C16 | 0,561 | 0,495 | 0,304 | 0,366 | 1,000 |
Примечание: коэффициенты корреляции, статистически значимые на уровне p<0,05, выделены жирным шрифтом
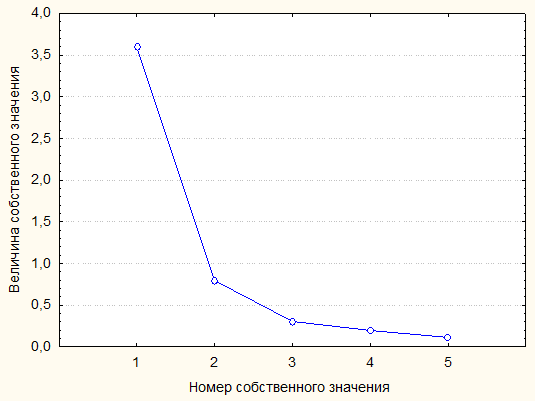
Рисунок 6 - Диаграмма величин собственных значений матрицы коэффициентов корреляции, представленной в таблице 4
Таблица 5 - Главные факторы, выделенные при анализе представленной в таблице 4 матрицы коэффициентов корреляции
Тест-культура | Без вращения | Варимаксное вращение | ||
Фактор 1 | Фактор 2 | Фактор 1 | Фактор 2 | |
Alt C20 | -0,926 | -0,056 | 0,799 | 0,472 |
Alt C24 | -0,896 | 0,003 | 0,799 | 0,406 |
Fus C7 | -0,904 | 0,328 | 0,955 | 0,120 |
Fus C15 | -0,872 | 0,255 | 0,892 | 0,170 |
Scler C16 | -0,599 | -0,785 | 0,176 | 0,972 |
Собственное значение | 3,597 | 0,792 | 3,015 | 1,375 |
% вариации | 71,9 | 15,8 | 60,3 | 27,5 |
Примечание: факторные нагрузки больше 0,70 выделены жирным шрифтом
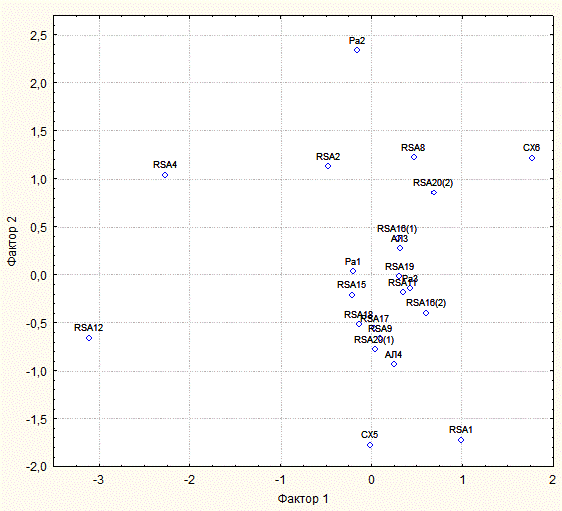
Рисунок 7 - Проекция штаммов-антагонистов на оси, представляющие Фактор 1 и Фактор 2
Примечание: см. табл. 5, без вращения
4. Заключение
Проверка антибиотической активности 22 штаммов Bacillus altitudinis, B. atrophaeus, B. cereus, B. megaterium, B. simplex, B. subtilis, Peribacillus simplex и Bacillus sp., выделенных из почв Красноярского края, в отношении актуальных для региона возбудителей грибных болезней сои р.р. Alternaria и Fusarium, а также Sclerotinia sclerotiorum, показала, что эта активность статистически значимо зависит как от штамма бактерий, так и от таксономического положения возбудителя. В среднем по штаммам-антагонистам максимальную чувствительность к их антибиотическому действию проявил изолят Sclerotinia sclerotiorum, минимальную – представители р. Fusarium. Среди штаммов-антагонистов максимальную антифунгальную активность в среднем по изолятам фитопатогенных грибов проявил штамм Bacillus atrophaeus СХ6. В то же время спектр чувствительности фитопатогенных грибов к штаммам-антагонистам, равно как и спектр антифунгальной активности антагонистов, различается. Это подтверждается наличием статистически значимого эффекта взаимодействия факторов «штамм-антагонист» и «тест-культура гриба». Корреляционный анализ с последующим факторным анализом матрицы корреляций показал, что изучаемые штаммы продуцируют как минимум два антигрибных антибиотика, различающихся спектром действия. При этом интенсивность продуцирования этих антибиотиков у разных штаммов различается. В этой связи для защиты сои от грибных болезней необходимо использовать комбинации штаммов, различающихся по спектру антифунгальной активности. На основании результатов нашего исследования, для почвенно-климатических условий Красноярского края можно рекомендовать комбинацию штаммов Bacillus atrophaeus СХ6 и Pa2 Bacillus sp.
