ИССЛЕДОВАНИЕ ВЛИЯНИЯ СОКА АРБУЗА НА ЛЮМИНЕСЦЕНТНУЮ РЕАКЦИЮ БАЗИДИОМИЦЕТА MYCENA GOMBAKENSIS
ИССЛЕДОВАНИЕ ВЛИЯНИЯ СОКА АРБУЗА НА ЛЮМИНЕСЦЕНТНУЮ РЕАКЦИЮ БАЗИДИОМИЦЕТА MYCENA GOMBAKENSIS
Аннотация
В работе представлены результаты исследования стимуляции арбузным соком люминесценции in vivo мицелия пеллет гриба Mycena gombakensis и in vitro выделенных из мицелия ферментных люминесцентных систем. Показано, что арбузный сок не является ни субстратом ферментной люминесцентной системы, ни НАДНФ. Однако его добавка к люминесцентной системе, содержащей эндогенный субстрат и активированной НАДФН, приводит к увеличению люминесцентного сигнала. Наблюдается стимуляция люминесценции ферментной системы без эндогенного субстрата, с предварительной добавкой НАДФН и экзогенного субстрата. Добавление арбузного сока к воде, в которой находятся пеллеты, также приводит к увеличению интенсивности люминесценции.
1. Введение
В последнее десятилетие был сделан значительный шаг к пониманию механизма грибной биолюминесценции. Было установлено, что грибное свечение обусловлено рядом последовательных ферментативных реакций и представляет собой замкнутый цикл. На начальном этапе кофейная кислота преобразуется в гиспидин, затем из гиспидина, в присутствии фермента гиспидин-3-гидроксилазы, образуется люциферин. Люциферин окисляется в присутствии люциферазы до оксилюциферина, который и излучает кванты света. Оксилюциферин может быть ферментативно преобразован в кофейную кислоту и цикл повторяется
, , . Светящиеся грибы, по всей видимости, обладают единым механизмом биолюминесценции и содержат общий набор необходимых компонентов, в том числе и гиспидин, как предшественник субстрата ферментативной реакции , .При проведении исследовательских работ с использованием грибных люминесцентных систем in vivo и in vitro, в том числе оценивают эффекты различных веществ на интенсивность люминесценции. Интерес вызывают вещества стимуляторы, добавка которых приводит к увеличению интенсивности люминесцентного сигнала, но которые при этом не являются компонентами ферментной люминесцентной системы (фермент, субстрат, НАДФН). Экстракты из биомассы грибов
, , , культуральные жидкости от выращивания грибного мицелия , и экстракты некоторых растений , вероятно, не стоит относить к стимуляторам, так как они содержат гиспидин.Ранее мы сообщали
о том, что внесение сока ананаса к пеллетам базидиомицета Mycena gombakensis стимулирует люминесцентную систему пеллет in vivo. Увеличение люминесценции характерно и при добавлении сока ананаса к ферментным системам in vitro выделенным из мицелия. При этом экспериментально показано, что сок ананаса не содержит субстрат люминесцентной реакции и НАДФН.В данной работе основное внимание уделяется влиянию арбузного сока (АС) на люминесценцию гриба M. gombakensis в экспериментах in vivo и in vitro. Как показали исследования, АС не содержит ни субстрат ферментной системы гриба M. gombakensis, ни НАДФН, однако, его добавка к мицелию и к выделенной ферментной системе приводит к увеличению люминесценции.
2. Методы и принципы исследования
Арбузы, выращенные в Алтайском крае, Рубцовском районе, п. Березовка, приобретены в торговой сети города Красноярска. АС получали отжимом из мякоти плода с использованием ручного пресса с последующим центрифугированием в течение 15 мин при 16000g на центрифуге Avanti J–E (Beckman–Coulter, США). Полученные образцы сока были лиофильно высушены (ЛС–500 (Россия)) и хранились до момента использования при -20°С. Лиофильная сушка позволяет осуществлять длительное хранение образцов без потери активности, а также при необходимости получить образцы с большей концентрацией. Перед проведением исследований образцы разводились в деионизованной воде Milli–Q system (Millipore, США).
В работе была использована культура обладающего свечением базидиомицета M. gombakensis (культура 2371) из Коллекции Института биофизики СО РАН. Жидкая картофельно-сахарозная среда (200 г/л картофеля, 20 г/л сахарозы) использовалась для наращивания мицелия гриба M. gombakensis. Глубинное культивирование проводили в колбах Эрленмейера, содержащих жидкую питательную среду при температуре 27°С с постоянным перемешиванием. Для получения пленочного мицелия культивирование осуществляли стационарно в чашках Петри, содержащих жидкую питательную среду, при температуре 27°С. Подробнее используемые методы культивирования описаны в работах , .
Полученные методом глубинного культивирования мицелиальные пеллеты в форме глобул отмывали деионизованной водой в течение суток и использовали для проведения экспериментов in vivo. В пробирку, содержащую 300 мкл воды помещали пеллету и прописывали базовый сигнал люминесценции. После чего аккуратно, без перемешивания вносили исследуемый образец АС и регистрировали изменения люминесцентного сигнала.
Холодные экстракты, выделенные из мицелия гриба M. gombakinsis и содержащие ферментную люминесцентную систему, использовали для оценки влияния АС в экспериментах in vitro. Ферментные системы получали по методике, описанной ранее , . Полученный из плодовых тел не светящегося гриба Pholiota squarrosa горячий экстракт, использовали в качестве экзогенного субстрата для ферментной люминесцентной системы. Способ получения горячего экстракта описан в работе .
Регистрацию люминесцентных сигналов in vivo и in vitro систем проводили на люминометре Glomax 20/20 (Promega BioSystems Sunnyvale, Inc., США), с режимом регистрации одно измерение в секунду.
Спектр биолюминесценции был получен с использованием спектрофлуориметра Cary Eclipse (Agilent Technologies, США). Измерения проводили следующим образом: в кварцевую кювету спектрофлуориметра, содержащую ферментную люминесцентную систему из гриба M. gombakensis и НАДФН, последовательно вносили экстракт P. squarrosa и регистрировали спектр биолюминесценции, а затем добавляли АС и вновь регистрировали спектр.
Гель-документирующая система GelDoc XR Imaging System (Bio-Rad Laboratories, Inc., США) была использована для визуальной регистрации люминесцентного сигнала пеллет. Черно-белые изображения люминесцентных областей были преобразованы в цветные с использованием программного обеспечения.
3. Основные результаты и обсуждение
3.1. Влияние АС на люминесцентные системы, выделенные из биомассы гриба M. gombakensis
В работе были использованы 2 вида ферментных систем, выделенных из мицелия гриба M. gombakensis, не имеющая эндогенного субстрата и содержащая эндогенный субстрат.
Отсутствие изменения в люминесцентном сигнале ферментной системы после внесения НАДФН свидетельствует о том, что система не содержит эндогенный субстрат. (Рис.1). Отсутствие изменений в регистрируемом сигнале ферментной системы, активированной НАДФН, после внесения АС означает, что сок не является субстратом люминесцентной системы (Рис.1).
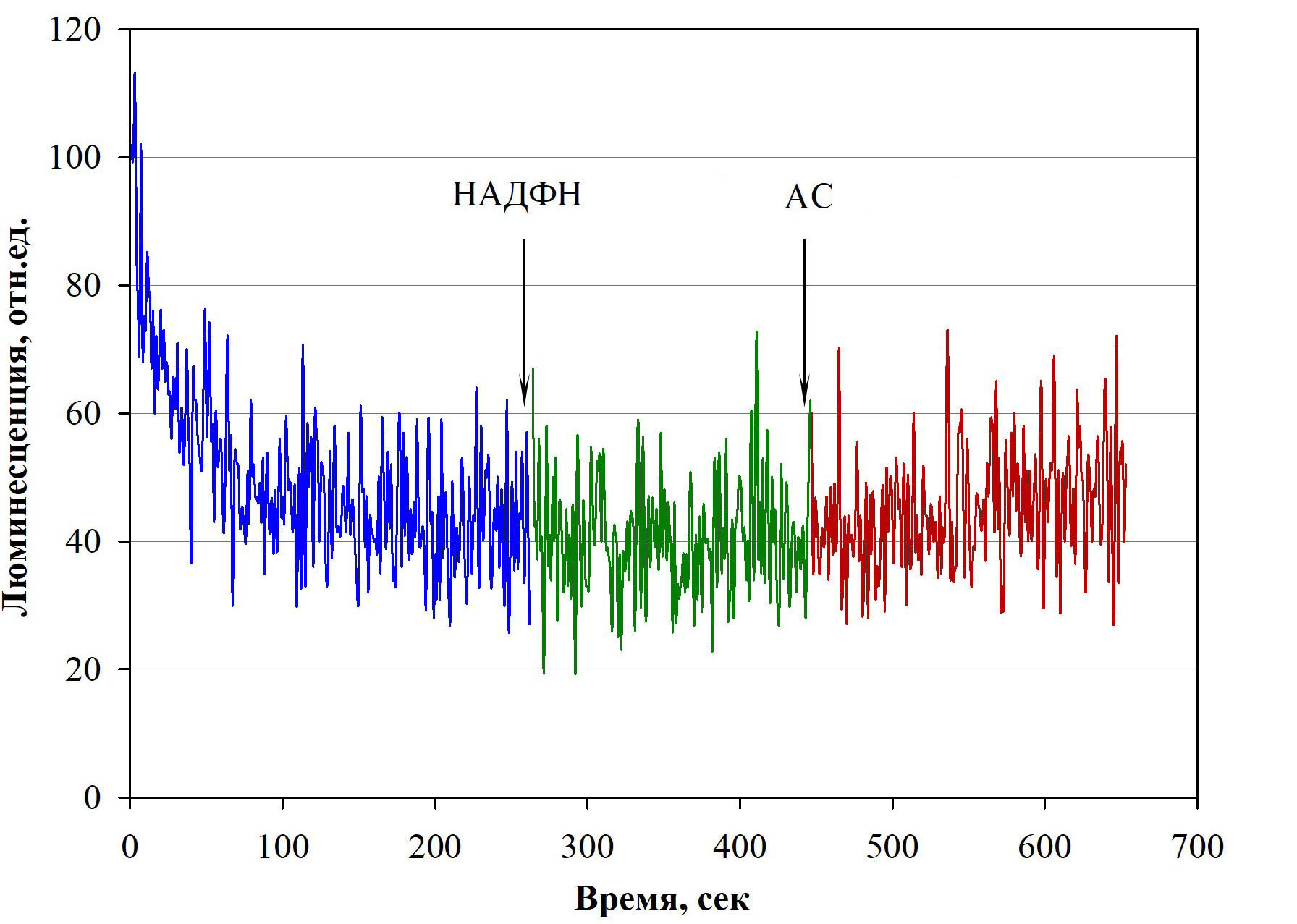
Рисунок 1 - Интенсивность люминесценции ферментной системы из гриба M. gombakensis при добавке АС
Примечание: стрелками указаны моменты последовательного внесения НАДФН и АС
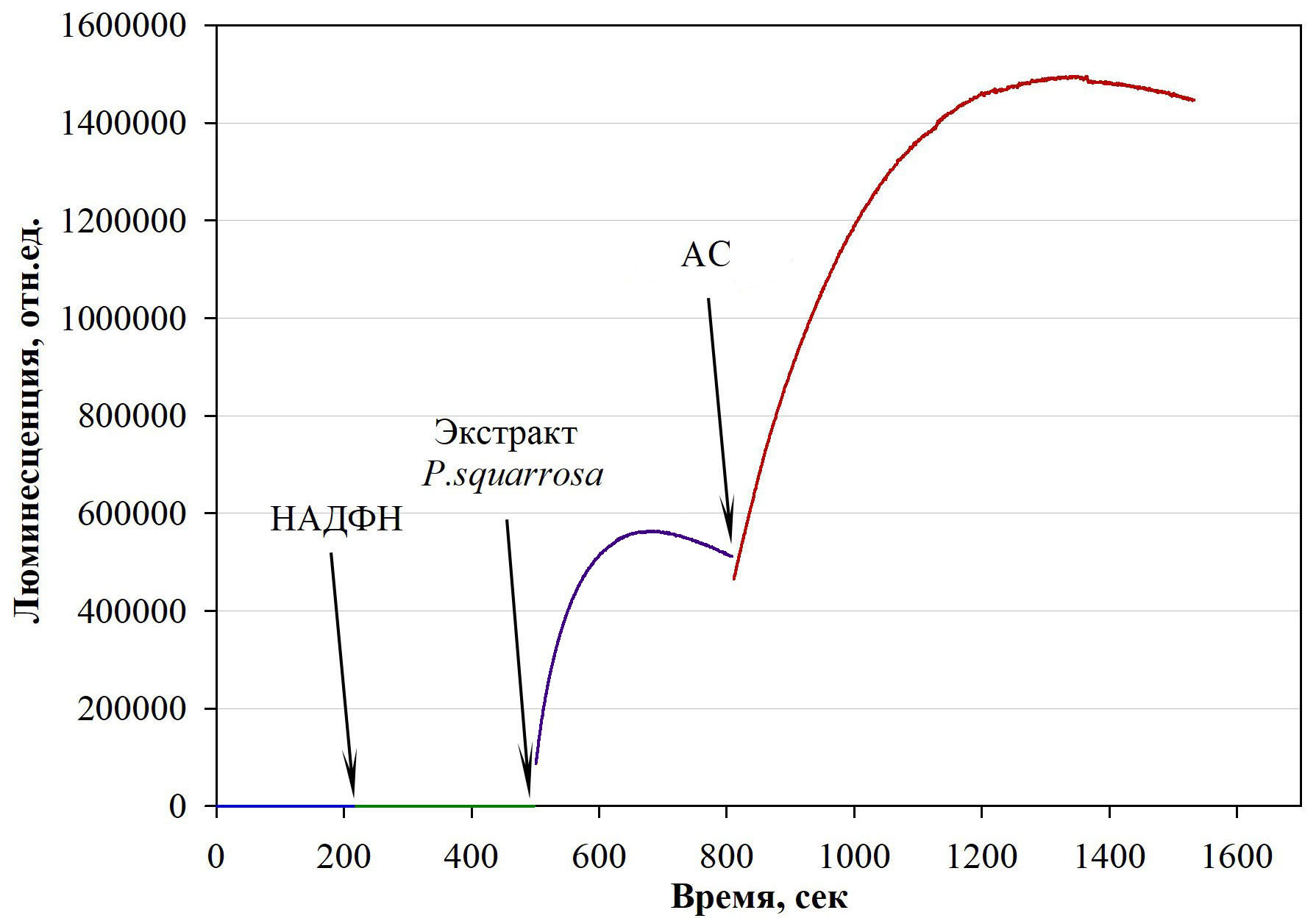
Рисунок 2 - Стимуляция люминесценции ферментной системы без эндогенного субстрата, выделенной из гриба M. gombakensis после добавки АС
Примечание: стрелками указаны моменты последовательного внесения: НАДФН, экстракта из P. squarrosa и АС
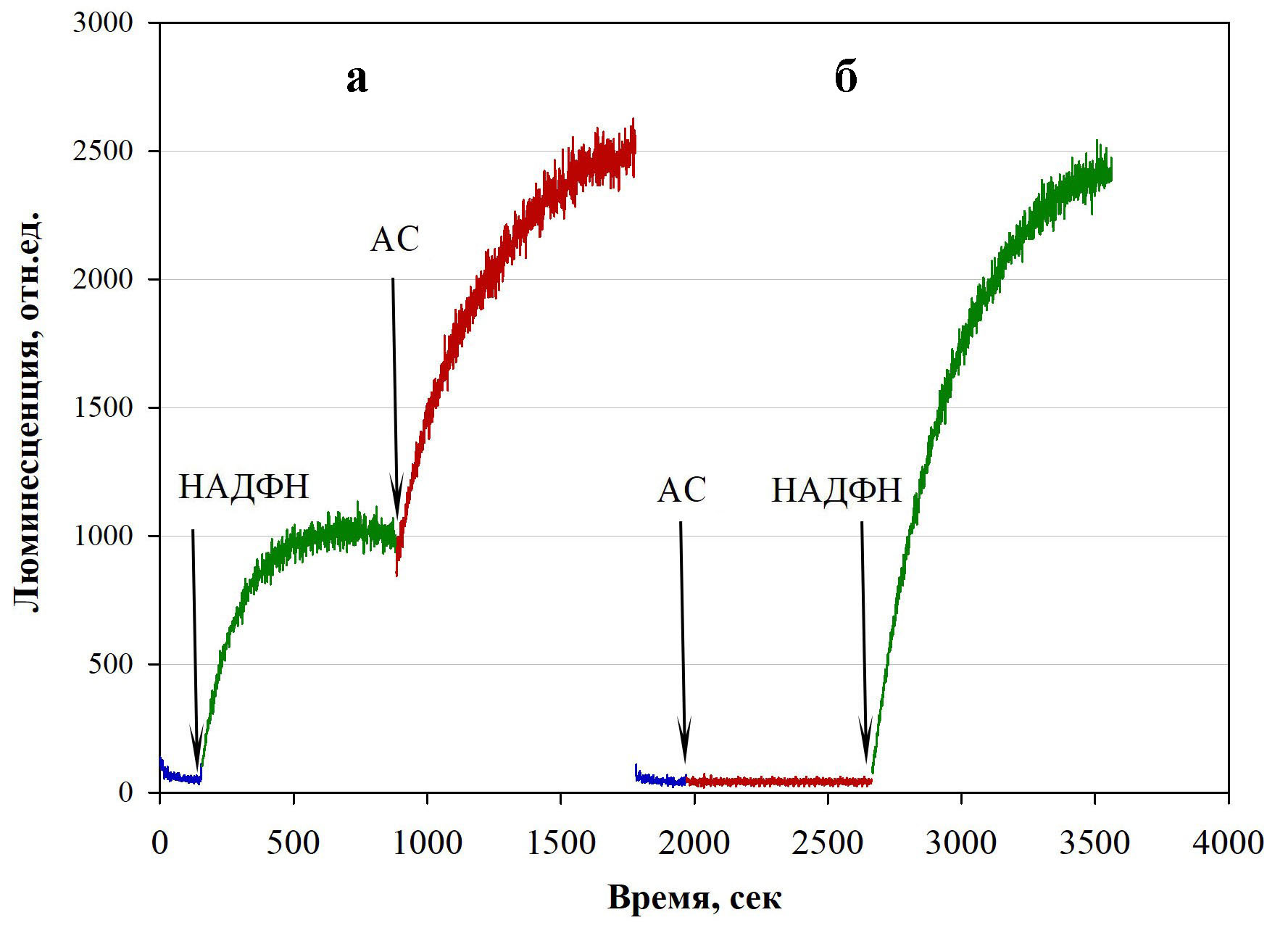
Рисунок 3 - Стимуляция люминесценции ферментной системы, содержащей эндогенный субстрат, выделенной из гриба M. gombakensis после добавки АС
Примечание: стрелками указаны моменты внесения: НАДФН и АС
АС является стимулятором люминесценции ферментных систем in vitro с экзогенным (Рис.2) и эндогенным субстратом (Рис.3а), а также стимулирует ферментную систему мицелия пеллет in vivo, содержащих эндогенный субстрат (Рис. 4,5).
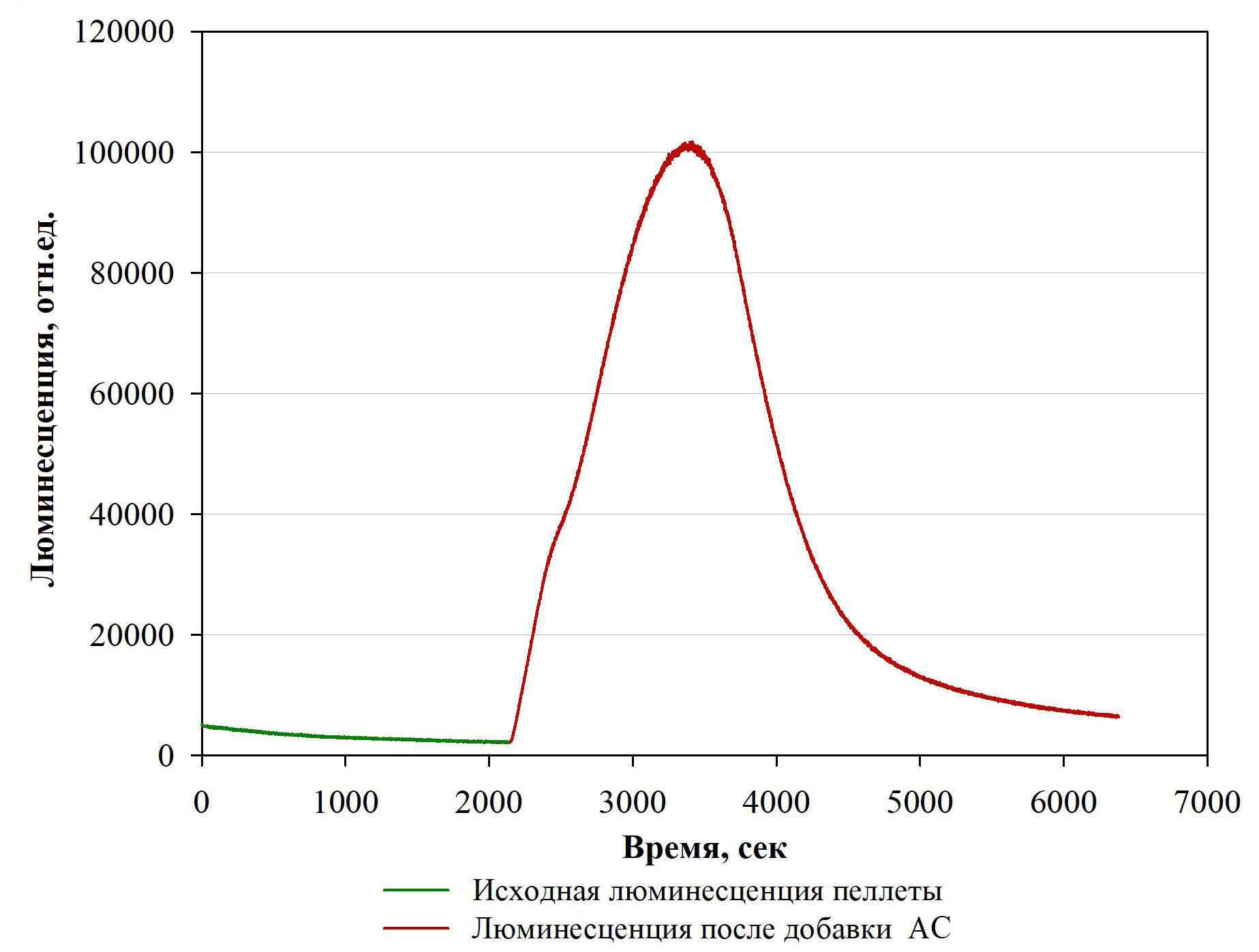
Рисунок 4 - Изменение интенсивности люминесценции пеллеты M. gombakensis после добавления в воду АС
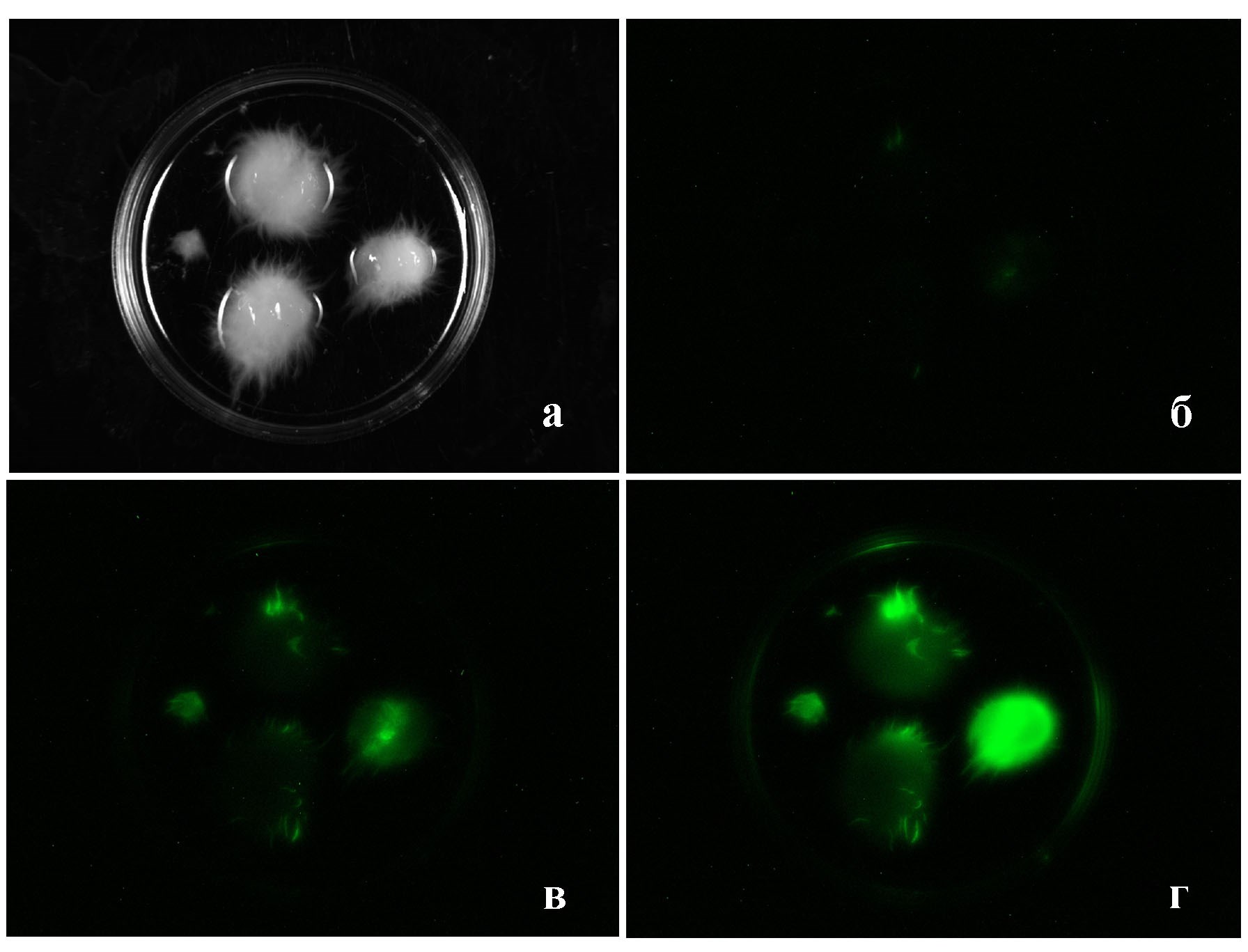
Рисунок 5 - Динамика люминесценции пеллет мицелия культуры M. gombakensis:
а – внешний вид пеллет; б – исходное свечение пеллет; в –свечение после добавления в воду АС через 5 минут; г – свечение после добавления АС через 30 минут
Измерение спектров биолюминесценции ферментативной люминесцентной реакции после добавления экстракта P. squarrosa и АС показало, что максимум биолюминесценции в обоих случаях составляет 520 нм (Рис.6).
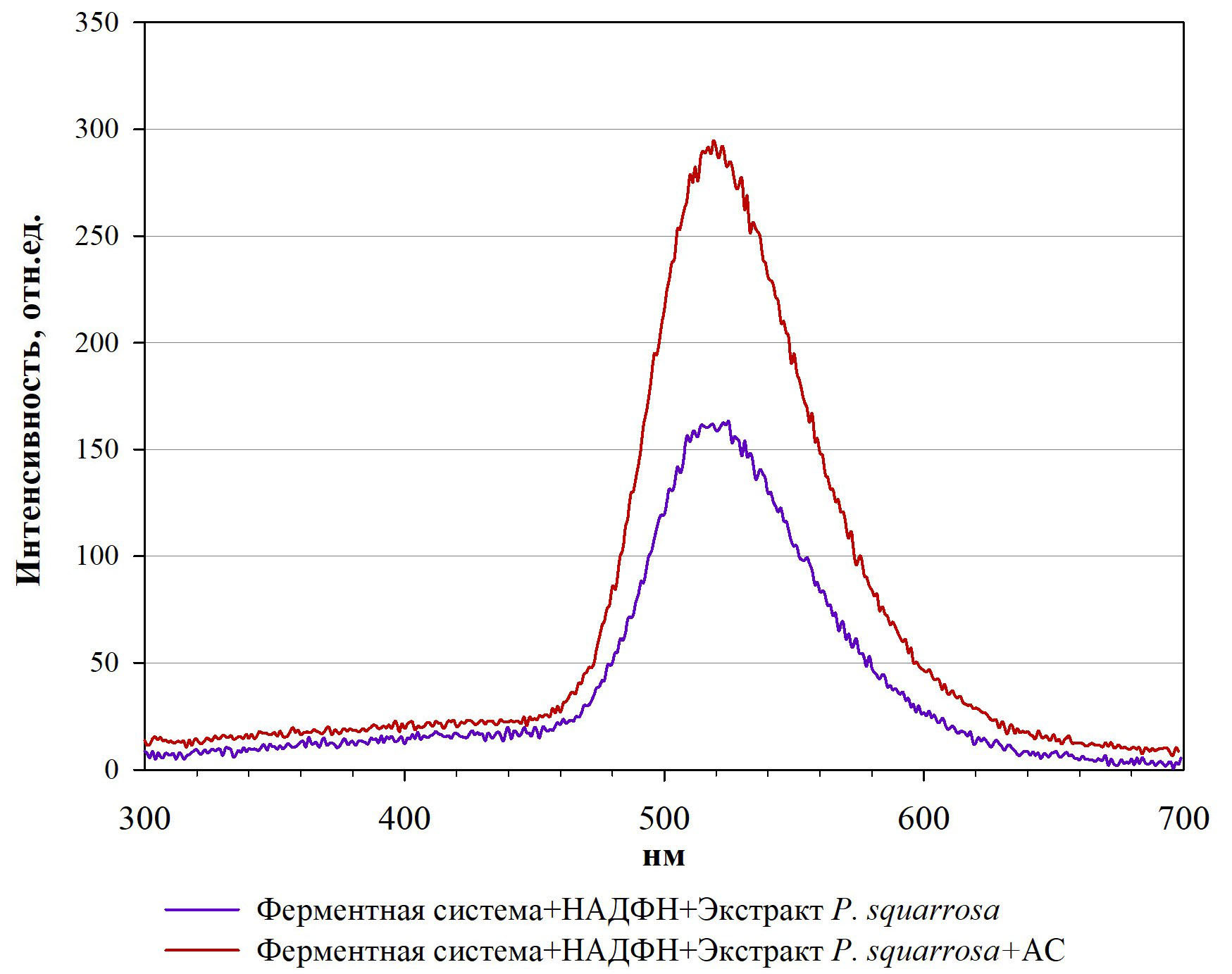
Рисунок 6 - Спектры биолюминесценции ферментной системы после добавки экстракта P. squarrosa (экзогенный субстрат) и после последующей добавки АС (стимулятор)
4. Заключение
В ходе работы была выявлена стимуляция АС люминесценции ферментной системы (in vitro) и мицелия пеллет (in vivo) базидиального гриба M. gombakensis. При этом показано, что АС не является ни субстратом выделенной ферментной системы, ни НАДФН. Механизм стимулирующего эффекта пока не ясен и требует дальнейших исследований.
