ВЛИЯНИЕ НИТРАТОВ ДВУХВАЛЕНТНОГО ЖЕЛЕЗА И МАГНИЯ НА ГЕЛЕОБРАЗОВАНИЕ В ВОДНЫХ РАСТВОРАХ КАЛИЕВО-ФОСФАТНЫХ СТЕКОЛ
ВЛИЯНИЕ НИТРАТОВ ДВУХВАЛЕНТНОГО ЖЕЛЕЗА И МАГНИЯ НА ГЕЛЕОБРАЗОВАНИЕ В ВОДНЫХ РАСТВОРАХ КАЛИЕВО-ФОСФАТНЫХ СТЕКОЛ
Аннотация
Исследовано влияние добавок нитратов железа и магния на процесс гелеобрпазования в водном растворе калиево-фосфатного стекла. Показано, что добавки нитрата двухвалентного железа способствуют более полному гелеобразованию в исследованной системе, по сравнению с добавками нитрата трехвалентного железа и магния. Изучена структура аэрогелей, полученных на основе жидкого калиево-фосфатного стекла. Показано, что гели с добавками нитрата железа имеют более связанную структуру, сформированную пирофосфатными цепочками и содержат в своем составе нитрат-ионы при общем содержании азота 15-20 ат.%. Исследована кинетика растворения полученных аэрогелей в воде. Установлено, что скорость растворения изученных гелей в воде после первых 5 дней линейно зависит от времени выдержки, так же как и скорость перехода в раствор нитрат-ионов. На основании полученных результатов делается вывод о возможности использования полученных гелей в качестве комплексных удобрений пролонгированного действия.
1. Введение
Известно, что традиционные азотсодержащие удобрения (нитраты, мочевина, аммофос) имеют высокую скорость растворения в воде. В результате большая часть азота (70-85%) при поливе вымывается из почвы и загрязняет окружающую среду , . Внедрение нитрат-ионов в оксидную матрицу, имеющую регулируемую скорость растворения в воде, позволит значительно увеличить эффективность использования удобрений, снизить их количество, вносимое в почву и, как следствие, снизить загрязнение подпочвенных вод нитратами , .
Калиево-фосфатные стекла, как вариант материала для формирования матрицы, содержащей нитрат-ионы, представляют особый интерес, в связи с тем, что и фосфор и калий являются важнейшими по значению, после азота, элементами, необходимыми для нормального развития растений. Низкая температура варки калиево-фосфатных стекол позволила предположить, что возможно введение в их состав нитрат-ионов, при использовании в составе шихты смеси фосфатов и нитратов. Однако, попытки варки подобных стекол при температурах ниже температуры стабильности ионов NO3- (500-550оС) показали, что получаемые расплавы представляют собой две несмешивающиеся жидкие фазы, интенсивно кристаллизующиеся при охлаждении. В связи с этим, для диспергирования нитрат-ионов в фосфатной матрице аморфного строения был выбран метод, аналогичный рассмотренному в ранее опубликованных работах , , в которых, в частности, было показано, что стекла, имеющие химический состав метафосфата натрия (NaPO3), довольно легко могут быть переведены в форму натриево-фосфатного жидкого стекла, а полученный коллоидный раствор может быть преобразован в гель при его перемешивании с водным раствором Al(NO3)3·9H2O, имеющим концентрацию не менее чем 0,56М. Однако присутствие Al3+ в удобрениях в количестве, превышающем 1 мол.%, является нежелательным, ввиду токсичности ионов алюминия для растений .
В этой связи целью настоящего исследования являлось получение стабильных аквагелей при взаимодействии калиево-фосфатного жидкого стекла с водным раствором Fe(NO3)2·6H2O, используемого в качестве гелеобразователя, и дальнейшее получение на этой основе фосфатно-нитратных ксерогелей, перспективных для применения в качестве комплексных удобрений с регулируемой растворимостью в воде. Выбор нитрата двухвалентного железа в качестве гелеобразователя вместо нитрата алюминия объясняется тем, что эффект гелеобразования в жидком калиево-фосфатном стекле может быть достигнут при введении любого нитрата металла, водный раствор которого имеет значение рН менее 7,8-8,0 . Дополнительно исследовалась возможность получения аналогичного эффекта при введении в раствор жидкого калиево-фосфатного стекла добавок Mg(NO3)2•6H2O, принимая во внимание, что соли магния вызывают эффект гелеобразования в водных растворах некоторых органических полимеров . Кроме того, учитывался тот факт, что магний является важным микроэлементом и его присутствие должно увеличивать положительный эффект от использования синтезированного таким образом комплексного удобрения.
2. Методы и принципы исследования
Фосфатное стекло, использованное для получения водных растворов (жидкого стекла), получали на основе шихты, содержащей NH4H2PO4 (CTR 98%+) и K2HPO4 (Alquime 98%+) в весовом соотношении 2:3. Варку стекла проводили в муфельной электропечи Thermoline 62700 в алундовом тигле при температуре 350 оС в течение 1 часа. Расплав стекла отливали в дистиллированную воду при весовом соотношении вода: стекло равном 2:1 и растворяли в воде при интенсивном перемешивании в течение 4 часов при температуре 60 оС.
Полученный раствор смешивали при комнатной температуре с водным раствором Fe(NO3)2∙6H2O, Mg(NO3)2∙6H2O или их смесей (все Aldrich 98+); и интенсивно перемешивали в течение получаса до полной гомогенизации. В ряде экспериментов вместо нитрата двухвалентного железа использовался нитрат трехвалентного железа Fe(NO3)3∙9H2O. После прекращения перемешивания в полученном растворе формировался гель, который далее фильтровался с помощью бумажного фильтра Whatman 40 и подвергался просушиванию в сушильном шкафу в течение 24 часов при 60 оС.
По указанной методике было получено несколько типов гелей. Состав смесей, использованный для их приготовления, представлен в таблице 1.
Таблица 1 - Состав смесей, использованных для формирования гелей на основе базового фосфатного стекла (ФС)
№ смеси | Обозначение смеси | Содержание компонентов, г | V*,% | |||
Fe(NO3)2∙6H2O | Mg(NO3)2∙6H2O | ФС | H2O | |||
1 | 3Fe | 3 | 0 | 4.7 | 15 | 90 |
2 | 2Fe-1Mg | 2 | 1 | 4.7 | 15 | 62 |
3 | 2Mg-1Fe | 1 | 2 | 4.7 | 15 | 35 |
4 | 3Mg | 0 | 3 | 4.7 | 15 | 10 |
Примечание: * V – объемная доля геля после отстаивания
Гели, полученные после просушивания (аэрогели), исследовали методами электронной сканирующей микроскопии (электронный микроскоп Explorer Aspex FEI, оснащенный приставкой энерго-дисперсионного анализа (ЭДС)), ИК спектроскопии (ИК Фурье-спектрометр ФТ-801), рентгеновского фазового анализа (рентгеновский дифрактометр ARLX’TRA (Cu Kα, λ = 0.15439 нм)) и дифференциального термического анализа (дифференциальный сканирующий калориметр NETZSCH STA 449 F3 Jupiter, скорость нагрева образцов 10 К·мин− 1).
Для изучения кинетики растворения полученных аэрогелей в воде проводилось тестирование в соответствии с методикой, представленной в работе . Навески порошков аэрогелей №1 и 2 (фракция 0,16-0,315 мм) в количестве 10 г помещали в колбу и заливали дистиллированной водой (100 мл). Каждый образец выдерживался в воде соответствующее количество дней без перемешивания, после чего раствор отфильтровывался на бумажном фильтре (WhatmanNo40), остаток геля просушивался (60 оС, 24 ч) и взвешивался для определения потери массы, а полученный раствор анализировался на присутствие нитрат-ионов с помощью иономера И-160МИ с ион-селективным электродом HI4013.
3. Основные результаты и их обсуждение
При введении в водный раствор базового фосфатного стекла нитрата магния в составе смесей № 3 и 4 устойчивые гели получить не удалось; значительное количество воды, 65 и 90 объемн.%, соответственно, в состав геля не входило даже при длительной выдержке. Микрофотографии аэрогелей, полученных на основе составов № 1 и 2, приведены на рис.1. Данные гели имеют непрерывную структуру При этом структура гелей, полученных с использованием добавок только нитрата железа – более однородна.

Рисунок 1 - Микрофотографии гелей, полученных с использованием нитрата железа (А) и смеси нитрата железа и нитрата магния (Б), а также их химический состав
Примечание: данные ЭДС
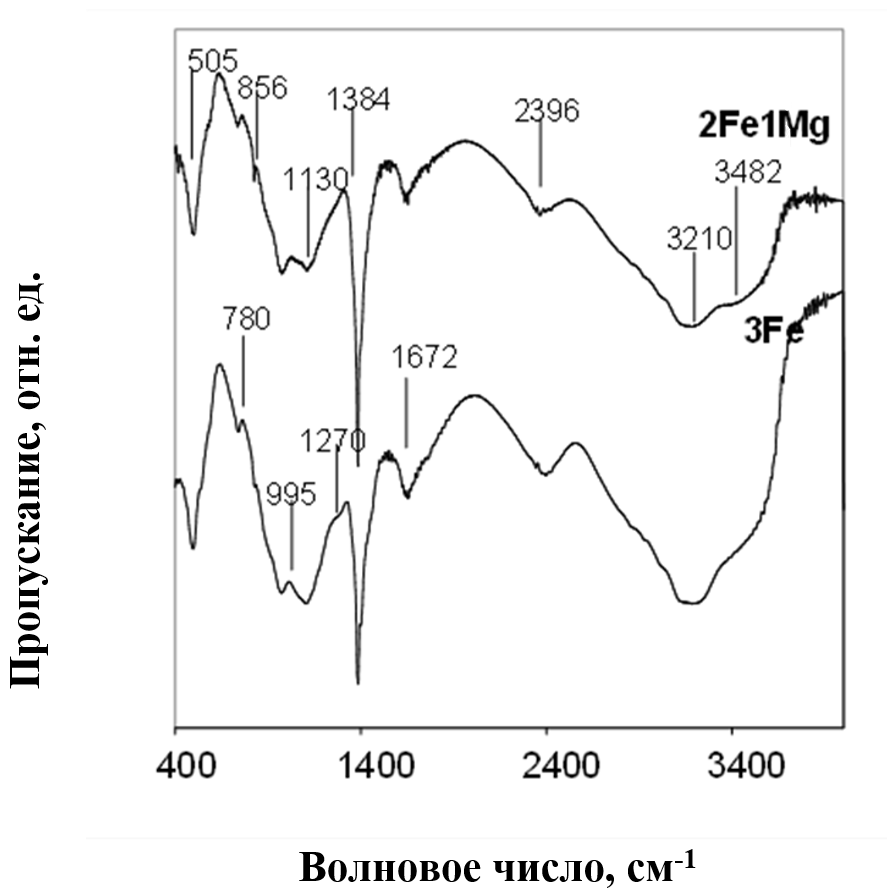
Рисунок 2 - ИК спектры пропускания аэрогелей №1 (3Fe) и №2 (2Fe1Mg)
Рентгеновские дифрактограммы полученных гелей, представленные на рис. 3. показывают, что аморфный аэрогель содержит включения кристаллических фаз KNO3 и K0,11(NH4)0,89H2PO4.
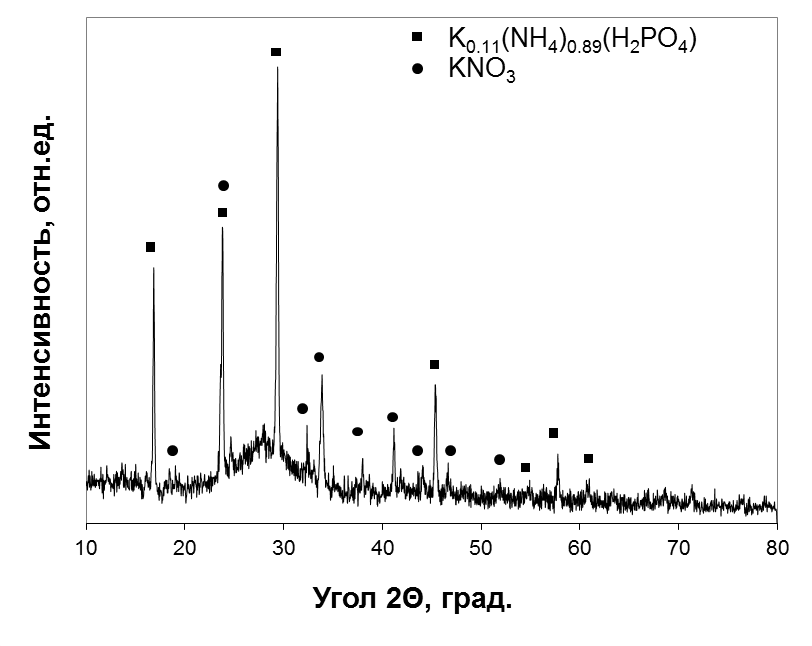
Рисунок 3 - Рентгеновская дифрактограмма аэрогеля №2 (2Fe-1Mg)
При этом, гелеобразование в фосфатном жидком стекле под действием нитрата двухвалентного железа Fe(NO3)2·6Н2О является предпочтительным в сравнении с использованием для этой цели водного раствора нитрата трехвалентного железа Fe(NO3)3 9H2O, что подтвердили контрольные эксперименты. Это может быть связано с тем, что прямое введение в жидкое фосфатное стекло ионов Fe3+ приводит к очень быстрому локальному гелеобразованию; при этом большая часть нитрат-ионов остается в водном растворе, удаляемом из системы при фильтрации геля. В результате гель, полученный с использованием Fe(NO3)3·9H2O, после сушки, по данным низкоэнергетического энергодисперсионного анализа, содержит не более 10% азота и не является перспективным для использования в качестве азотсодержащего комплексного удобрения. С другой стороны, постепенное гелеобразование в растворе жидкого калиево-фосфатного стекла с добавками нитратов двухвалентного железа и магния, происходящее по мере окисления Fe2+ до Fe3+, позволяет осуществить гелеобразование постепенно во всем объеме раствора; в результате нитрат-ионы оказываются равномерно распределены в структуре полученного геля.
Данные термического и термогравиметрического анализа (рис.4, 5) показывают, что полученные аэрогели включают в свой состав некоторое остаточное количество растворителя (Н2О). В образце №1 (3Fe) содержание физически сорбированной воды, удаляемой при нагреве в интервале до 120 оС, составляет около 3 масс.%, а в образце №2 (2Fe1Mg) – 13 масс.%. Присутствует также некоторое количество более прочно фиксированной в структуре геля воды, удаляемой в интервале температур 120-200 оС (10 и 4 масс.% для образцов №1 и 2, соответственно). Таким образом, общее содержание молекулярной воды в структуре обоих видов аэрогелей – сопоставимо (13 и 17 масс., соответственно для образцов №1 и 2), однако в аэрогеле, полученном при введении в жидкое калиево-фосфатное стекло только нитрата железа – эта вода связана в структуре геля значительно прочнее.
В температурном интервале 200-310 оС при нагревании образцов наблюдается серия эндотермических пиков. Согласно данным эти пики можно отнести к реакции распада ионов NO3-.
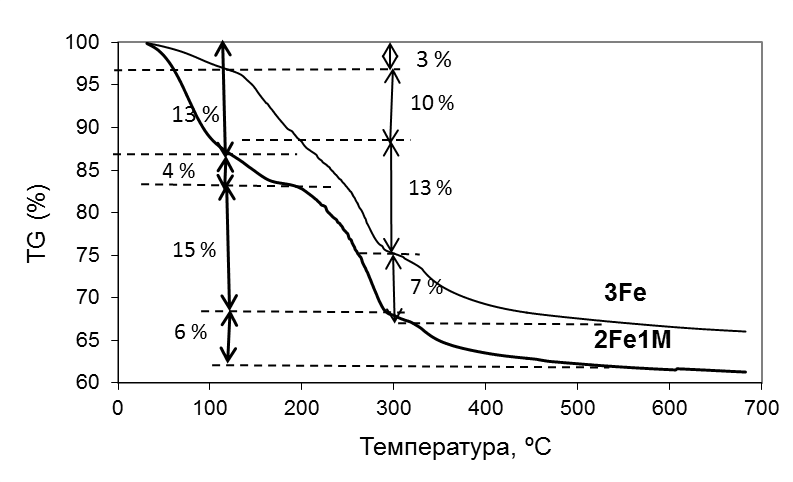
Рисунок 4 - Кривая термогравиметрического анализа образцов порошков № 1(3Fe) и №2 (2Fe1Mg)
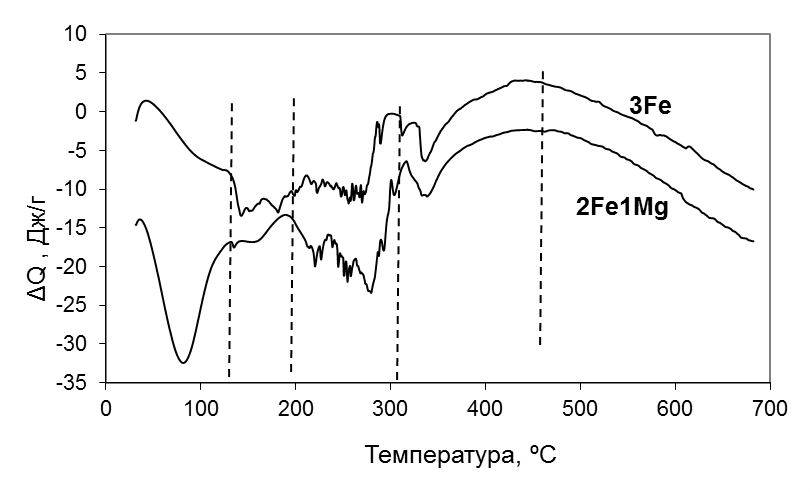
Рисунок 5 - Кривая термического анализа образцов порошков № 1(3Fe) и №2 (2Fe1Mg)
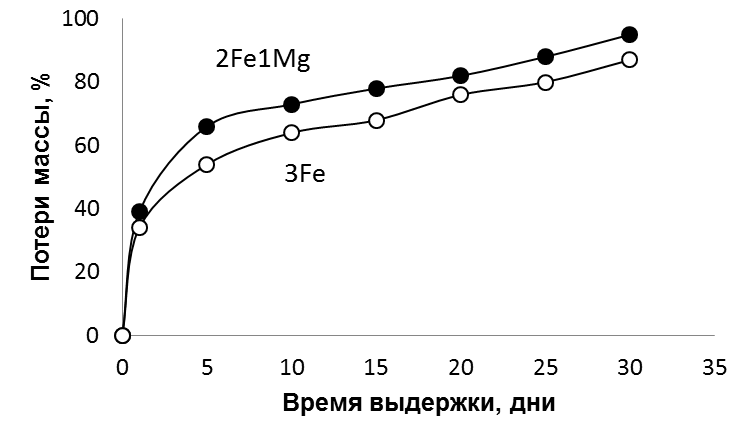
Рисунок 6 - Кинетика растворения (потери массы) аэрогелей составов 1 (3Fe) и 2 (2Fe1Mg) в дистиллированной воде
Полученные данные показывают, что аэрогели, приготовленные на основе калиево-фосфатного жидкого стекла с добавками нитратов железа и магния, имеют достаточно стабильную структуру, медленно деградирующую под действием воды и постепенно высвобождающую химические элементы, составляющие основу для питания растений (K, P, N). Подобные характеристики позволяют рассматривать их в качестве комплексных удобрений пролонгированного действия.
4. Заключение
В результате проведённых исследований установлены следующие закономерности:
1. Введение нитратов железа и магния в водные растворы, полученные при растворении калиево-фосфатного стела (жидкие калиево-фосфатные стекла), приводит к гелеобразованию.
2. Нитрат двухвалентного железа является более эффективным гелеобразователем, чем нитрат трехвалентного железа и нитрат магния.
3. Гелеобразование в исследованной системе сопровождается переходом Fe2+ в Fe3+ под действием растворенного кислорода и также может быть связано с переходом части нитратного азота в аммонийную форму.
4. При просушивании полученных гелей формируется аморфная фосфатная матрица, стабилизированная ионами Mg2+ и Fe3+. При этом ионы Fe3+ способствуют «сшиванию» пирофосфатных цепочек в структуре геля, а ионы Mg2+ формированию метафосфатных структурных фрагментов.
Полученные гели характеризуются более высокой стабильностью в водных растворах по сравнению с гелями, полученными на основе жидких фосфатных стекол при барботировании СО2 без добавок нитрата двухвалентного железа или его смеси с нитратом магния, что позволяет их рассматривать как перспективный вид комплексных азотсодержащих удобрений пролонгированного действия.
