ФОТОЗАЩИТНЫЕ МЕХАНИЗМЫ КОЖИ И ВОЗМОЖНОСТИ ИХ КОРРЕКЦИИ ВТОРИЧНЫМИ МЕТАБОЛИТАМИ РАСТЕНИЙ
ФОТОЗАЩИТНЫЕ МЕХАНИЗМЫ КОЖИ И ВОЗМОЖНОСТИ ИХ КОРРЕКЦИИ ВТОРИЧНЫМИ МЕТАБОЛИТАМИ РАСТЕНИЙ
Обзорная статья
ORCID: 0000-0002-1246-4131,
Белорусский государственный университет, Минск, Республика Беларусь
*Корреспондирующий автор(kostyuk[at]bsu.by)
АннотацияКожа человека, являясь крупнейшим органом организма, подверженным воздействию агрессивной окружающей среды, обеспечивает физическую, фотохимическую, антиоксидантную, метаболическую и иммунную защиту кожи от ультрафиолетового (УФ) излучения. Тем не менее при избыточном воздействии ультрафиолета в коже могут развиваться множество патологических нарушений, включая солнечную эритему, преждевременное старение и рак. Поскольку физиологической функцией многих вторичных метаболитов растений (ВМР) является их защита от воздействия УФ-излучения они представляют большой интерес как потенциальные нетоксичные, гипоаллергенные компоненты солнцезащитных композиций, обладающие не только фотопротекторными свойствами, но и способные воздействовать на редокс и свободно-радикальный баланс, а также модулировать метаболический и иммунный ответ кожи при избыточном воздействии УФ-излучения.
Ключевые слова: УФ-излучение; кожа, кератиноциты, фотопротекторы, вторичные метаболиты растений.PHOTOPROTECTIVE MECHANISMS OF THE SKIN AND THE POSSIBILITY OF THEIR CORRECTION VIA SECONDARY PLANT METABOLITES
Review article
Kostyuk V.A.*
ORCID: 0000-0002-1246-4131,
Belarusian State University, Minsk, Belarus
* Corresponding author (kostyuk[at]bsu.by)
AbstractAs the largest organ of the body exposed to an aggressive environment, the human skin provides physical, photochemical, antioxidant, metabolic and immune protection of the skin from ultraviolet (UV) radiation. Nevertheless, with excessive exposure to ultraviolet light, skin is at risk of developing many pathological disorders, including solar erythema, premature aging and cancer. Since the physiological function of many secondary metabolites of plants is their protection from UV radiation, they are of great interest as potential non-toxic, hypoallergenic components of sunscreen compositions that not only have photoprotective properties but also capable of affecting redox and free radical balance, as well as modulating the metabolic and immune response of the skin in the case of excessive exposure to UV radiation.
Keywords: UV radiation; skin, keratinocytes, photoprotectors, secondary metabolites of plants. ВведениеВ зависимости от интенсивности воздействия на кожу солнечное УФ-излучение оказывает как благотворное, так и негативное влияние на организм человека. Общеизвестно, что под действием УФ-излучения в коже инициируется процесс образования из холестерола холекальциферола (витамина Д3), необходимого для всасывания кальция в кишечнике и обеспечения нормального развития костной ткани. Показано, что даже кратковременное воздействие солнечного света влияет на синтез серотонина (активирует) и мелатонина (ингибирует) гормонов, отвечающих за циркадный (суточный) биологический ритм, тем самым способствуя выходу организма из депрессивных состояний, связанных с дефицитом серотонина [1]. Вместе с тем, избыточное воздействие ультрафиолета является основным природным фактором, ответственным за множество патологических нарушений в коже, включая солнечную эритему, преждевременное старение и рак [2].
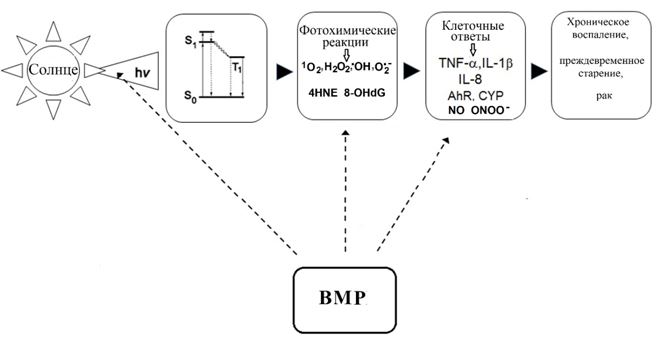
Солнечное УФ-излучение достигая открытых поверхностей тела человека последовательно воздействует на различные структуры, осуществляющие механическую, фотохимическую, антиоксидантную, метаболическую и иммунную защиту кожи и подлежащих тканей. В первую очередь УФ-излучение инициирует фотохимические реакции в покрывающих кожу поверхностных липидах или кожном сале. Затем УФ-излучение воздействует на верхний слой эпидермиса, состоящий из отмерших кератиноцитов, и на межклеточные липиды рогового слоя. И, наконец, УФ-излучение непосредственно или посредством фотохимических интермедиатов воздействует на кератиноциты, меланоциты, фибропласты и другие клетки эпидермиса и дермы [3]. На такое воздействие клеточные элементы кожи отвечают характерными воспалительными, метаболическими и пролиферативными реакциями, направленными как на устранение последствий повреждающего действия УФ-излучения, так и на адаптацию к нему [2]. К сожалению, возрастание УФ-нагрузки на организм человека за счет увеличения интенсивности солнечной радиации, появления искусственных источников УФ-излучения и широкого распространения пляжного отдыха приводит к тому, что защитные механизмы кожи оказываются неспособными полностью устранить результаты воздействия УФ-излучения, что обуславливает множество негативных последствий: от преждевременного старения до инициирования канцерогенеза. Поэтому поиск средств дополнительной эффективной и безопасной защиты кожи от избыточного воздействия солнечного излучения является важной и во многом нерешенной проблемой современной дерматологии и косметологии [4]. В последнее время опубликованы результаты ряда экспериментальных исследований [5], [7], свидетельствующих, что решение данной проблемы может быть связано с использованием растений и морских организмов в качестве важнейшего источника соединений, обладающих не только фотопротекторными свойствами, но и способных воздействовать на редокс и свободно-радикальный баланс, а также метаболический и иммунный ответ кожи при избыточном воздействии УФ-излучения (рисунок 1).
Рис. 1 – Основные механизмы защитного действия ВМР при воздействии УФ-излучения на кожу
В обзоре рассматриваются вопросы, касающиеся классификации и роли вторичных метаболитов (ВМ) в наземных и водных растениях, особенностей фотохимических реакций с их участием и возможности использования ВМ для усиления фотозащитных свойств кожи в условиях избыточного воздействия УФ-излучения.
Фотоактивные вторичные метаболиты наземных и морских растений: биосинтез и физиологические эффекты
Наземные и морские растения синтезируют первичные метаболиты, необходимые для их роста, деления и размножения (белки и аминокислоты, липиды и жирные кислоты, поли- и олигосахариды). На их долю приходится более 90 – 95% сухой массы высших и морских растений [8]. Вместе с тем, растения, а также низшие эукариоты, такие как морские микро и макроводоросли, кораллы, горгонарии и др., характеризуются способностью осуществлять биосинтез так называемых вторичных метаболитов, которые не используются в процессах роста, деления и размножения, но необходимы для защиты и адаптации к постоянно меняющимся условиям окружающей среды (биотический и абиотический стресс) [9], [10], [11]. Например, вторичный метаболизм и образование ВМ у растений и морских организмов активируется при воздействии ультрафиолета, рентгеновских лучей, ультразвукового облучения, экстремальных температур (холод или жара), поступлении в организм тяжелых металлов, солей и органических токсинов, механических повреждениях [7]. Возрастание продукции ВМ имеет место и в результате бактериальных, вирусных или паразитарных инфекций. Таким образом, вторичный метаболизм и ВM функционируют как простейший аналог иммунной системы и системы детоксикации у животных организмов [12].
Множество известных на сегодняшний день ВМ растений (ВМР), число которых превышает несколько десятков тысяч, принято делить в соответствии с их химической структурой на три основных класса:
- фенилпропаноиды (синоним этилпропаноиды) и их производные, такие как простые полифенольные соединения (кислоты, спирты и альдегиды), ароматические/полиароматические полифенолы (флавоноиды, стильбены, куркуминоиды, кумарины и т. д.) и их гликозиды (гликозидные фрагменты, в основном рамноза, манноза, рутиноза);
- терпеноиды (изопреноиды) – самый большой класс вторичных метаболитов растений, составляющий около 60% известных природных продуктов, характеризуются наличием углеродного скелета, образованного изопреновыми звеньями, с которым связаны дополнительные функциональные группы, обычно содержащие кислород;
- азотсодержащие гетероциклы, такие как алкалоиды, пурины, пиримидины, порфирины, хлорофиллы, флавины и др.
Большинство ВМР синтезируется в ответ на воздействие солнечного УФ-излучения [9], [13], [14], в следствие чего повышается фотоустойчивость растительного организма. Например, синтез флавоноидов и других фенилпропаноидов и их гликозидов активируется в растительных клетках через фенилпропаноидный путь сразу после воздействия УФ [9], [14], [15]. ВМР обеспечивают защиту от солнечного света в широком спектральном диапазоне: от УФ-излучения до видимого и инфракрасного света, благодаря наличию в химической структуре хромофоров, которые поглощают энергию солнечного света [10], [14]. Поглощение кванта света молекулой переводит ее в возбужденное состояние:
A (S0) + hv → A*(S1)
где, A (S0) – молекула в основном состоянии; A*(S1) – молекула в возбужденном состоянии.
Из возбужденного состояния молекула может вернуться в основное (тушение), при этом избыток энергии, принесенный квантом света, либо перейдет в тепловую энергию в результате безызлучательных переходов (колебательной релаксации, внутренней конверсии, интеркомбинационной конверсии), либо – в энергию испускаемого возбужденной молекулой кванта света (флуоресценция, фосфоресценция).
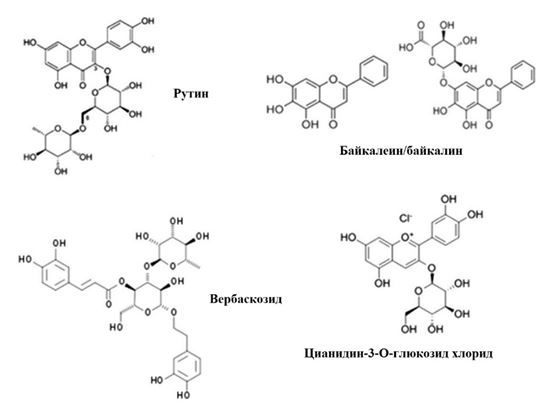
Следует отметить, что молекулярная структура полифенольных соединений состоит из конденсированных ароматических 5- и 6-углеродных колец с несколькими OH-группами (рисунок 2), благодаря чему они могут эффективно поглощать УФ (A + B) излучение, переходя в возбужденное состояние.
Рис. 2 – Примеры молекулярной структуры полифенольных соединений
При этом, если возможно вращение фрагментов молекулы вокруг соединяющей их химической связи, а к таким молекулам относятся флавоноиды и другие растительные полифенольные соединения, то полученная при взаимодействии с фотоном энергия может рассеиваться в виде тепла в результате интеркомбинационной конверсии. В этом случае молекула в результате перераспределения энергии возбуждения по вращательным и колебательным степеням свободы и возникновения ряда конформаций, характеризуемых различными значениями потенциальной энергии, совершает безызлучательный переход в основное состояние (S0). Поэтому они более безопасные, чем классические синтетические компоненты солнцезащитных кремов [16], которые также являются ароматическими полифенолами, но не обладают указанными выше особенностями молекулярной структуры [17], [18]. Кроме того, присутствие гликозильных фрагментов в ВМР обеспечивает повышенную фотостабильность, поэтому многие из гликозилированные метаболиты не подвержены разрушению УФИ [19].
Кроме фотопротекторного действия многие фенилпропаноиды ВМР (стильбены, катехины, флавоноиды и терпеноиды) способны защищать макромолекулы и структурные элементы растений от разрушительного воздействия активных форм кислорода (супероксидных анион-радикалов, гидроксильных радикалов, пероксидов и синглетного кислорода), которые образуются при воздействии солнечного света на различные клеточные компоненты: нуклеиновые кислоты (ДНК, РНК), белки и другие хромофоры, диспергированными в цитозоле и мембранах в присутствии молекулярного кислорода [13].
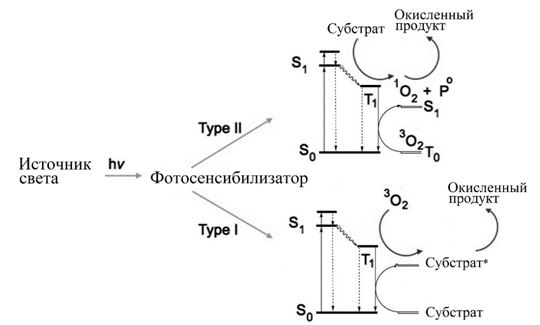
Напротив, большинство азотсодержащих гетероциклов и терпеноидов являются фотосенсибилизаторами (рисунок 3), которые используют УФ-энергию, видимое или инфракрасное солнечное излучение для ускорения биологически важных фотохимических реакций, опосредуемых свободными радикалами, такие как фотосинтез или синтез терпеноид- и полифенолсодержащих полимеров [9].
Рис. 3 – Вторичные метаболиты растений функционируют как фотосенсибилизаторы, возбуждаемые солнечным светом и инициирующие последующие фотохимические реакции
Следует отметить, что полифенолы, содержащие альдегидную группу (группы), могут проявлять свойства фотосенсибилизаторов из-за снижения энергии фотовозбуждения [20], [21]. Поэтому, когда растительные экстракты включаются без дополнительной обработки в состав топических фотозащитных средств, существует большой риск развития побочных реакций, обусловленных присутствием фотосенсибилизирующих вторичных метаболитов, которые приводят к фитофотодерматозу или аллергической реакции [12].
Фотохимический барьер в коже человека
Топология фотоактивных компонентов поверхности растений и низших морских и кожи человека сходна в том, что снаружи находятся молекулы, являющиеся фотопротекторами (меланины, мелатонин и белки, богатые ароматическими аминокислотами) [22], [23], которые экранируют и уменьшают интенсивность воздействия солнечного света на молекулы – фотосенсибилизаторы (аминокислоты триптофан и его производные, ретиноевая кислота, порфирины, флавины, гемоглобин, пурины и пиримидины) [24], [25], [26], [27]. У человека эффективность кожного барьера зависит от баланса фотопротекторы / фотосенсибилизаторы, который постепенно ухудшается при старении или заболевании кожи [25], [28].
Первый фотохимический барьер, на который воздействует солнечное излучение составляют поверхностные липиды кожи, формирующие защитную гидрофобную пленку, которая в наибольшей степени выражена на участках кожи, более подверженных воздействию солнечного света [3]. Липидный барьер представляет собой смесь липидов эпидермиса, происходящих из отшелушивающего рогового слоя, в основном состоящего из фосфолипидов остатков кератиноцитов и продуктов их гидролиза, и из триглицеридов, стеринов и липофильных витаминов (витамин E и коэнзим Q10), продуцируемых себоцитами, секреторными клетками сальных желез. Липиды, синтезируемые в себоцитах, богаты легко окисляемым тритерпеноидом скваленом, сильно липофильной молекулой, которая рассматривается не только как водоизолирующий и сглаживающий кожу фактор, но также, что наиболее важно, как жертвенный антиоксидант [29], [30]. После быстрой деградации липофильных антиоксидантов под воздействием ультрафиолета сквален остается главным защитником ненасыщенных фосфолипидов эпидермальных клеточных мембран от свободнорадикального окисления. Также было доказано, что короткоживущие, гидрофильные, низкомолекулярные продукты окисления сквалена, способные быстро диффундировать в жизнеспособные эпидермальные и дермальные слои, являются ранним сигналом, запускающим адаптивный иммунный ответ кожи на УФ-облучение [31], [32]. Вместе с тем, если сквален вырабатывается сальными железами или наносится на кожу в чрезмерных количествах, он может вызвать неконтролируемое повышение токсичных альдегидов и эпоксидов, которые могут оказывать провоспалительное действие, ускоряющее процессы старения и способствующее канцерогенезу [3]. Скорость окисления кожного сквалена была предложена в качестве объективного количественного параметра для измерения эффективности солнцезащитных препаратов [33]. Показано, что полифенолы растительного происхождения, обладающие антиоксидантными свойствами, ингибируют окисление сквалена, обусловленное УФ-излучением [7], [32].
Кроме окисленного сквалена, как фотохимические медиаторы передачи УФ-сигналов к клеткам кожи были идентифицированы продукты фотоокисления триптофана [34], 4-гидрокси-2-ноненаль, конечный продукт окисления арахидоновой кислоты [35] и 9-гидроксиоктадекадиеновая кислота, продукт фотоокисления линолевой кислоты [36].
В нижележащих клеточных слоях кожи (эпидермисе и дерме) поглощение УФ-света обусловлено эндогенными хромофорами, такими как трансурокановая кислота, меланины, порфирины, флавины, хиноны, триптофан и его фотоокисленные метаболиты N' - формилкинуренин и 6-формилиндоло [3,2-b] карбазол (FICZ), гидропиридины и конечные продукты гликирования [22], [23], [24], [25]. Такое взаимодействие препятствует проникновению ультрафиолета в дерму и выполняет фотозащитную функцию. Недавно было установлено, что аналогичную функцию выполняют эпидермальные и дермальные белки, содержащие УФ-хромофоры [37].
Редокс-барьер кожи человека
Кожа человека, являясь крупнейшим органом организма, подверженным воздействию агрессивной окружающей среды, обеспечивает редокс и антиоксидантный барьер на пути токсикантов, присутствующих в атмосфере, и для УФ-излучения. В клетках эпидермиса в большом количестве присутствуют жирорастворимые антиоксиданты, в основном альфа-токоферол, и антиоксидантные ферменты, такие как каталаза, супероксиддисмутазы (SOD), глутатионпероксидазы [38], [39]. Недавно была обнаружена важная роль индуцибельной митохондриальной марганцевой SOD в ответе кератиноцитов на УФ-облучение, опосредованное рецептором эпидермального фактора роста (EGF) [40]. Чтобы эффективно противодействовать воздействиям окружающей среды, эпидермис нормальной кожи человека содержит высокий уровень воды и водорастворимых антиоксидантов, таких как глутатион, тиоредоксин, витамин С, мочевая кислота и коэнзим Q10. Содержание антиоксидантов в коже нарастает от поверхности к более глубоким слоям эпидермиса [38], [39].
Эндогенный внутрикожный мелатонин и его метаболиты, которые образуются в ферментативных и неферментативных реакциях окисления, по-видимому, выполняют наиболее важную антиоксидантную роль в условиях окислительного стресса, вызванного УФ-облучением благодаря способности эффективно перехватывать гидроксильные радикалы [41], [42]. Метаболиты мелатонина, проявляющие антиоксидантные свойства (6 - гидроксимелатонин, N (1) -ацетил-N (2) -формил-5-метоксикинурамин и 5 - метокситриптамин), были обнаружены в трех типах клеток кожи человека: кератиноцитах, меланоцитах и дермальных фибробластах [43]. Внеклеточное пространство дермы содержит большое количество водорастворимых антиоксидантов, таких как аскорбиновая кислота, мочевая кислота и глутатион. Кроме того, несколько ключевых структурных белков, широко присутствующих в роговом слое, волосах и сосочках дермы и характеризующихся высоким содержанием аминокислот-хромофоров, а именно цистеина, триптофана и тирозина, по-видимому, эффективно защищают кожу от фотохимического окислительного стресса [37]. Высокий уровень активных форм кислорода (АФК) также может осуществлять сигнальную функцию, в основном, посредством механизма, зависимого от ядерного фактора эритроид 2 (Nrf2), запуская в качестве адаптивного ответа экспрессию ферментов, детоксицирующих АФК [44].
Фактор транскрипции Nrf2 считается ключевым элементом защиты клеток от абиотических стрессов окружающей среды, таких как УФ-излучение, загрязняющие вещества, ксенобиотики, низкомолекулярные токсины, лекарственные препараты, тяжелые металлы, озон, стресс и др. [45], [46]. Гены, регулируемые этим ядерным фактором, включают ферменты фазы II детоксикации, репарацию ДНК, воспалительную передачу сигналов и антиоксидантный ответ. Недавно сообщалось о регулируемой Nrf2 экспрессии генов в ответ на солнечное УФ(A + B)-излучение в культивируемых клетках кожи человека [47]. Благодаря этим находкам, Nrf2 был предложен в качестве фармакологической мишени при преждевременном старении кожи, связанном с фотоповреждениями [48], [49].
Метаболический барьер кожи человека
Кожа является эффективным биохимическим / токсикологическим барьером на пути проникновения низкомолекулярных ксенобиотиков и лекарств. Топически применяемые ВМР являются также ксенобиотиками, которые необходимо детоксицировать и удалить путем активации в коже метаболических ферментов. Эти ферменты участвуют и в биотрансформации токсичных эндогенных метаболитов, таких как окисленные / фотоокисленные липиды и аминокислоты. Начальный этап биотрансформации, приводящий к уменьшению липофильности ксенобиотиков и токсичных эндогенных метаболитов, инициируется ферментами окислительной фазы детоксикации (фаза I), к которым относится суперсемейство цитохрома 450 (CYPs), флавопротеинмонооксигеназа, алкогольдегидрогеназа, эпоксидгидроксилаза и др. Окисленный продукт подвергается восстановительной или конъюгативной модификации ферментами фазы II детоксикации (глутатион-S-трансфераза, UDP-глюкуоронозилтрансфераза, катехол-O-метилтрансфераза, N-ацетилтрансфераза и сульфотрансферазы). Экспрессия ферментов, метаболизирующих ксенобиотики, регулируется ядерными рецепторами, факторами транскрипции и эпигенетическими механизмами, включая микроРНК. Полагают, что в коже особенно важны процессы детоксикации, обеспечиваемые ферментами фазы II [50]. Тем не менее следует отметить, что и ферменты фазы I − Cyp1A1, и Cyp1B1 (белок и мРНК), в значительной степени индуцируются в кератиноцитах человека как ароматическими химическими веществами, включая органические токсины, лекарственные препараты, ВMP, косметические средства, так и после облучения УФB [34], [51], [52]. Детоксицирующие ферменты расположены в основном в кератиноцитах эпидермиса [53], хотя эти ферменты также экспрессируются в меланоцитах и фибробластах [50], [54]. Их индукция и активность регулируются арилуглеводородным рецептором (AhR), транскрипционным фактором, перемещающимся из цитоплазмы в ядро. AhR считается сенсором и основным регулятором адаптивного метаболического ответа на широкий спектр ксенобиотиков. Он также играет ведущую роль в метаболической деградации эндобиотиков. Например, простагландины, лейкотриены и другие эйкозаноиды служат лигандами AhR-активаторами его пути передачи сигнала [55]. Также появляется все больше доказательств того, что физиологическая роль AhR в коже не ограничивается метаболизмом ксенобиотиков и эндобиотиков, а включает такие функции клеток кожи, как пролиферация, межклеточные контакты, иммунные и воспалительные реакции, меланогенез [56]. Среди эндогенных лигандов AhR, идентифицированных к настоящему времени, есть продукты фотоокисления триптофана, фотоокисления сквалена, эстроген, простагландины, билирубин / биливердин и кинуреновая кислота [32], [57], [58]. Помимо метаболических ферментов, гены ряда факторов роста, цитокинов, хемокинов и их рецепторов являются мишенями для активированного AhR [45], [59]. AhR также функционально связан с рецептором EGF, предположительно, через путь, регулируемый ядерным фактором kappaB (NF-kB) [60], таким образом влияя на пролиферацию эпителиальных клеток. AhR также может опосредовано и напрямую взаимодействовать с белками, участвующими в основных редокс-регулируемых сигнальных путях, такими как NF-kB, различные протеинкиназы, (Src, JNK, p38, MAPK), а также с рецепторами эстрогена, опосредующими метаболизм эстрогена [61]. Недавние исследования раскрыли неожиданные физиологические роли и новые альтернативные лиганд-специфические пути для этого рецептора, которые позволили предположить многочисленные фармакологические роли лигандов AhR, полезных для разработки нового поколения фотозащитных лекарств и косметики [62], [63].
Метаболические реакции в коже человека при УФ-облучении
Продукты фотоокисления триптофана, в первую очередь формилиндоло [3,2 - b] карбазол, были идентифицированы как эндогенные лиганды AhR, и следовательно, медиаторы опосредованных CYP метаболических ответов кератиноцитов и меланоцитов на воздействие УФ-излучения [34]. Недавно показано, что сквален, основной компонент поверхностных липидов кожи человека, становится лигандом AhR и, как следствие, индуктором CYP1A1 и CYP1B1 после окисления в результате воздействия УФ-излучения [32]. Было также показано, что пероксид сквалена, являясь эндогенным активатора AhR-CYP, может вовлекаться в инициирование воспалительных реакций в коже, активируя в эпидермальных кератиноцитах сигнальные пути, регулирующие синтез и секрецию цитокинов IL- 6 и TNF-альфа [32].
Влияние вторичных метаболитов растений на метаболические реакции в коже человека при УФ- облучении
Ряд поступающих с пищей растительных полифенолов (ресвератрол, кверцетин, куркумин), а также эндогенные индолы, метаболиты триптофана, билирубин и окисленные продукты липидного метаболизма могут функционировать в качестве нетоксичных лигандов-активаторов или лигандов-ингибиторов экспрессии AhR, посредством конкурентных и неконкурентных механизмов [32], [56]. Среди растительных полифенолов, используемых для местного применения, были выявлены соединения, ингибирующие в кератиноцитах человека путь сигнальной трансдукции, включающий активацию AhR УФ-облучением или воздействием FICZ и заканчивающийся на генах CYP1A1-CYP1B1 [63], [64], [65]. Наиболее сильными ингибиторами оказались фенилпропаноид вербаскозид и флавоноид кверцетин [63], [64]. Подавляя УФ-стимулированную индукцию ферментов CYP1A1 и CYP1B1, эти соединения способны замедлить или даже предотвратить в кератиноцитах биотрансформацию проканцерогенов в основные канцерогены [65]. В тоже время, ряд других ВМР индуцировал увеличение экспрессии этих метаболических ферментов, что может увеличивать риск развития немеланомного рака кожи [66], [67]. В частности установлено, что широко известный растительный полифенол ресвератрол и его гликозид полидатин усиливают метаболические и воспалительные реакции кератиноцитов человека на UV(A+B) излучение или на экзогенный FICZ [68], что дает основание ограничить использование этого ВМР в косметических продуктах. Получены и другие данные, подтверждающие, что активация / ингибирование рецепторов AhR полифенолами растений коррелирует с последующим поведением CYP1 [69].
Иммунные ответы на УФ-облучение
Иммунная система кожи в наибольшей степени подвержена воздействию УФ-излучения и / или фотомодифицированных метаболитов, происходящих из поверхностных липидов кожи, поврежденных клеток кожи и внеклеточного матрикса. При этом в зависимости от дозы облучения его эффект может быть как положительным, так и крайне негативным. Благоприятное действие ультрафиолетовых лучей выражается в изменении иммунобиологической реактивности организма. Облучение стимулирует выработку антител, повышает фагоцитоз, тонизирует ретикулоэндотелиальную систему. Благодаря этому повышается сопротивляемость организма к инфекциям. В результате избыточного воздействия система, обеспечивающая адекватную защиту от чужеродных агентов, таких как молекулы с высокой молекулярной массой, пыль, бактериальные частицы, простейшие, грибы и вирусы, дает сбой, и иммунные ответы сильно изменяются: либо подавляются (иммунодефицит), либо неадекватно усиливаются (воспаление). Длительное воздействие солнечного излучения неизбежно приводит к иммунодефициту кожной иммунной системы, что обычно рассматривается как причина канцерогенеза, индуцированного ультрафиолетом [2], [4], [28], [65]. Иммунные ответы кожных клеток могут быть количественно оценены путем измерения экспрессии цитокинов, хемокинов и факторов роста, экспрессии рецепторов, чувствительных к УФ-свету, таких как мембраносвязанный рецептор EGF, Toll-подобные рецепторы, рецепторы G2A и внутриклеточные рецепторы, например, NF-kB и AhR [28], [34], [64], [69]. Большинство патологий кожи и ее старение связано с такого рода изменениями в локальной иммунной системе, что делает соответствующие структурно-функциональные элементы мишенями для поиска эффективных лекарств и светозащитной косметики.
Влияние вторичных метаболитов растений на иммунный ответ при воздействии УФ-облучения
Растущая в последние несколько десятилетий обеспокоенность общественности и медицинского сообщества проблемами, связанными с солнечным и искусственным УФ-облучением, обусловила существенную интенсификацию исследований, направленных на поиск фотозащитных веществ растительного происхождения [5], [6], [7], [65]. Экспериментальные данные показывают, что различные ВМР, в основном полифенолы, извлеченные из зеленого чая, виноградных косточек, соевых бобов или корня Curcumalonga, при пероральном или местном применении влияют на воспалительные ответы кожи (покраснение и солнечные ожоги). У этих соединений выявлен химиопрофилактический эффект, заключающийся в значительном уменьшении количества доброкачественных и злокачественных опухолей кожи, вызванных воздействием канцерогенных доз УФ-излучения [70], [71]. В клиническом исследовании изофлавон генистеин соевых бобов эффективно подавлял при предварительном нанесении на кожу эритему, вызванную УФВ-излучением [72]. В тоже время в экспериментах с культивируемыми клетками установлено, что растительные полифенолы кверцетин и ресвератрол, добавленные к нормальным кератиноцитам (НК) человека уже после воздействия УФИ полностью устраняли оверэкспрессию мРНК ферментов фазы I детоксикации Cyp1a1, Cyp1b1 и воспалительных цитокинов IL-1 beta и IL-6, атакже предотвращали повышение внутриклеточного уровня пероксидов [73]. Интересно, что гликозид кверцетина рутин, у которого антиоксидантные свойства выражены значительно слабее, чем у аглюкона, практически не влиял на уровень ЛПС-индуцированной экспрессии мРНК воспалительных цитокинов IL-6 иIL-1Bв НК человека и уровень секреции в культуральную среду соответствующих белков, тогда как комплекс рутин-Fe, обладающий в сравнении с рутином, более высокой антирадикальной и пероксидазной активностью, эффективно подавлял оверэкспрессию мРНК цитокинов IL-6 иIL-1B[74]. Результаты этих исследований указывают на существенное значение антиоксидантных свойств ВМР в реализации их противовоспалительного действия. По-видимому, ВМР проявляют свои химиопрофилактические свойства, снижая уровни небелковых провоспалительных медиаторов, таких как свободные радикалы, неорганические и органические пероксиды и альдегиды, образующиеся при УФ-облучении [8], [15]. Конечные продукты окисления кожного жира и липидов мембран кератиноцитов представляют собой ключевые биохимические медиаторы воспалительной реакции, вызванной УФ-облучением [3], [75], [76]. Среди таких молекул наиболее подробно охарактеризован 4-гидроксиноненал (4-HNE). Показано, что полифенолы зеленого чая и красного вина, эффективно реагируя с 4-HNE, защищают различные типы клеток invitro от индуцированного 4-HNE внутриклеточного окислительного стресса и существенно снижают его цитотоксичность [77]. Существенное ингибирование 4-HNE- индуцированной продукции митохондриальных АФК выявлено у кверцетина, эпигаллокатехин галлата, теафлавинов и их галлатов [78]. Убедительные данные, свидетельствующие о перспективности применения ВМР для защиты кожи от повреждений, вызванных фото-лучевой антипролиферативной терапией, получены со стандартизированными экстрактами зеленого чая, которые обладают как противовоспалительным, так и фотопротекторным действием [67]. Каротиноиды, включая бета-каротин, ликопин, лютеин, зеаксантин и астаксантин, в течение многих лет изучались в качестве средств защиты кожи от солнечного света [28]. Накапливаясь в коже при системном приеме, каротиноиды оказывают фотозащитное действие, поглощая фотоны, и функционируют как жертвенные антиоксиданты, перехватывая образующийся в результате фотохимических реакций синглетный кислород.
Заключение
Идея разработать полностью натуральные солнцезащитные космецевтики и средства по уходу за кожей одна из привлекательных, но и сложных задач в области профилактики здоровья населения. ВМР, синтезируемые растениями / морскими организмами в ответ на на негативное воздействие окружающей среды, в первую очередь, солнечное облучение, по-видимому, являются отличными кандидатами для предотвращения, замедления или даже восстановления повреждений кожи, вызываемых УФ-излучением. Хромофоры ВМР способны эффективно поглощать энергию солнечного света в диапазоне опасного для организма УФА и УФВ излучения. Среди ВМР выявлены соединения, обладающие высокой фотостабильностью, которые, функционируя как химические фотофильтры, не оказывают фототоксического действия в отношении клеток кожи и внеклеточного матрикса. Выраженные антирадикальные и хелатирующие свойства делают ВМР эффективными антиоксидантами, защищающими клетки от фотохимического повреждения, вызываемого солнечным излучением. При этом, сочетание у ВМР свойств нетоксичных химических УФ-фильтров и антиоксидантов при использовании их в составе фотозащитных кремов позволит не допустить критическое расходование эндогенных низкомолекулярных антиоксидантов, а способность влиять на активность метаболических ферментов фазы I и фазы II может активировать процессы детоксикации токсичных продуктов фотодеградации эндогенных субстратов и самих ВМР. Кроме того, структурное сходство у ряда ВМР и сигнальных молекул человека позволяет им взаимодействовать с множеством рецепторов на иммунных клетках кожи и воздействовать на пути сигнальной трансдукции, подавляя нежелательные воспалительные ответы, вызываемые избыточным УФ-облучением. Чтобы достичь всех перечисленных положительных эффектов при использовании ВМР в составе солнцезащитной косметики необходимы исследования, нацеленные на выявление как наиболее эффективных соединений, так и комбинаций потенциальных фотопротекторов с целью получения максимально эффективных безопасных композиций в конечном солнцезащитном косметическом продукте.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Gambichler T. Impact of UVA exposure on psychological parameters and circulating serotonin and melatonin / Gambichler, A. Bader, M. Vojvodic et al. // BMC Dermatol. – 2002. – Vol. 2. – P. 6.
- Kostyuk V.A. Modulation of human keratinocyte responses to solar UV by plant polyphenols as a basis for chemoprevention of non-melanoma skin cancers / V.A. Kostyuk, A.I. Potapovich, D. Lulli et al. // Curr. Med. Chem. – 2013. – Vol. 20. –P. 869–879.
- De Luca C. Surface lipids as multifunctional mediators of skin responses to environmental stimuli / C. De Luca, Valacchi // Mediat. Inflamm. – 2010. – Vol. 2010. – P. 321494.
- Scharffetter-Kochanek K. UV-induced reactive oxygen species in photocarcinogenesis and photoaging / K. Scharffetter-Kochanek, M. Wlaschek, P. Brenneisen et al. // Biol. Chem. – 1997.–Vol. 378. – P. 1247–1257.
- Pallela R. Anti-photoaging and photoprotective compounds derived from marine organisms / R. Pallela, Y. Young-Na, S.K. Kim et al. // Mar. Drugs. – 2010 – Vol.8. – P. 1189–1202.
- Saewan N. Natural products as photoprotection / Saewan, A. Jimtaisong // J. Cosmet. Dermatol. – 2015. – Vol. 14. – P. 47–63.
- Korkina L. Meristem plant cells as a sustainable source of redox actives for skin rejuvenation / L. Korkina, W. Mayer, De Luca // Biomolecules.–2017. – Vol. 7. – P. 40.
- Douglas C.J. Phenylpropanoid metabolism and lignin biosynthesis: From weeds to trees / C.J. Douglas // Trends Plant Sci. – 1996. – Vol. 1. –P. 171–178.
- Korkina L.G. Phenylpropanoids as naturally occurring antioxidants: From plant defence to human health / L.G. Korkina // Cell. Mol. Biol. – 2007. – Vol. 53. – P. 15–25.
- Ramakrishna A. Influence of abiotic stress signals on secondary metabolites in plants / A. Ramakrishna, A. Ravishankar // Plant Signal. Behav. – 2011. – Vol. 6. – P. 1720–1731.
- Zandalinas S.I. Plant adaptations to the combination of drought and high temperatures / S.I. Zandalinas, R. Mittler, Balfagón et al. // Physiol. Plant. – 2018. –Vol. 162. – P. 2– 12.
- Korkina L.G. Metabolism of plant polyphenols in the skin: Beneficial versus deleterious effects / L.G. Korkina, Pastore, C. De Luca et al. // Curr. Drug Metab. – 2008. – Vol. 9. – P. 710–729.
- Perez-Sancez A. Protective effects of citrus and rosemary extracts on UV-induced damage in skin cell model and human volunteers / A. Perez-Sancez, E. Barrajon-Catalan, N. Caturla et al. // J. Photochem. Photobiol. B. – 2014. – Vol. 136. – P. 12–18.
- Frohnmeyer H. Ultraviolet-B radiation-mediated responses in plants. Balancing damage and protection / H. Frohnmeyer, D. Staiger // Plant Physiol. – 2003. – Vol. 133. – P. 1420–1428.
- Hahlbrock K. Physiology and molecular biology of phenylpropanoid metabolism / K. Hahlbrock, D. Scheel // Ann. Rev. Plant Physiol. Plant Mol. Biol. –1989. – Vol. 4. – P. 347–369.
- Moyal D.D. Broad-spectrum sunscreens provide better protection from solar ultraviolet-stimulated radiation and natural sunlight-induced immunosuppression in human beings / D.D Moyal, A.M. Fourtanier // J. Am. Acad. Dermatol. – 2008. – 58. – P. S149–S154.
- Wolf R. Sunscreens / R. Wolf, D. Wolf, P. Morganti et al. // Clin. Dermatol. –2001. – Vol. 9. – P. 452–459.
- Commission recommendation of 22 September 2006 on the efficacy of sunscreen products and the claims made relating thereto // Off. J. Eur. Union. – 2006. – Vol. 265. – P. 39–43.
- Dembitsky V.M. Astonishing diversity of natural surfactants: 5. Biologically active glycosides of aromatic metabolites / V.M. Dembitsky // Lipids. – 2005. – Vol. 40. – P. 869–900.
- Ju K.Y. Clue to understanding the Janus behavior of eumelanin: Investigating the relationships between hierarchical assembly structure of eumelanin and its photo physical properties / K.Y. Ju, J. Kang, J.H. Chang et al. // – 2016. –Vol. 17. –P. 2860–2872.
- Bilkis I. Generation of reactive oxygen species by photosensitizers and their modes of action on proteins / I. Bilkis, Silman, L. Weiner // Curr. Med. Chem. – 2018. – Vol. 25. – P. 5528–5539.
- Korkina L. Metabolic and redox barriers in the skin exposed to drugs and xenobiotics / L. Korkina // Exp. Opin. Drug Metab. Toxicol. – 2016. – Vol. 12. – P.377–388.
- Kostyuk V. Natural substances for prevention of skin photoageing: Screening systems in the development of sunscreen and rejuvenation cosmetics / V. Kostyuk, A. Potapovich, A.R. Albuhaydar et al. // Rejuvenation Res. – 2018. – Vol. 21. – P. 91–101.
- Herrmann G. Photosensitisation of uroporphyrin augments the ultraviolet A-induced synthesis of matrix metalloproteinases in human dermal fibroblasts / G. Herrmann, M. Wlaschek, K. Bolsen et al. // J. Investig. Dermatol. – 1996. – Vol. 107. – P. 398–403.
- Wondrak G.T. Endogenous UVA-photosensitizers: Mediators of skin photodamage and novel targets for skin photoprotection / G.T. Wondrak, M.K. Jacobson, E.L. Jacobson et al. //. Photobiol. Sci. – 2006. – Vol. 5. – P. 215–237.
- Cadet J. Sensitised formation of oxidatively generated damage to cellular DNA by UVA radiation / J. Cadet, T. Douki, J.L.Ravanat et al. // Photochem. Sci. – 2009. – Vol. 8. – P. 903–911.
- Lamore S.D. The malondialdehyde-derived fluorophore DPH-lysine is a potential sensitizer of UVA-induced photooxidative stress in human skin cells /S.D. Lamore, S. Azimian, D. Horn et al. // J. Photochem. Photobiol. – 2010. – 101. – P. 251–264.
- Dickinson S.E. TLR4-directed molecular strategies targeting skin photodamage and carcinogenesis / S.E. Dickinson, G.T. Wondrak // Curr. Med. Chem. – 2018. – Vol. 25. – P. 5487–5502.
- De Luca C. Lipoperoxidase activity of Pityrosporum: Characterisation of by-products and possible role in Pityriasis versicolor / C. De Luca, M. Picardo, A. Breathnach et al. // Exp. Dermatol. – 1996. – Vol. 5. – P. 49–56.
- Ekanayake Mudiyanselage S. Ultraviolet A induces generation of squalene monohydroperoxide isomers in human sebum and skin surface lipids in vitro and in vivo / S. Ekanayake Mudiyanselage, M. Hamburger, P. Elsner et al. // J. Investig. Dermatol. – 2003. – Vol. 120. – P. 915–922.
- Picardo M. Sebaceous gland – A major player in skin homeostasis / M. Picardo, A. Mastrofrancesco, T. Biro // Exp. Dermatol. – 2015. – Vol. 24. – P.485–486.
- Kostyuk V. Photo-oxidation products of skin surface squalene mediate metabolic and inflammatory responses to solar UV in human keratinocytes / V. Kostyuk, A. Potapovich, A. Stancato et al. // PLoS ONE. – 2012. – Vol. 7. – P. e44472.
- Auffray B. Protection against singlet oxygen, the main actor of sebum squalene peroxidation during sun exposure, using Commiphora myrrha essential oil / B. Auffray // Int. J. Cosmet. Sci. – 2007. – Vol. 29. – P. 23–29.
- Rannug A. The aryl hydrocarbon receptor and light / A. Rannug, E. Fritsche // Biol. Chem. – 2006. – Vol. 387. – 1149–1157.
- Uchida K. Activation of stress signaling pathways by the end product of lipid peroxidation / K. Uchida, M. Shiraishi, Naito et al. // J. Biol. Chem. – 1999. – Vol. 274. – P. 2234–2242.
- Hattori T. G2A plays proinflammatory roles in human keratinocytes under oxidative stress as a receptor for 9-hydroxyoctadecadenoic acid / T. Hattori, H. Obinata, A. Ogawa et al. // J. Investig. Dermatol. – 2008. – Vol. 128. –P. 1123–1133.
- Hibbert S.A. A potential role for endogenous proteins as sacrificial sunscreens and antioxidants in human tissues / A. Hibbert, R.E.B. Watson,N.K. Gibbs et al. // Redox Biol. – 2015. – Vol.5. – P. 101–113.
- Kwon M.J. Superoxide dismutase 3 suppresses hyaluronic acid fragments mediated skin inflammation by inhibition of toll-like receptor 4 signaling pathway: Superoxide dismutase 3 inhibits reactive oxygen species-induced trafficking of toll-like receptor 4 to lipid rafts / M.J. Kwon, J. Han, B.H. Kim et al. // Antioxid. Redox Signal. –2012. – Vol. 16. – P. 297–313.
- Thiele J. Permeability and antioxidant barriers in aged skin / J. Thiele, C.O. Barland, R. Ghadially et al. // Skin Aging. – B. Gilchrest, J. Krutmann, Eds. – Springer: Berlin, Germany. – 2006. – P. 65–79.
- Packer L. Antioxidants and the response of skin to oxidative stress: Vitamin E as an indicator / L. Packer, G. Valacchi // Skin Pharmacol. Appl. Skin Physiol. – 2002. – Vol. 15. – P. 282–290.
- Slominski A.T. Cytochromes P450 and skin cancer: Role of local endocrine pathways / A.T. Slominski, M.A. Zmijewski, I. Semak et al. // Anticancer Agents Med. Chem. – 2014. – Vol. 14. – P. 77–96.
- Slominski A.T. Local melatoninergic system as the protector of skin integrity /A.T. Slominski, K. Kleszczynski, Semak et al. // Int. J. Mol. Sci. – 2014. – Vol. 15. – P. 17705–17732.
- Kim T.K. Metabolism of melatonin and biological activity of intermediates of melatoninergic pathway in human skin cells / T.K. Kim, K.Kleszczynski, Z. Janjetovic et al. // FASEB J. – 2013. – Vol. 27. – P. 2742–2755.
- Lee J.S. Nrf2 as a novel molecular target for chemoprevention / J.S. Lee, Y.J. Surh // Cancer Lett. – 2005. – Vol. 224. – P. 171–184.
- Ma Q. Role of Nrf2 in oxidative stress and toxicity / Q. Ma // Annu. Rev. Pharmacol. Toxicol. – 2013. – Vol. 53. – 401–426.
- Schafer M. Nrf2-A regulator of keratinocyte redox signaling / M. Schafer, S. Werner // Free Radic. Biol. Med. – 2015. – Vol. 88 – P. 243–252.
- Rojo de la Vega M. Targeting NRF2 for improved skin barrier function and photoprotection: Focus on the achiote-derived apocarotenoid bixin / M. Rojo de la Vega, A.Krajisnik, D.D. Zhang et al. // Nutrients. – 2017. – Vol. 9. – P. 1371.
- Hirota A. Acceleration of UVB-induced photoageing in nrf2 gene-deficient mice / A. Hirota, Y. Kawachi, M. Yamamoto et al. // Exp. – 2011. – Vol. 20. – P. 664–668.
- Bosch R. Mechanisms of Photoaging and Cutaneous Photocarcinogenesis, and Photoprotective Strategies with Phytochemicals / R. Bosch, N. Philips, J.A. Suarez-Perez et al. // Antioxidants. – 2015. – Vol. 4. – P. 248–268.
- Oesch F. Xenobiotic-metabolizing enzymes in the skin of rat, mouse, pig, guinea, and in human skin models / F. Oesch, E. Fabian, K. Guth et al. // Arch. – 2014. – Vol. 88. – P. 2135–2190.
- Katiyar S.K. Ultraviolet-B exposure of human skin induces cytochromes P450 1A1 and 1B1 51 / S.K. Katiyar, S. Matsui, H. Mukhtar // J. Investig. Dermatol. – 2000. – Vol. 114. – P. 328–333.
- Pavek P. Xenobiotic-induced transcriptional regulation of xenobiotic metabolizing enzymes of the cytochrome P450 superfamily in human extrahepatic tissues / P. Pavek, Z. Dvorak // Curr. Drug Metab. –2008. – Vol. 9. – P. 129–143.
- Baron J.M. Expression of multiple cytochrome P450 enzymes and multidrug resistance-associated transport proteins in human skin keratinocytes / J.M. Baron, D. Holler, R. Schiffer et al. // J. Investig. –2001. – Vol. 116. – P. 541–548.
- Gundert-Remy U. Extrahepatic metabolism at the body’s internal-external interfaces / U. Gundert-Remy, U. Bernauer, B. Blomeke et al. // Drug Metab. – 2014. – Vol. 46. – P. 291–324.
- Chiaro C.R. 12(R)-hydroxy-5(Z),8(Z),10(E),14(Z)-eicosatetraenoic acid [12(R)-HETE], an arachidonic acid derivative, is an activator of the aryl hydrocarbon receptor / C.R. Chiaro, R.D. Patel, G.H. Perdew // Mol. – 2008. – Vol. 74. – P. 1649–1656.
- Nguyen L.P. The search for endogenous activators of aryl hydrocarbon receptor / L.P. Nguyen, C.A.Bradfield // Chem. Res. – 2008. – Vol. 21 – P. 102–116.
- Stejskalova L. Endogenous and exogenous ligands of aryl hydrocarbon receptor: Current state of art / L. Stejskalova, Dvorak, P. Pavek // Curr. Drug Metab. – 2011. – Vol. 12. – P. 198–212.
- Kalthoff S. Interaction between oxidative stress sensor Nrf2 and xenobiotic-activated aryl hydrocarbon receptor in the regulation of the human phase II detoxifying UDP-glucuronosyltransferase 1A10 / S.Kalthoff, U. Ehmer, N. Freiberg et al. // Biol. Chem. – 2010. – Vol. 285. – P. 5993–6002.
- Swanson H.I. Cytochrome P450 expression in human keratinocytes: An aryl hydrocarbon receptor perspective / I.Swanson // Chem. Biol. Interact. – 2004. – Vol. 149. – P. 69–79.
- Puga A. The aryl hydrocarbon receptor cross-talks with multiple signal transduction pathways / A. Puga, C. Ma, L.Marlowe // Biochem. Pharmacol. – 1999. – Vol. 77. – P. 13–22.
- Ohtake F. Modulation of estrogen receptor signaling by association with the activated dioxin receptor / F. Ohtake, Takeyama, T. Matsumoto et al. // Nature. – 2003. – Vol. 423. – P. 545–550.
- The AhR twist: Ligand-dependent AhR signaling and pharmaco-toxicological implications / E. Guyot, A. Chevallier, R. Barouki et al. // Drug Discov. Today. – 2013. – Vol. 18. – P. 479–486.
- Busbee P.B. Use of natural AhR ligands as potential therapeutic modalities against inflammatory disorders / P.B. Busbee, M. Busbee, M. Rouse et al. // Nutr. – 2013. –Vol. 71. – P. 353–369.
- Pastore S. Differential modulation of stress-inflammation responses by plant polyphenols in cultured normal human keratinocytes and immortalized HaCaT cells / S. Pastore, D. Lulli, A.I. Potapovich et al. // J. Dermatol. Sci. – 2011. – Vol. 63. – P. 104–114.
- Katiyar S.K. UV-induced immune suppression and photocarcinogenesis: Chemoprevention by dietary botanical agents / S.K. Katiyar // Cancer Lett. –2007. – Vol. 255. – P. 1–11.
- Katiyar S.K. Green tea polyphenol (−)-epigallocatechin-3-gallate treatment of human skin inhibits ultraviolet radiation-induced oxidative stress / S.K. Katiyar, F. Afaq, A. Peres et al. // Carcinogenesis. –2001 – Vol. 22. –P. 287–294.
- Afaq F. Inhibition of ultraviolet B-mediated activation of nuclear factor κB in normal human epidermal keratinocytes by green tea constituent (−)-epigallocatechin-3-gallate / F. Afaq, V.M. Adhami, N. Ahmad et al. // Oncogene. –2003. – Vol. 22. – P. 1035–1044.
- Pastore S. Resveratrol enhances solar UV induced responses in normal human epidermal keratinocytes / S. Pastore, Lulli, A. Pascarella et al. // Photochem. Photobiol. –2012. – Vol. 88. – P. 1522–1530.
- Potapovich A.I. Plant polyphenols differentially modulate inflammatory responses of human keratinocytes by interfering with activation of transcriptional factors NFκB and AhR and EGFR-ERK pathways independently of their direct redox properties / A.I. Potapovich, D. Lulli, P. Fidanza et al. // Toxicol. Appl. Pharmacol. – 2011. – Vol. 255. –P. 138–149.
- Wright T.I. Chemoprevention of nonmelanoma skin cancer / T.I. Wright, J.M. Spencer, F.P.Flowers // J. Am. Acad. Dermatol. –2006. –Vol. 54. –P. 933–946.
- Wang Z.Y. Inhibitory effect of green tea in the drinking water on tumorigenesis by ultraviolet light and 12-O-tetradecanoylphorbol-13-acetate in the skin of SKH-1 mice / Z.Y. Wang, M.T. Huang, T. Ferraro et al. // Cancer Res. –1992. –Vol. 52. –P. 1162–1170.
- Wei H. Isoflavone genistein: Photoprotection and clinical implications in dermatology / H. Wei, R. Saladi, Y. Lu et al. // J. Nutr. – 2003. – Vol. 133. – P. 3811S–3819S.
- Potapovich A.I. Effects of pre- and post-treatment with plant polyphenols on human keratinocyte responses to solar UV / A.I. Potapovich, V.A. Kostyuk, T.V. Kostyuk et al. // Inflamm. Res. –2013. –Vol. 62. –P. 773–780.
- Потапович А.И. Исследование антиоксидантной и противовоспалительной активности комплекса рутина с двухвалентным железом / А.И.Потапович, Т.О. Сухан, О.А. Антипова и др. // Журнал Белорусского государственного университета. Биология. – – № 1. – С. 3–12.
- Picardo M. Role of skin surface lipids in UV-induced epidermal cell changes / M. Picardo, C. Zompetta, C. De Luca et al. // Arch. Dermatol. Res. –1991. –Vol. 283. –P. 191–197.
- Uchino T. Effect of squalene monohydroperoxide on cytotoxicity and cytokine release in a three-dimensional human skin model and human epidermal keratinocytes / T. Uchino, H. Tokunaga, H. Onodera et al. // Biol. Pharm. Bull. –2002. – 25. –P. 605–610.
- Zhu Q. Natural polyphenols as direct trapping agents of lipid peroxidation-derived acrolein and 4-hydroxy-trans-2-nonenal / Q. Zhu, Z.P. Zheng, K.W. Cheng et al. // Chem. Res. Toxicol. – 2009. – Vol. 22. –P. 1721–1727.
- Feng Q. Anticarcinogenic antioxidants as inhibitors against intracellular oxidative stress / Q. Feng, T. Kumagai, Y. Torii et al. // Free Radic. Res. – 2001. –Vol. 35. –P. 779–788.
Список литературы на английском языке / References in English
- Gambichler T. Impact of UVA exposure on psychological parameters and circulating serotonin and melatonin / Gambichler, A. Bader, M. Vojvodic et al. // BMC Dermatol. – 2002. – Vol. 2. – P. 6.
- Kostyuk V.A. Modulation of human keratinocyte responses to solar UV by plant polyphenols as a basis for chemoprevention of non-melanoma skin cancers / V.A. Kostyuk, A.I. Potapovich, D. Lulli et al. // Curr. Med. Chem. – 2013. – Vol. 20. –P. 869–879.
- De Luca C. Surface lipids as multifunctional mediators of skin responses to environmental stimuli / C. De Luca, Valacchi // Mediat. Inflamm. – 2010. – Vol. 2010. – P. 321494.
- Scharffetter-Kochanek K. UV-induced reactive oxygen species in photocarcinogenesis and photoaging / K. Scharffetter-Kochanek, M. Wlaschek, P. Brenneisen et al. // Biol. Chem. – 1997.–Vol. 378. – P. 1247–1257.
- Pallela R. Anti-photoaging and photoprotective compounds derived from marine organisms / R. Pallela, Y. Young-Na, S.K. Kim et al. // Mar. Drugs. – 2010 – Vol.8. – P. 1189–1202.
- Saewan N. Natural products as photoprotection / Saewan, A. Jimtaisong // J. Cosmet. Dermatol. – 2015. – Vol. 14. – P. 47–63.
- Korkina L. Meristem plant cells as a sustainable source of redox actives for skin rejuvenation / L. Korkina, W. Mayer, De Luca // Biomolecules.–2017. – Vol. 7. – P. 40.
- Douglas C.J. Phenylpropanoid metabolism and lignin biosynthesis: From weeds to trees / C.J. Douglas // Trends Plant Sci. – 1996. – Vol. 1. –P. 171–178.
- Korkina L.G. Phenylpropanoids as naturally occurring antioxidants: From plant defence to human health / L.G. Korkina // Cell. Mol. Biol. – 2007. – Vol. 53. – P. 15–25.
- Ramakrishna A. Influence of abiotic stress signals on secondary metabolites in plants / A. Ramakrishna, A. Ravishankar // Plant Signal. Behav. – 2011. – Vol. 6. – P. 1720–1731.
- Zandalinas S.I. Plant adaptations to the combination of drought and high temperatures / S.I. Zandalinas, R. Mittler, Balfagón et al. // Physiol. Plant. – 2018. –Vol. 162. – P. 2– 12.
- Korkina L.G. Metabolism of plant polyphenols in the skin: Beneficial versus deleterious effects / L.G. Korkina, Pastore, C. De Luca et al. // Curr. Drug Metab. – 2008. – Vol. 9. – P. 710–729.
- Perez-Sancez A. Protective effects of citrus and rosemary extracts on UV-induced damage in skin cell model and human volunteers / A. Perez-Sancez, E. Barrajon-Catalan, N. Caturla et al. // J. Photochem. Photobiol. B. – 2014. – Vol. 136. – P. 12–18.
- Frohnmeyer H. Ultraviolet-B radiation-mediated responses in plants. Balancing damage and protection / H. Frohnmeyer, D. Staiger // Plant Physiol. – 2003. – Vol. 133. – P. 1420–1428.
- Hahlbrock K. Physiology and molecular biology of phenylpropanoid metabolism / K. Hahlbrock, D. Scheel // Ann. Rev. Plant Physiol. Plant Mol. Biol. –1989. – Vol. 4. – P. 347–369.
- Moyal D.D. Broad-spectrum sunscreens provide better protection from solar ultraviolet-stimulated radiation and natural sunlight-induced immunosuppression in human beings / D.D Moyal, A.M. Fourtanier // J. Am. Acad. Dermatol. – 2008. – 58. – P. S149–S154.
- Wolf R. Sunscreens / R. Wolf, D. Wolf, P. Morganti et al. // Clin. Dermatol. –2001. – Vol. 9. – P. 452–459.
- Commission recommendation of 22 September 2006 on the efficacy of sunscreen products and the claims made relating thereto // Off. J. Eur. Union. – 2006. – Vol. 265. – P. 39–43.
- Dembitsky V.M. Astonishing diversity of natural surfactants: 5. Biologically active glycosides of aromatic metabolites / V.M. Dembitsky // Lipids. – 2005. – Vol. 40. – P. 869–900.
- Ju K.Y. Clue to understanding the Janus behavior of eumelanin: Investigating the relationships between hierarchical assembly structure of eumelanin and its photo physical properties / K.Y. Ju, J. Kang, J.H. Chang et al. // Biomacromolecules. – 2016. –Vol. 17. –P. 2860–2872.
- Bilkis I. Generation of reactive oxygen species by photosensitizers and their modes of action on proteins / I. Bilkis, Silman, L. Weiner // Curr. Med. Chem. – 2018. – Vol. 25. – P. 5528–5539.
- Korkina L. Metabolic and redox barriers in the skin exposed to drugs and xenobiotics / L. Korkina // Exp. Opin. Drug Metab. Toxicol. – 2016. – Vol. 12. – P.377–388.
- Kostyuk V. Natural substances for prevention of skin photoageing: Screening systems in the development of sunscreen and rejuvenation cosmetics / V. Kostyuk, A. Potapovich, A.R. Albuhaydar et al. // Rejuvenation Res. – 2018. – Vol. 21. – P. 91–101.
- Herrmann G. Photosensitisation of uroporphyrin augments the ultraviolet A-induced synthesis of matrix metalloproteinases in human dermal fibroblasts / G. Herrmann, M. Wlaschek, K. Bolsen et al. // J. Investig. Dermatol. – 1996. – Vol. 107. – P. 398–403.
- Wondrak G.T. Endogenous UVA-photosensitizers: Mediators of skin photodamage and novel targets for skin photoprotection / G.T. Wondrak, M.K. Jacobson, E.L. Jacobson et al. //. Photobiol. Sci. – 2006. – Vol. 5. – P. 215–237.
- Cadet J. Sensitised formation of oxidatively generated damage to cellular DNA by UVA radiation / J. Cadet, T. Douki, J.L.Ravanat et al. // Photochem. Sci. – 2009. – Vol. 8. – P. 903–911.
- Lamore S.D. The malondialdehyde-derived fluorophore DPH-lysine is a potential sensitizer of UVA-induced photooxidative stress in human skin cells /S.D. Lamore, S. Azimian, D. Horn et al. // J. Photochem. Photobiol. – 2010. – 101. – P. 251–264.
- Dickinson S.E. TLR4-directed molecular strategies targeting skin photodamage and carcinogenesis / S.E. Dickinson, G.T. Wondrak // Curr. Med. Chem. – 2018. – Vol. 25. – P. 5487–5502.
- De Luca C. Lipoperoxidase activity of Pityrosporum: Characterisation of by-products and possible role in Pityriasis versicolor / C. De Luca, M. Picardo, A. Breathnach et al. // Exp. Dermatol. – 1996. – Vol. 5. – P. 49–56.
- Ekanayake Mudiyanselage S. Ultraviolet A induces generation of squalene monohydroperoxide isomers in human sebum and skin surface lipids in vitro and in vivo / S. Ekanayake Mudiyanselage, M. Hamburger, P. Elsner et al. // J. Investig. Dermatol. – 2003. – Vol. 120. – P. 915–922.
- Picardo M. Sebaceous gland – A major player in skin homeostasis / M. Picardo, A. Mastrofrancesco, T. Biro // Exp. Dermatol. – 2015. – Vol. 24. – P.485–486.
- Kostyuk V. Photo-oxidation products of skin surface squalene mediate metabolic and inflammatory responses to solar UV in human keratinocytes / V. Kostyuk, A. Potapovich, A. Stancato et al. // PLoS ONE. – 2012. – Vol. 7. – P. e44472.
- Auffray B. Protection against singlet oxygen, the main actor of sebum squalene peroxidation during sun exposure, using Commiphora myrrha essential oil / B. Auffray // Int. J. Cosmet. Sci. – 2007. – Vol. 29. – P. 23–29.
- Rannug A. The aryl hydrocarbon receptor and light / A. Rannug, E. Fritsche // Biol. Chem. – 2006. – Vol. 387. – 1149–1157.
- Uchida K. Activation of stress signaling pathways by the end product of lipid peroxidation / K. Uchida, M. Shiraishi, Naito et al. // J. Biol. Chem. – 1999. – Vol. 274. – P. 2234–2242.
- Hattori T. G2A plays proinflammatory roles in human keratinocytes under oxidative stress as a receptor for 9-hydroxyoctadecadenoic acid / T. Hattori, H. Obinata, A. Ogawa et al. // J. Investig. Dermatol. – 2008. – Vol. 128. –P. 1123–1133.
- Hibbert S.A. A potential role for endogenous proteins as sacrificial sunscreens and antioxidants in human tissues / A. Hibbert, R.E.B. Watson,N.K. Gibbs et al. // Redox Biol. – 2015. – Vol.5. – P. 101–113.
- Kwon M.J. Superoxide dismutase 3 suppresses hyaluronic acid fragments mediated skin inflammation by inhibition of toll-like receptor 4 signaling pathway: Superoxide dismutase 3 inhibits reactive oxygen species-induced trafficking of toll-like receptor 4 to lipid rafts / M.J. Kwon, J. Han, B.H. Kim et al. // Antioxid. Redox Signal. –2012. – Vol. 16. – P. 297–313.
- Thiele J. Permeability and antioxidant barriers in aged skin / J. Thiele, C.O. Barland, R. Ghadially et al. // Skin Aging. – B. Gilchrest, J. Krutmann, Eds. – Springer: Berlin, Germany. – 2006. – P. 65–79.
- Packer L. Antioxidants and the response of skin to oxidative stress: Vitamin E as an indicator / L. Packer, G. Valacchi // Skin Pharmacol. Appl. Skin Physiol. – 2002. – Vol. 15. – P. 282–290.
- Slominski A.T. Cytochromes P450 and skin cancer: Role of local endocrine pathways / A.T. Slominski, M.A. Zmijewski, I. Semak et al. // Anticancer Agents Med. Chem. – 2014. – Vol. 14. – P. 77–96.
- Slominski A.T. Local melatoninergic system as the protector of skin integrity /A.T. Slominski, K. Kleszczynski, Semak et al. // Int. J. Mol. Sci. – 2014. – Vol. 15. – P. 17705–17732.
- Kim T.K. Metabolism of melatonin and biological activity of intermediates of melatoninergic pathway in human skin cells / T.K. Kim, K.Kleszczynski, Z. Janjetovic et al. // FASEB J. – 2013. – Vol. 27. – P. 2742–2755.
- Lee J.S. Nrf2 as a novel molecular target for chemoprevention / J.S. Lee, Y.J. Surh // Cancer Lett. – 2005. – Vol. 224. – P. 171–184.
- Ma Q. Role of Nrf2 in oxidative stress and toxicity / Q. Ma // Annu. Rev. Pharmacol. Toxicol. – 2013. – Vol. 53. – 401–426.
- Schafer M. Nrf2-A regulator of keratinocyte redox signaling / M. Schafer, S. Werner // Free Radic. Biol. Med. –2015. – Vol. 88 – P. 243–252.
- Rojo de la Vega M. Targeting NRF2 for improved skin barrier function and photoprotection: Focus on the achiote-derived apocarotenoid bixin / M. Rojo de la Vega, A.Krajisnik, D.D. Zhang et al. // Nutrients. – 2017. –Vol. 9. – P. 1371.
- Hirota A. Acceleration of UVB-induced photoageing in nrf2 gene-deficient mice / A. Hirota, Y. Kawachi, M. Yamamoto et al. // Exp. – 2011. – Vol. 20. – P. 664–668.
- Bosch R. Mechanisms of Photoaging and Cutaneous Photocarcinogenesis, and Photoprotective Strategies with Phytochemicals / R. Bosch, N. Philips, J.A. Suarez-Perez et al. // Antioxidants. – 2015. – Vol. 4. – P. 248–268.
- Oesch F. Xenobiotic-metabolizing enzymes in the skin of rat, mouse, pig, guinea, and in human skin models /F. Oesch, E. Fabian, K. Guth et al. // Arch. – 2014. – Vol. 88. – P. 2135–2190.
- Katiyar S.K. Ultraviolet-B exposure of human skin induces cytochromes P450 1A1 and 1B1 51. / S.K. Katiyar, S. Matsui, H. Mukhtar // J. Investig. Dermatol. – 2000. – Vol. 114. – P. 328–333.
- Pavek P. Xenobiotic-induced transcriptional regulation of xenobiotic metabolizing enzymes of the cytochrome P450 superfamily in human extrahepatic tissues / P. Pavek, Z. Dvorak // Curr. Drug Metab. –2008. – Vol. 9. – P. 129–143.
- Baron J.M. Expression of multiple cytochrome P450 enzymes and multidrug resistance-associated transport proteins in human skin keratinocytes / J.M. Baron, D. Holler, R. Schiffer et al. // J. Investig. –2001. – Vol. 116. – P. 541–548.
- Gundert-Remy U. Extrahepatic metabolism at the body’s internal-external interfaces / U. Gundert-Remy, U. Bernauer, B. Blomeke et al. // Drug Metab. – 2014. – Vol. 46. – P. 291–324.
- Chiaro C.R. 12(R)-hydroxy-5(Z),8(Z),10(E),14(Z)-eicosatetraenoic acid [12(R)-HETE], an arachidonic acid derivative, is an activator of the aryl hydrocarbon receptor / C.R. Chiaro, R.D. Patel, G.H. Perdew // Mol. – 2008. – Vol. 74. – P. 1649–1656.
- Nguyen L.P. The search for endogenous activators of aryl hydrocarbon receptor / L.P. Nguyen, C.A.Bradfield // Chem. Res. – 2008. – Vol. 21 – P. 102–116.
- Stejskalova L. Endogenous and exogenous ligands of aryl hydrocarbon receptor: Current state of art / L. Stejskalova, Dvorak, P. Pavek // Curr. Drug Metab. – 2011. – Vol. 12. – P. 198–212.
- Kalthoff S. Interaction between oxidative stress sensor Nrf2 and xenobiotic-activated aryl hydrocarbon receptor in the regulation of the human phase II detoxifying UDP-glucuronosyltransferase 1A10 / S.Kalthoff, U. Ehmer, N. Freiberg et al. // Biol. Chem. – 2010. – Vol. 285. – P. 5993–6002.
- Swanson H.I. Cytochrome P450 expression in human keratinocytes: An aryl hydrocarbon receptor perspective / I.Swanson // Chem. Biol. Interact. – 2004. – Vol. 149. – P. 69–79.
- Puga A. The aryl hydrocarbon receptor cross-talks with multiple signal transduction pathways / A. Puga, C. Ma, L.Marlowe // Biochem. Pharmacol. – 1999. – Vol. 77. – P. 13–22.
- Ohtake F. Modulation of estrogen receptor signaling by association with the activated dioxin receptor / F. Ohtake, Takeyama, T. Matsumoto et al. // Nature. – 2003. – Vol. 423. – P. 545–550.
- The AhR twist: Ligand-dependent AhR signaling and pharmaco-toxicological implications / E. Guyot, A. Chevallier, R. Barouki et al. // Drug Discov. Today. – 2013. – Vol. 18. – P. 479–486.
- Busbee P.B. Use of natural AhR ligands as potential therapeutic modalities against inflammatory disorders / P.B. Busbee, M. Busbee, M. Rouse et al. // Nutr. – 2013. –Vol. 71. – P. 353–369.
- Pastore S. Differential modulation of stress-inflammation responses by plant polyphenols in cultured normal human keratinocytes and immortalized HaCaT cells / S. Pastore, D. Lulli, A.I. Potapovich et al. // J. Dermatol. Sci. – 2011. – Vol. 63. – P. 104–114.
- Katiyar S.K. UV-induced immune suppression and photocarcinogenesis: Chemoprevention by dietary botanical agents / S.K. Katiyar // Cancer Lett. –2007. – Vol. 255. – P. 1–11.
- Katiyar S.K. Green tea polyphenol (−)-epigallocatechin-3-gallate treatment of human skin inhibits ultraviolet radiation-induced oxidative stress / S.K. Katiyar, F. Afaq, A. Peres et al. // Carcinogenesis. –2001 – Vol. 22. – P. 287–294.
- Afaq F. Inhibition of ultraviolet B-mediated activation of nuclear factor κB in normal human epidermal keratinocytes by green tea constituent (−)-epigallocatechin-3-gallate / F. Afaq, V.M. Adhami, N. Ahmad et al. // Oncogene. –2003. – Vol. 22. – P. 1035–1044.
- Pastore S. Resveratrol enhances solar UV induced responses in normal human epidermal keratinocytes / S. Pastore, Lulli, A. Pascarella et al. // Photochem. Photobiol. –2012. – Vol. 88. – P. 1522–1530.
- Potapovich A.I. Plant polyphenols differentially modulate inflammatory responses of human keratinocytes by interfering with activation of transcriptional factors NFκB and AhR and EGFR-ERK pathways independently of their direct redox properties / A.I. Potapovich, D. Lulli, P. Fidanza et al. // Toxicol. Appl. Pharmacol. – 2011. – Vol. 255. –P. 138–149.
- Wright T.I. Chemoprevention of nonmelanoma skin cancer / T.I. Wright, J.M. Spencer, F.P.Flowers // J. Am. Acad. Dermatol. –2006. –Vol. 54. –P. 933–946.
- Wang Z.Y. Inhibitory effect of green tea in the drinking water on tumorigenesis by ultraviolet light and 12-O-tetradecanoylphorbol-13-acetate in the skin of SKH-1 mice / Z.Y. Wang, M.T. Huang, T. Ferraro et al. // Cancer Res. –1992. –Vol. 52. –P. 1162–1170.
- Wei H. Isoflavone genistein: Photoprotection and clinical implications in dermatology / H. Wei, R. Saladi, Y. Lu et al. // J. Nutr. – 2003. – Vol. 133. – P. 3811S–3819S.
- Potapovich A.I. Effects of pre- and post-treatment with plant polyphenols on human keratinocyte responses to solar UV / A.I. Potapovich, V.A. Kostyuk, T.V. Kostyuk et al. // Inflamm. Res. –2013. –Vol. 62. –P. 773–780.
- Potapovich A.I. Issledovanie antioksidantnoj i protivovospalitel'noj aktivnosti kompleksa rutina s dvuhvalentnym zhelezom [Research of antioxidant and anti-inflammatory activity of rutine complex with bivalent iron] / I. Potapovich, T.O. Suhan, O.A. Antipova et al. // Journal of the Belarusian State University. Biology. – 2019. – № 1. – P. 3–12. [in Russian].
- Picardo M. Role of skin surface lipids in UV-induced epidermal cell changes / M. Picardo, C. Zompetta, C. De Luca et al. // Arch. Dermatol. Res. –1991. –Vol. 283. –P. 191–197.
- Uchino T. Effect of squalene monohydroperoxide on cytotoxicity and cytokine release in a three-dimensional human skin model and human epidermal keratinocytes / T. Uchino, H. Tokunaga, H. Onodera et al. // Biol. Pharm. Bull. –2002. – 25. –P. 605–610.
- Zhu Q. Natural polyphenols as direct trapping agents of lipid peroxidation-derived acrolein and 4-hydroxy-trans-2-nonenal / Q. Zhu, Z.P. Zheng, K.W. Cheng et al. // Chem. Res. Toxicol. – 2009. – Vol. 22. –P. 1721–1727.
- Feng Q. Anticarcinogenic antioxidants as inhibitors against intracellular oxidative stress / Q. Feng, T. Kumagai, Y. Torii et al. // Free Radic. Res. – 2001. –Vol. 35. –P. 779–788.