Изучение случаев неспецифической серопозитивности в реакции иммуноферментного анализа при обследовании не вакцинированного против ящура крупного рогатого скота
Изучение случаев неспецифической серопозитивности в реакции иммуноферментного анализа при обследовании не вакцинированного против ящура крупного рогатого скота
Аннотация
Целью проведения данных исследований было проанализировать случаи и возможные причины проявления неспецифической активности в реакции иммуноферментного анализа (ИФА) обнаружения антител к вирусу ящура в образцах сыворотки крови крупного рогатого скота (КРС), не вакцинированного против ящура, и подтвердить необходимость уточнения статуса серопозитивных особей.
Сыворотку крови КРС в количестве 4573 образцов исследовали на наличие антител к вирусу ящура методом ИФА с использованием коммерческих наборов. При проведении 26089 иммуноферментных тестов разных форматов были выявлены случаи получения положительных результатов, не подтвердившихся в других серологических реакциях на наличие антител к структурным и неструктурным белкам вируса ящура. При обследовании в тест-системах ARRIAH (производитель ФГБУ «ВНИИЗЖ») разных групп невакцинированного КРС доля ложноположительных результатов составила 2,14%, что было близко к допустимым значениям, установленным ранее в рамках диагностической специфичности при валидации тест-систем ARRIAH для серотипов А, О, Asia 1: 1,0%, 1,5%, 2,4%, соответственно (среднее значение — 1,63%). В ходе параллельного исследования в тест-системах ARRIAH и IZSLER (производитель IZSLER, Италия) 810 образцов сыворотки крови от невакцинированного КРС все оказавшиеся ложноположительными пробы были отобраны от особей женского пола преимущественно репродуктивного возраста. Число совпадений результатов тестов ARRIAH и IZSLER по качественным характеристикам для подозрительных животных составило 29–36%. При этом согласование между результатами двух тестов по всей выборке образцов (n=810) равнялось 92,3%.
Положительный результат на ящур в реакции иммуноферментного анализа, полученный при обследовании невакцинированного поголовья, должен быть подтверждён в других серологических реакциях. При комплексном подходе, когда положительные сыворотки, отобранные при скрининге образцов методом ИФА, подтверждаются в реакции нейтрализации вируса ящура, вероятность получения ложноположительных результатов сводится к минимуму.
1. Введение
Ящур — особо опасная, высоко контагиозная вирусная болезнь парнокопытных животных. Восприимчивы к ящуру крупный рогатый скот (КРС), свиньи, овцы, козы, олени, антилопы, буйволы, верблюды. Источником возбудителя инфекции являются инфицированные, больные животные, а также животные — реконвалесценты, способные быть вирусоносителями на протяжении длительного времени. Ящуром болеют животные разного возраста, но наиболее уязвим молодняк в возрасте до 2–3 месяцев. Данная инфекция с характерной симптоматикой, известная с давних времён, остаётся актуальной и по сей день, поскольку способна наносить колоссальный экономический ущерб, складывающийся из потерь в результате падежа молодняка (телят, поросят, ягнят), снижения на 50–75% молочной продуктивности коров, уменьшения живого веса больных животных и абортов. Особенно большие затраты связаны с проведением карантинных мероприятий
, .Профилактическая вакцинация в регионах, граничащих с неблагополучными по ящуру территориями, регулярные мониторинговые обследования поголовья сельскохозяйственных животных, как в крупных агрохолдингах, так и в фермерских/личных подсобных хозяйствах, позволяют осуществлять строгий надзор за болезнью в соответствии с регионализацией, предусматривающей подтверждение статусов, признанных Всемирной организацией здравоохранения (ВОЗЖ): зона, свободная от ящура без вакцинации, и зона, свободная от ящура с вакцинацией.
Для достижения целей мониторинговых исследований целесообразно использовать разные тесты и учитывать различные подходы при интерпретации результатов тестирования, дифференцированный подход при обследовании вакцинированных и не вакцинированных против ящура животных, а также животных с неизвестным статусом
.В настоящее время для ретроспективной диагностики ящура используют два вида серологических тестов: для обнаружения антител к структурным белкам вируса (SP) и для обнаружения антител к неструктурным белкам вируса (NSP). Первый вид тест-систем (SP тесты) являются серотипоспецифическими и определяют антитела, индуцированные при вакцинации или инфекции. К ним относятся реакция нейтрализации вируса ящура (РН ВЯ) и иммуноферментный анализ (ИФА): твердофазный конкурентный ИФА и жидкофазный блокирующий ИФА
, , , . На диагностическую чувствительность данных тестов может влиять соответствие (антигенное родство) вируса или антигена, использованных в реакции, с вакцинным штаммом или со штаммом, циркулирующим в полевых условиях . Однако использование тест-систем данного вида не позволяет дифференцировать поствакцинальные специфические антитела от постинфекционных, поскольку при формировании иммунного ответа посредством вакцинации или инфицирования, и в том, и в другом случае, вырабатываются антитела к структурным белкам вируса ящура . Для выявления переболевших животных независимо от их первоначального статуса (вакцинированные/ невакцинированные) индивидуальные образцы сыворотки крови исследуют в ИФА на наличие антител к неструктурным белкам вируса ящура. Неструктурные белки синтезируются в процессе репликации вируса ящура, но не входят в состав капсида. При производстве противоящурной вакцины инактивированное сырьё подвергается очистке от клеточного детрита и неструктурных белков. Что и позволяет идентифицировать впоследствии переболевших животных.Небольшое количество исследуемых образцов сыворотки крови в реакции ИФА разного формата может давать ложноположительный ответ вследствие неспецифических реакций. При комплексном подходе, когда положительные сыворотки, отобранные при скрининге образцов в ИФА, подтверждаются в РН, вероятность получения ложноположительных результатов сводится к минимуму
.Особенно остро вопрос подтверждения положительных результатов на ящур стоит при сертифицировании экспортных и импортных животных для целей международной торговли. По правилам Таможенного союза перемещение животных между странами допускается при отсутствии у них антител против вируса ящура
. Большинство диагностических учреждений не имеют возможности подтверждения результатов ИФА в РН в соответствии с рекомендациями ВОЗЖ , так как для проведения подобных исследований лаборатория должна быть аккредитована по соответствующему классу биобезопасности для работы с живым вирусом ящура, относящемуся ко II классу патогенности. В таких случаях подозрительные образцы для подтверждения статуса карантинируемых животных следует направлять в аккредитованные референтные центры, имеющие класс биобезопасности не ниже III, что значительно удорожает исследования. В то же время недостаточно всесторонне, в нарушение принципа объективности и достоверности выполненные диагностические мероприятия, субъективный подход в интерпретации результатов исследований могут приводить к смещению полученных данных, искажению итоговых результатов мониторинга и, как следствие, к значительным финансовым потерям.В данной статье мы заострили внимание на случаях неспецифических реакций, проявляющихся иногда в ИФА при тестировании проб от не вакцинированного против ящура КРС, и необходимости подтверждения статуса серопозитивных в отношении ящура особей.
2. Методы и принципы исследования
2.1. Материал для исследования в ИФА
В работе были использованы 4573 образца сыворотки крови от КРС, из 6 условных популяционных групп, в которых только 11 особей (шестая группа) вакцинировались против ящура:
- 1 группа — 450 образцов сыворотки крови КРС разного пола и возраста, поступивших из 25 хозяйств региона I, свободного от ящура без вакцинации;
- 2 группа — 450 образцов сыворотки крови КРС, поступивших из хозяйств региона II, свободного от ящура без вакцинации;
- 3 группа — 160 образцов сыворотки крови, отобранной в ФГБУ «ВНИИЗЖ» от КРС (бычки, возраст — 6 мес.) перед вакцинацией, 0 день;
- 4 группа — 3414 образцов сыворотки крови нетелей КРС, полученных из 8 регионов, свободных от ящура без вакцинации;
- 5 группа — 86 образцов сыворотки крови отелившихся коров из региона III, свободного от ящура без вакцинации;
- 6 группа — 11 образцов сыворотки крови КРС (бычки, возраст — 6 мес.), отобранной через 21 день после однократной иммунизации сорбированной вакциной против ящура серотипов А, О, Asia 1, и 2 образца сыворотки крови от невакцинированного контроля.
2.2. Иммуноферментный анализ (ИФА)
Образцы сыворотки крови КРС исследовали в ИФА на наличие антител к вирусу ящура. В работе использовали коммерческие наборы и тест-системы на основе жидкофазного блокирующего варианта ИФА для определения антител к структурным белкам вируса ящура серотипов А, О, Asia 1 разных штаммов, разработанных в ФГБУ «ВНИИЗЖ», в соответствии с инструкцией по применению набора; коммерческие наборы для обнаружения антител к вирусу ящура типов А, О, Asia 1 на основе конкурентного варианта ИФА представителей ведущих мировых производителей в соответствии с рекомендациями к наборам. Перечень наборов в приведённом ниже списке:
- набор для определения антител к структурным белкам вируса ящура в ИФА, типы А, О, Asia 1, ФГБУ «ВНИИЗЖ», Россия (ARRIAH);
- SPCE for antibodies specific to FMDV Serotype А, O, Asia 1, IZSLER, Италия & the Pirbright Institute, Великобритания (IZSLER);
- ID Screen® FMD Type A, O, Asia 1 Competition, Innovative Diagnostics, Франция (IDVet);
- AsurDx™ FMDV Type A, O, Asia 1 Antibody cELISA Test Kit, BioStoneTM Animal Health, США (BioStone).
Серопозитивность (доля положительных результатов) выражали в процентах через отношение количества положительных значений процента ингибиции (PI) к общему количеству исследований выборки образцов в ИФА.
3. Результаты и обсуждение
Иммуноферментный анализ (ИФА) — один из самых востребованных методов в диагностической практике медицинских и ветеринарных лабораторий. Как и любые иммунохимические методы анализа, ИФА может давать ложноположительные результаты, что не снижает ценности ИФА как диагностического инструмента
. Этот риск следует учитывать при интерпретации результатов и проводить дополнительные исследования для подтверждения во избежание неправильной постановки диагноза.На факт вероятности получения ложноположительных реакций на ящур в ИФА акцентирует внимание Руководство ВОЗЖ по диагностическим тестам и вакцинам для наземных животных. Для минимизирования диагностических ошибок предлагается комбинированный подход в исследованиях, сочетающий скрининговые SP тесты и РН для подтверждения положительных результатов
.Для оценки масштаба неспецифической реакции в ИФА при обследовании КРС, не вакцинированного против ящура, было протестировано 4560 образцов сыворотки крови, входящих в разные выборки образцов: полевые сыворотки — группы 1, 2, 4, 5; опытные сыворотки — группа 3. Основным инструментом для исследований служили наборы производства ФГБУ «ВНИИЗЖ» (ARRIAH) на основе тест-систем для определения антител к структурным белкам вируса ящура разных серотипов, в качестве референтного теста использовались наборы IZSLER (SP тест). Поскольку в задачи наших исследований входило не сравнение специфичности разных тест-систем и наборов, а изучение явления в целом, данные ИФА анализировались без разделения на серотипы. Каждый образец из 4560 тестировали в 4-7 реакциях жидкофазного блокирующего варианта ИФА (ARRIAH), 810 образцов — в 3 реакциях конкурентного варианта ИФА (IZSLER). Результаты исследований отражены на рис. 1 и 2.
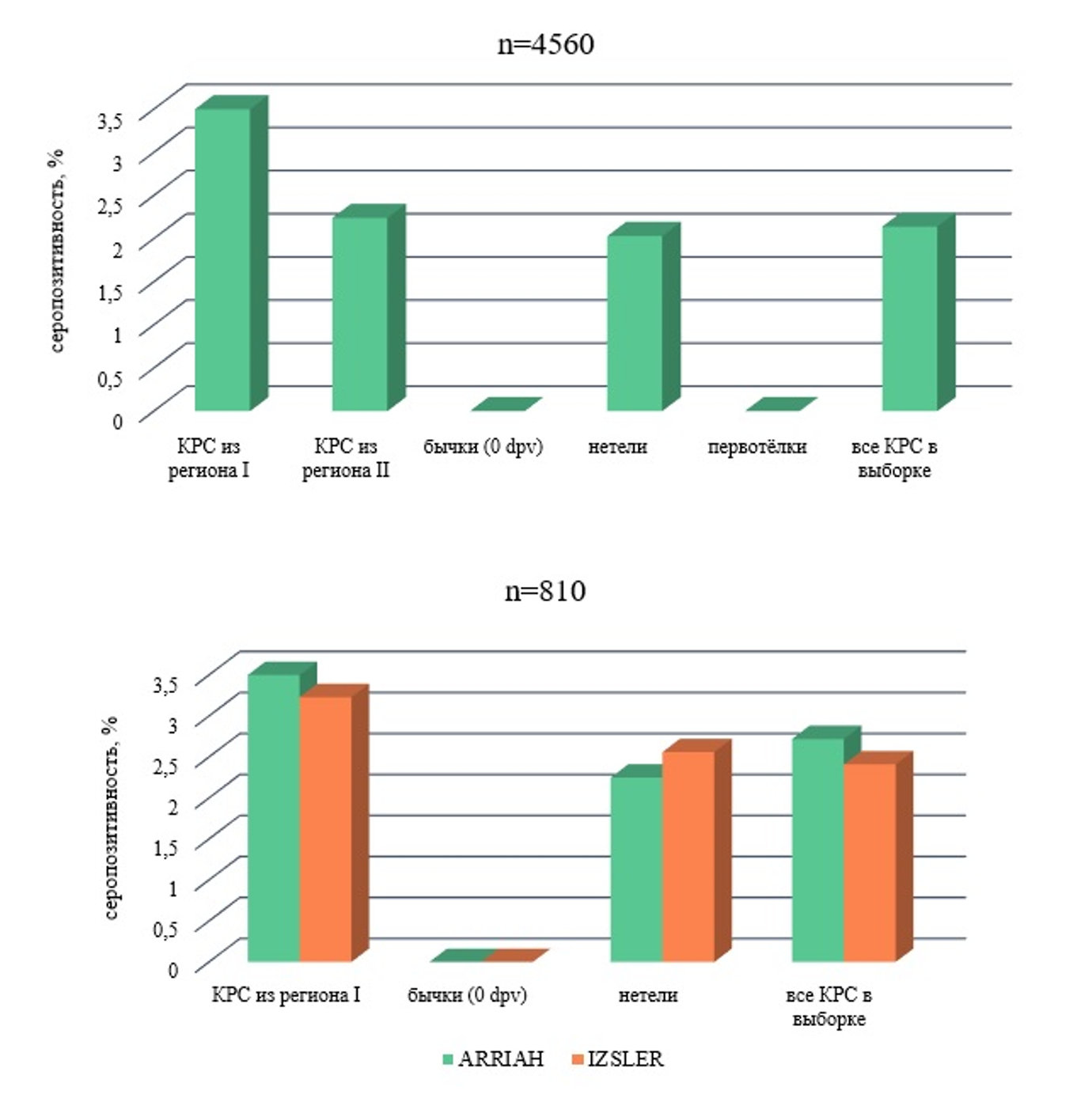
Рисунок 1 - Серопозитивность, определённая в ИФА с использованием тест-систем ARRIAH и IZSLER для разных групп не вакцинированного против ящура КРС
Группы 1 и 2 представляли собой полевые образцы сыворотки крови КРС из разных регионов. Все 900 образцов предварительно были исследованы на наличие антител к неструктурным белкам вируса ящура с использованием набора для обнаружения антител к неструктурным белкам вируса ящура иммуноферментным методом в сыворотках крови крупного и мелкого скота производства ФГБУ «ВНИИЗЖ» (Ящур-NSP-ИФА). Подозрительные образцы, имевшие положительные значения PI хотя бы в одной реакции ИФА для выявления специфических антител к структурным белкам вируса ящура, дополнительно проверяли в реакции нейтрализации (РН) вируса ящура разных серотипов. Ни в одном из протестированных образцов сыворотки крови КРС антител, как к структурным белкам вируса ящура, так и к неструктурным, обнаружено не было.
В состав группы 1 входили коровы возраста 2–13 лет — 82,7%, 6–12-месячные тёлки — 8%, бычки 6–19 мес — 9,3%. Из 25 сельскохозяйственных предприятий региона I в 4 хозяйствах имелись отдельные серопозитивные в отношении ящура особи, определённые таковыми либо в иммуноферментных тест-системах ARRIAH, либо IZSLER; в 10 — в тест-системах и того, и другого производителя; в 7 не выявили ни одной положительно реагирующей особи КРС. Серопозитивность в тест-системах ARRIAH демонстрировали коровы разного возраста и 8–12-месячные тёлки в 2,81% и 0,77% случаев, соответственно, в тест-системах IZSLER — коровы в 3,23% случаев. Положительный статус был установлен для 36% подозрительных образцов сыворотки крови КРС при использовании, как наборов ARRIAH, так и IZSLER. В то время как для 64% подозрительных образцов согласование между наборами отсутствовало: положительные в тест-системах одного производителя были отрицательными в тест-системах другого производителя, и наоборот. То есть положительные результаты реакции подтверждены не были.
Образцы из региона II проверяли на наличие специфических антител против вируса ящура только в тест-системах ARRIAH. Неспецифическая серопозитивность КРС составила 2,24% (рис. 1).
Группа 3 включала 160 образцов сыворотки крови, отобранных от 6-месячных бычков перед вакцинацией (0 dpv) в ФГБУ «ВНИИЗЖ». Все эксперименты на животных проводились в строгом соответствии с межгосударственным стандартом по содержанию и уходу за лабораторными животными ГОСТ 33215-2014, принятым Межгосударственным советом по стандартизации, метрологии и сертификации, а также согласно требованиям Директивы 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях. Животные поставлялись в разное время небольшими партиями, содержались в одинаковых условиях, стрессовая нагрузка была минимальной, условия отбора крови соблюдались. При тестировании данных образцов сыворотки крови в ИФА не было зарегистрировано ни одного положительного значения PI (ARRIAH, IZSLER). Так же как и при обследовании 86 отелившихся коров, группа 5 (ARRIAH).
Группа 4 включала 3414 образцов сыворотки крови нетелей разного срока стельности. При тестировании этих проб в ИФА были выявлены случаи неспецифических реакций неизвестной этиологии, как и при обследовании животных из групп 1 и 2. Тактический подход при интерпретации результатов был аналогичным. Наличие антител к структурным и неструктурным белкам вируса ящура было исключено по данным ИФА (Ящур-NSP-ИФА) и РН вируса ящура разных серотипов. Тем не менее, в ИФА при выявлении антител к структурным белкам вируса ящура имели место положительные значения PI для отдельных проб: в тест-системах ARRIAH 2,03% при полном тестировании всех образцов от нетелей (n=3414) и 2,25% - при выборочном (n=200), в тест-системах IZSLER серопозитивность реакции составила 2,56% при проверке 200 проб от КРС (рисунок 1, n=4560, n=810). Согласования между результатами, полученными в тест-системах ARRIAH и IZSLER, для ложноположительных образцов практически не было: совпадения по качественной реакции составили 29%, не совпали 71% подозрительных образцов.
Однако согласованность результатов между наборами ARRIAH и IZSLER по каждой выборке образцов была более 90% (табл. 1).
Таблица 1 - Согласованность результатов ИФА между тест-системами ARRIAH и IZSLER при исследовании образцов сыворотки крови КРС, не вакцинированного против ящура
Животные | Количество образцов в выборке | Неспецифическая серопозитивность, % (ARRIAH) | Неспецифическая серопозитивность, % (IZSLER) | Согласованность по ложноположительным результатам, % | Согласованность по выборке образцов, % |
КРС из региона I | 450 | 3,58 | 3,23 | 36,1 | 90,4 |
Нетели | 200 | 2,25 | 2,56 | 29,2 | 91,5 |
Бычки, 0 dpv1 | 160 | 0 | 0 | - | 100 |
Все КРС | 810 | 2,72 | 2,41 | 34,1 | 92,3 |
Примечание: pv1 – дни после вакцинации
Чтобы продемонстрировать уровень неспецифического взаимодействия, было выполнено распределение ложноположительных результатов по значениям PI. Как видно на рис. 2, большинство образцов, квалифицированных как положительные (до 1,43% — ARRIAH, до 2,07% — IZSLER), имели низкие, околопороговые значения PI: ARRIAH — PIpos≥50%, IZSLER — PIpos≥70%, и входили в «серую зону». Что свидетельствовало о невысоком уровне неспецифической реакции.
Несогласованность ложноположительных результатов ARRIAH и IZSLER, а также отсутствие подтверждения в других серологических реакциях на ящур характеризовали хаотичное, спонтанное неспецифическое взаимодействие белков в реакции ИФА. Специфическое взаимодействие имеет другой характер.
Пример исследования 11 поствакцинальных и 2 контрольных образцов сыворотки крови КРС, отобранных на 21 день после однократного введения сорбированной вакцины против ящура серотипов А, О, Asia 1, с подтверждением в других серологических реакциях, включая референтные диагностические наборы и РН вируса ящура, генетически и антигенно родственного вакцинным штаммам, представлен на рис. 3. Как показывает анализ рис. 3, на 21 день после введения вакцины 6-месячные бычки демонстрировали хороший иммунный ответ в разных тест-системах ИФА и РН для серотипов А, О, Asia 1. В пробах от двух невакцинированных бычков (контроль) специфических антител обнаружено не было. В целом, картина выстраивалась логичная и закономерная. Результаты ИФА и РН имели хорошее согласование между собой.
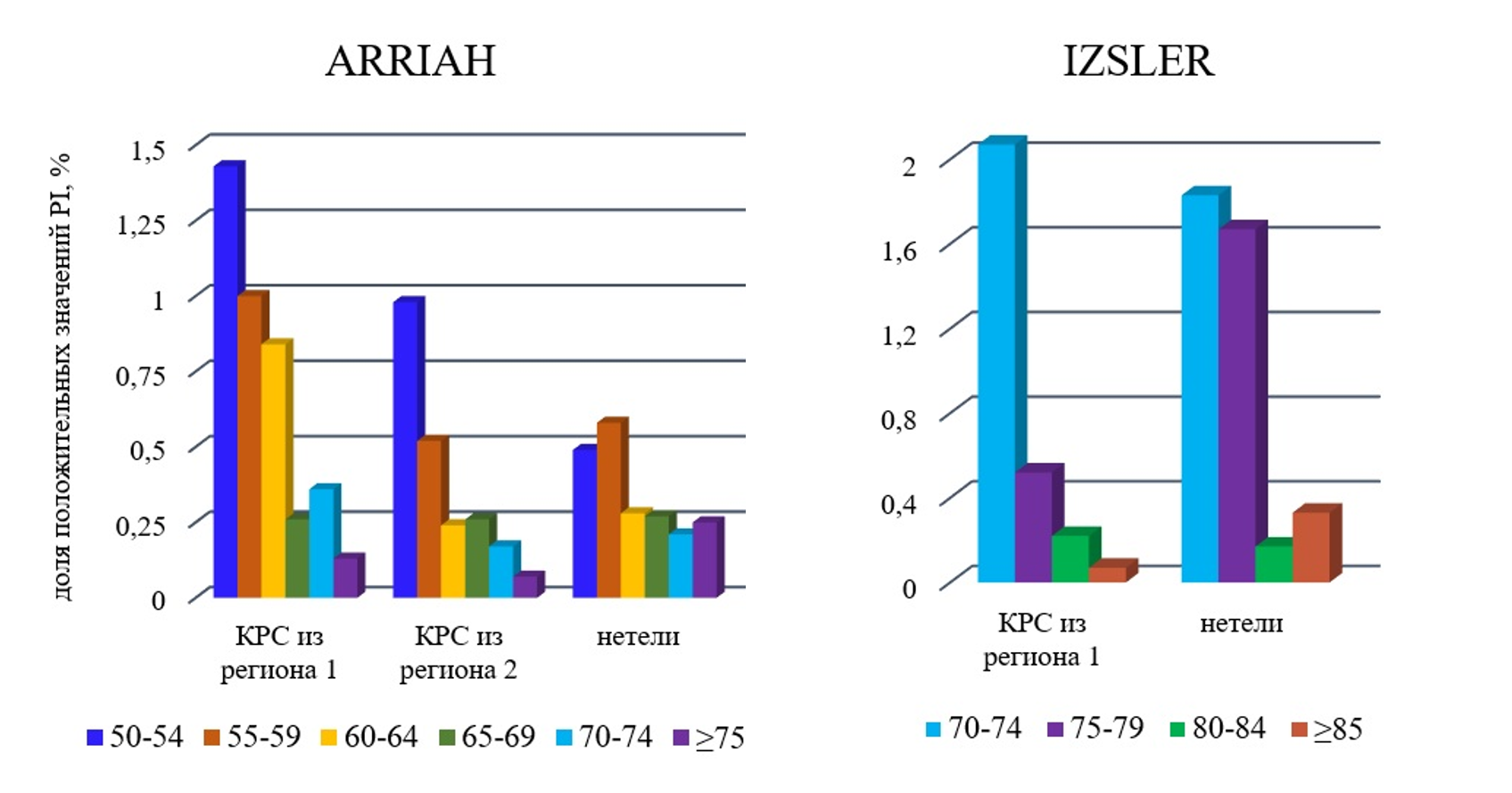
Рисунок 2 - Распределение положительных значений PI, полученных в тест-системах ARRIAH или IZSLER для образцов сыворотки крови не вакцинированного против ящура КРС
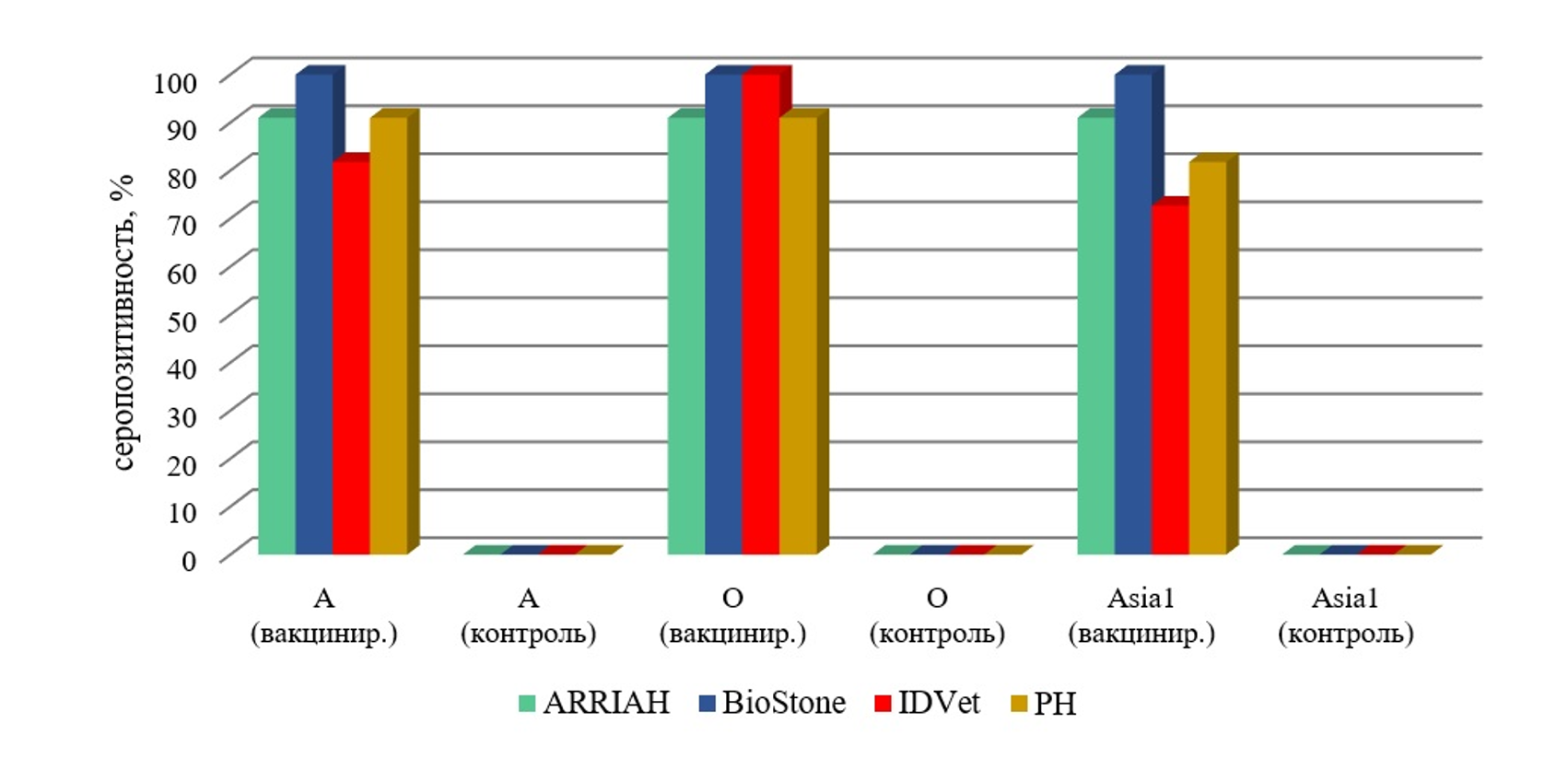
Рисунок 3 - Результаты исследования в ИФА и РН образцов сыворотки крови КРС на напряжённость иммунитета против ящура серотипов А, О, Asia 1 однократно привитых сорбированной противоящурной вакциной и не привитых (контроль) животных
На достоверность результатов серологических исследований может влиять качество сыворотки крови: бактериальная контаминация, гемолиз. Для лабораторных испытаний отбирают только венозную кровь по возможности утром, до кормления животных или по истечении 4 часов после кормления для жвачных животных (крупный и мелкий рогатый скот). Процесс отбора проб крови должен быть максимально безболезненным и быстрым (беспокойство, болевая реакция, длительный венозный застой в месте инъекции изменяют состав крови). На результаты лабораторных исследований могут влиять факторы, связанные с индивидуальными особенностями и физиологическим состоянием организма животного, такие как возраст, нервный стресс, воспалительные процессы, различные хронические заболевания, которые могут быть вызваны, как инфекциями, так и гельминтозами, а также аллергическими реакциями на чужеродные (неспецифические) белки , , . Всё, что может способствовать накоплению неспецифического белка в сывороточных образцах и препятствовать полноценному прохождению реакции ИФА.
При анализе данных, полученных в ходе проведённых исследований, нами было сделано предположение о связи повышенного гормонального фона у КРС, вызванного острым или хроническим стрессом, с частотой регистрации неспецифической реакции на ящур в ИФА.
У большинства млекопитающих, в том числе, и КРС, основным гормоном, секретируемым клетками пучковой оболочки коры надпочечников, является кортизол. Он играет важную роль в метаболизме жиров, белков и углеводов и участвует в широком спектре физиологических процессов организма человека и животных. Секреция кортизола в организме происходит под контролем гипоталамо-гипофизонадпочечниковой оси по определенному циркадному ритму и может существенно повышаться в ответ на физиологический стресс. Существует огромное количество внешних и внутренних факторов, вызывающих стресс. В зависимости от продолжительности их воздействия стресс может быть острым или хроническим. Уровень кортизола может увеличиваться на короткий период времени при остром стрессе, чтобы обеспечить глюкозой клетки организма для реагирования на стресс. Как только острая реакция на стресс утихает, уровень кортизола возвращается к нормальному (базовому) уровню .
У сельскохозяйственных животных стрессовые реакции могут вызывать такие манипуляции, как обработка, транспортировка, обезроживание. Удерживание животных является кратковременным стрессором, приводящим к довольно быстрому повышению уровня кортизола. Взятие крови у животных, связанные с процедурой болевые ощущения, испуг могут вызвать мгновенный выброс кортизола. Концентрация глюкокортикоидов также изменяется в зависимости от возраста. В основном наблюдается повышение их содержания при старении у многих видов животных .
Беременность можно отнести к хроническому стрессу. Гормоны коры надпочечников участвуют в формировании и поддержании беременности. Показана связь уровня кортизола в крови нетелей разных пород со сроком стельности , , . До 3 месяца стельности уровень кортизола существенно не изменялся по сравнению с показателями до осеменения. Видимые изменения его концентрации наблюдались на 5 месяце стельности. На 7 месяце стельности уровень кортизола резко увеличился и продолжал возрастать, достигая максимальных значений на 9 месяце. Полученные результаты о влиянии беременности на уровень кортизола в плазме крови согласовывались с данными других исследователей, указывающих, что нормально протекающая беременность сопровождается повышением содержания в крови гликокортикоидов по мере прогрессирования беременности. При этом было отмечено, что наиболее высокие уровни кортизола во второй половине стельности сохранялись у помесных нетелей при скрещивании симментальской и абердин-ангусской пород по отношению к голштинизированной чёрно-пёстрой и симментальской породам . Во все периоды стельности относительно более высокий уровень общего кортизола был отмечен у нетелей породы джерси по сравнению с породами монбельярд, красно-пёстрая и голштинизированная чёрно-пёстрая .
Также регистрировали изменения концентрации кортизола в крови коров голштинизированной чёрно-пёстрой породы разной молочной продуктивности. Наивысшая концентрация кортизола наблюдалась на 2 месяце лактации (пик лактации) с последующими постепенным понижением к 8 месяцу и увеличением к концу лактации — 10 месяцу. При этом концентрация кортизола во все периоды лактации была выше в группе коров с самой высокой продуктивностью .
Известный статус нетелей позволяет рассмотреть повышенный гормональный фон, как одну из возможных причин проявления неспецифической реакции в ИФА. В процессе подготовки данной статьи было исследовано 3414 образцов сыворотки крови, отобранной от карантинных нетелей голштинской породы, характеризующейся высокой молочной продуктивностью и хорошей адаптивностью, из регионов, свободных от ящура без вакцинации. Отдельные образцы показывали положительный результат в ИФА (рис. 1, 2). От подозрительных животных либо от всего обследуемого стада была отобрана или запрошена в хозяйстве-поставщике сыворотка крови для повторного анализа. Результаты тестирования представлены в табл. 2, на рис. 4. При обследовании в ИФА КРС (нетели, первотёлки) из 7 хозяйств в разные периоды времени были получены отличающиеся результаты для одних и тех же животных, что свидетельствовало о динамических процессах, как в сторону увеличения неспецифических проявлений, так и уменьшения. К сожалению, мы не всегда располагали исчерпывающей информацией о животных для проведения детального анализа. Однако при рассмотрении отдельных ситуаций удавалось проследить определённую закономерность.
Таблица 2 - Анализ ложноположительных реакций на ящур в ИФА (ARRIAH) у нетелей и первотёлок КРС при тестировании парных образцов сыворотки крови
Хозяйство/отбор крови | Срок отбора крови (срок стельности/отёл) | Неспецифическая серопозитивность, % |
1/I | ~8 мес стельности | 6,2 |
1/II | не позднее 2 нед после отёла | 0 |
2/I | ~8 мес стельности | 3,8 |
2/II | ~9 мес стельности/отёлы в карантине | 1,4 |
3/I | 5 мес стельности | 0 |
3/II | 6 мес стельности | 2,3 |
3/III | ~6,5 мес стельности | 1,5 |
3/IV | ~7,5 мес стельности | 1,3 |
4/I | ~6 мес стельности | 1,7 |
4/II | ~6,5 мес стельности | 2,3 |
5/I | нет данных | 3,0 |
5/II | через 2 нед после I отбора | 2,4 |
5/III | через 2 нед после II отбора | 1,9 |
6/I | нет данных | 0,8 |
6/II | через 2 нед после I отбора | 1,7 |
7/I | нет данных | 1,8 |
7/II | через 2 нед после I отбора | 0 |
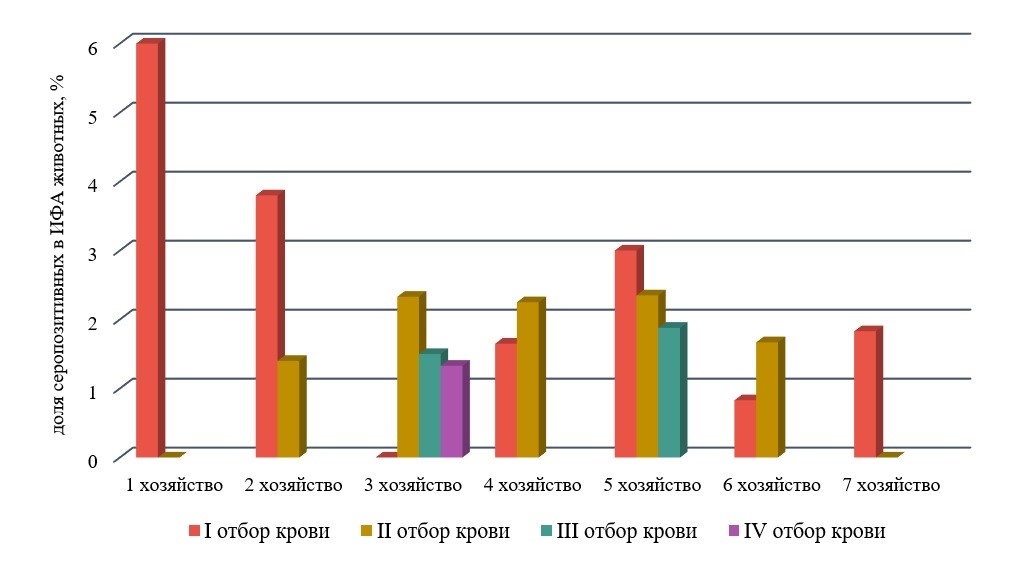
Рисунок 4 - Серопозитивность на ящур в ИФА (ARRIAH) нетелей и первотёлок КРС при тестировании парных образцов сыворотки крови
Последующие отборы крови от нетелей в хозяйстве 3, а также три последовательных отбора в хозяйстве 5 подтвердили ложноположительные результаты на ящур в ИФА большинства подозрительных особей из этих хозяйств, что свидетельствовало о длительном воздействии фактора, провоцирующего неспецифические проявления в реакции ИФА. Однако несколько животных, имевших первоначально положительный статус, при повторном тестировании оказались серонегативными. Возможно это было связано с острым кратковременным стрессом, либо с низким уровнем неспецифической реакции в области «серой зоны», в результате чего один и тот же образец при повторных исследованиях может демонстрировать то положительный, то отрицательный результат. Также следует отметить, что третий и четвёртый отборы крови в карантинном стаде хозяйства 3 и второй и третий отборы в хозяйстве 5 производились только от подозрительных нетелей. Вероятно при полном обследовании стад картина была бы несколько другая.
В хозяйствах 4 и 6 ожидаемо наблюдали повышение количества ложноположительных образцов с увеличением срока стельности. Для нетелей из хозяйства 7, серопозитивных при первом отборе проб крови, через 2 недели при исследовании в ИФА парных сывороток крови были получены отрицательные значения PI. Это можно объяснить, например, кратковременным выбросом кортизола при первом отборе крови.
В любом случае все вышеописанные примеры положительного реагирования на ящур в ИФА образцов сыворотки крови от невакцинированного КРС требуют дополнительных исследований. Констатация факта получения положительных результатов в ИФА при скрининговом тестировании образцов сыворотки крови от невакцинированного КРС не является подтверждением наличия специфических антител к вирусу ящура в крови данных животных.
При использовании в исследованиях на ящур коммерческих наборов для определения антител к структурным белкам вируса ящура производства ФГБУ «ВНИИЗЖ» (ARRIAH) подтверждение положительных результатов тестирования (PIpos≥50%) проводят в соответствии с рекомендациями ВОЗЖ для жидкофазного блокирующего варианта ИФА. Образцы сыворотки крови от не вакцинированных против ящура животных, положительно реагирующих в ИФА, исследуют повторно методом последовательных разведений. Конечная точка титрования (титр) сыворотки определяется по значению PI, равному или более 50%. При этом титр сыворотки ≤64 является отрицательным (положительное значение PI в одной из двух лунок в разведении 1:64), ≥90 — положительным (положительное значение PI в двух лунках в разведении 1:64). В случае получения положительного результата может быть запрошен образец сыворотки крови, повторно отобранный от данного животного. Положительный статус считается установленным, если титр сыворотки в ИФА имеет значение 45 (положительное значение PI в двух лунках в разведении 1:32) и выше. При получении положительных или сомнительных результатов в ИФА для образцов сыворотки крови от не вакцинированных против ящура животных или животных с неизвестным статусом требуется их подтверждение в РН вируса ящура .
4. Заключение
В данной работе было проведено 26089 тестов образцов сыворотки крови не вакцинированного против ящура КРС, из них 22728 тестов — с использованием наборов ARRIAH, 3121 тестов – IZSLER, что позволило сделать определённые выводы. В реакции ИФА разных форматов, как в тест-системах ARRIAH, так и IZSLER, было получено некоторое количество положительных результатов, не подтвердившихся в других серологических реакциях на наличие антител к структурным и неструктурным белкам вируса ящура. В связи с чем эти образцы были квалифицированы как ложноположительные. Однако такое явление не имело массового характера. При обследовании в тест-системах ARRIAH разных групп КРС, не вакцинированного против ящура, доля ложноположительных результатов составила 2,14%, что близко к допустимым значениям, установленным нами ранее в рамках определения диагностической специфичности при валидации тест-систем ARRIAH для серотипов А, О, Asia 1: 1,0%, 1,5%, 2,4%, соответственно
. Диагностическая специфичность тест-систем для ретроспективной диагностики ящура (SP тесты) при обследовании невакцинированного скота является статистической величиной и зависит от выборки образцов для исследования. При этом значение имеют пол, возраст, физиологическое состояние животных. При параллельном исследовании в тест-системах ARRIAH и IZSLER 810 образцов сыворотки крови от невакцинированного КРС все оказавшиеся серопозитивными в ИФА особи были женского пола преимущественно репродуктивного возраста. Уровень неспецифической реакции был низким, большинство образцов имели околопороговые значения PI. Число совпадений результатов тестов ARRIAH и IZSLER по качественным характеристикам для подозрительных животных составило 29–36%. При этом согласование между результатами двух тестов по всей выборке образцов (n=810) равнялось 92,3%.Таким образом, для соблюдения объективности и достоверности диагностических мероприятий положительный результат на ящур в ИФА, полученный при обследовании невакцинированного поголовья, должен быть подтверждён. Все подозрительные на ящур образцы сыворотки крови КРС необходимо исследовать на наличие антител к структурным белкам вируса ящура в реакции нейтрализации вируса ящура разных серотипов.
