ИССЛЕДОВАНИЕ ПРОЦЕССА СУЛЬФАТИЗИРУЮЩЕГО ОБЖИГА С ИСПОЛЬЗОВАНИЕМ СУЛЬФАТОВ ЖЕЛЕЗА ПРИ ПЕРЕРАБОТКЕ ЦИНКОВЫХ КЕКОВ
ИССЛЕДОВАНИЕ ПРОЦЕССА СУЛЬФАТИЗИРУЮЩЕГО ОБЖИГА С ИСПОЛЬЗОВАНИЕМ СУЛЬФАТОВ ЖЕЛЕЗА ПРИ ПЕРЕРАБОТКЕ ЦИНКОВЫХ КЕКОВ
Научная статья
Грудинский П.И.1, *, Смирнова В.Б.2, Дюбанов В.Г.3, Козлов П.А.4
1 ORCID: 0000-0002-7358-150X,
1, 2, 3 Институт металлургии и материаловедения им. А.А. Байкова РАН, Москва, Россия;
Технический университет УГМК, Верхняя Пышма, Россия
* Корреспондирующий автор (GruPaul[at]yandex.ru)
Аннотация
Приведены результаты исследования процесса сульфатизирующего обжига цинковых кеков с использованием сульфатов железа FeSO4 и Fe2(SO4)3. Изучен элементный и фазовый состав, а также микроструктура цинкового кека ПАО «Челябинский цинковый завод». На основе термодинамического расчёта установлены температурные интервалы сульфатизирующего обжига и необходимое количество присадок сульфатов железа для сульфатизации цинка и меди. В лабораторных экспериментах получено, что из обожжённых образцов не менее 98% цинка и не менее 88% меди переходит в раствор в ходе водной отмывки, тогда как степень перехода железа в раствор не превышает 3%. Полученные результаты свидетельствуют о высокой эффективности сульфатизирующего обжига для перевода содержащихся в цинковых кеках цинка и меди из ферритной в водорастворимую форму.
Ключевые слова: цинковые кеки, сульфатизирующий обжиг, сульфат железа (II), сульфат железа (III), сульфатизация.
STUDY OF SULPHATING ROASTING WITH THE HELP OF IRON SULPHATES IN ZINC CAKES PROCESSING
Research article
Grudinsky P.I. 1, *, Smirnova V.B. 2, Dyubanov V.G. 3, Kozlov P.A. 4
1 ORCID: 0000-0002-7358-150X,
1, 2, 3 A. A. Baikov Institute of Metallurgy and Materials Science of RAS, Moscow, Russia;
4 Ural Mining and Metallurgical Company, Verkhnyaya Pyshma, Russia
* Corresponding author (GruPaul[at]yandex.ru)
Abstract
The results of the study of the process of sulphating roasting of zinc cakes with the help of iron sulfates FeSO4 and Fe2(SO4)3 are presented in the article. The elemental and phase composition, as well as the microstructure of the zinc cake of PJSC “Chelyabinsk Zinc Plant” were studied. Based on the thermodynamic calculation, the temperature ranges of the sulphating roasting and the required amount of iron sulfate additives for sulfatization of zinc and copper are established. Laboratory experiments showed that at least 98% of zinc and at least 88% of copper from calcined samples go into solution during water washing, while the degree of transition of iron into the solution does not exceed 3%. The results indicate high efficiency of sulphating roasting for converting zinc and copper contained in zinc cakes from ferritic to water-soluble form.
Keywords: zinc cakes, sulphating roasting, iron (II) sulfate, iron (III) sulfate, sulfatization.
Введение
В настоящее время около 95% цинка производят гидрометаллургическим методом [1, С. 11]. В этом методе полученный после обжига цинковых сульфидных концентратов огарок подвергают сернокислотному выщелачиванию. При этом образуются осадки выщелачивания с высоким содержанием цинка (18-24%) и меди (0,3-1,5%), называемые цинковыми кеками. Цинк и медь в кеках находятся в форме труднорастворимых ферритов. Основным применяемым методом переработки кеков является вельц-процесс [2], основанный на восстановительно-дисстиляционной пирометаллургической переработке во вращающейся трубчатой печи при температурах 1200‑1300°C. В результате получаются возгоны (вельц-окись), пригодные для дальнейшего выщелачивания и электролитического извлечения цинка, а также клинкер, используемый для извлечения меди на предприятиях медной промышленности. Вельц-процесс позволяет достигнуть высоких показателей по извлечению цинка (более 90%), однако он достаточно дорогостоящий из-за высокого расхода коксовой мелочи, достигающего 50% по отношению к кеку.
В промышленной практике существуют и гидрометаллургические методы переработки цинковых кеков на основе растворения ферритов цинка и меди серной кислотой высокой концентрации с переводом цинка, меди и железа в раствор и дальнейшем осаждении железа в виде гематита (гематит-процесс), гетита (гетит‑процесс) и ярозита (ярозит-процесс) [3, С. 15]. Гематит-процесс предполагает автоклавное осаждение железа при повышенных температурах (180-120°C) с получением железосодержащего осадка, направляемого на предприятия чёрной металлургии или в производство цемента. Однако использование сложного в эксплуатации и дорогого оборудования для автоклавного выщелачивания ограничивает использование этого метода. В гетит-процессе получается цинковый промежуточный продукт, направляемый на окислительный обжиг, а также кек для использования в свинцовом производстве. К недостаткам этого метода можно отнести низкое извлечение в раствор цинка и меди, а также невозможность использования железосодержащего гетитного осадка в чёрной металлургии из-за высокого остаточного содержания в нём цинка. В ярозит-процессе железо осаждают в виде непригодных для использования в чёрной металлургии ярозитов NH4Fe3(SO4)2·(OH)6, KFe3(SO4)2·(OH)6, NaFe3(SO4)2·(OH)6. По сравнению с гетит-процессом, в ярозит-процессе выше извлечение цинка и меньше выход железистого осадка, но требуется дополнительная очистка раствора от вредных примесей. Существуют методы для снижения перехода железа в раствор при выщелачивании цинковых кеков путём специальных добавок [4], однако их эффективность недостаточно изучена.
Известны методы пирометаллургической переработки цинковых кеков путём восстановительной плавки [5], восстановительной прокалки [6], флотационной переработки с предварительной сульфидизирующей прокалкой [7]. Разработаны способы сульфатизации цинковых кеков путём прокалки совместно с элементарной серой на воздухе [8], а также совместно с олеумом [9].
В настоящей работе рассмотрен процесс сульфатизирующего обжига цинковых кеков в присутствии сульфатов железа FeSO4 и Fe2(SO4)3 с целью перевода соединений цинка и меди в водорастворимую сульфатную форму, а железа в нерастворимые в воде соединения.
Методы
Элементный состав цинкового кека ПАО «Челябинский цинковый завод» был изучен на рентгенофлуоресцентном спектрометре Axios Advanced (Нидерланды), фазовый состав – на рентгеновском дифрактометре ARL X'TRA (Швейцария) с рентгеновским излучением Cu-Kα. Содержание углерода было определено на приборе LECO СS-400 (США). Микроструктуру цинкового кека исследовали методом сканирующей электронной микроскопии на приборе Zeiss EVO LS10 (Германия) с приставкой для рентгеновского энергодисперсионного микроанализа в режиме детектирования отражённых электронов.
Для термодинамических расчётов использовали программу HSC Chemistry 5.11 [10]. Расчёт равновесных состояний был выполнен в интервале температур 25-900°C и атмосферном давлении. Равновесные составы систем определяли методом минимизации энергии Гиббса для изобарно-изотермических условий. Расчёты были выполнены на 100 кг цинкового кека, компоненты малых содержаний не учитывали. Ввиду отсутствия термодинамических данных для присутствующего в исходном материале ктеназита Cu2.4Zn2.6(SO4)2∙(OH)6∙6H2O он был пересчитан на соответствующие гидраты сульфатов цинка ZnSO4∙6H2O и меди CuSO4∙5H2O. На основании результатов элементного и фазового анализов в расчёты были заложены следующий состав цинкового кека: 45,16% ZnFe2O4; 2,84% ZnS; 11,27% ZnSO4∙6H2O; 0,07% ZnO; 8,35% CuFe2O4; 3,27% CuSO4∙5H2O; 0,14% Cu2S; 0,10% CuO; 10,92% CaSO4∙2H2O; 6,02% PbSO4; 2,35% BaSO4; 1,74% FeS; 0,5% Fe2O3; 2,22% CaCO3; 1,32% MnS; 0,41% CdO; 1,04% MgO; 0,89% Al2O3; 0,84% SiO2; 0,55% As2O3.
Эксперименты были проведены следующим образом. Цинковый кек ПАО «ЧЦЗ», а также чистые реактивы FeSO4 (хч.) и Fe2(SO4)3 (хч.) были размолоты до фракции <0,1 мм в агатовой ступке. Смеси готовили в V‑образном порошковом смесителе в течение 24 часов. Навески 7,5-12,5 г полученных смесей помещали в муфельную печь, нагревали со скоростью 300°C/час до температуры 625°C и выдерживали в течение 6 ч. Температуру задавали с помощью микропроцессорного автоматического регулятора с использованием управляющей платинородиевой термопары S-типа.
После прокалки выполняли водную отмывку полученных огарков на магнитной мешалке с подогревом MS-H280-Pro, температуру процесса задавали c помощью датчика PT1000. Отмывка была проведена при температуре 70°C, соотношении твёрдого к жидкому Т:Ж = 1:160 и времени перемешивания 30 мин. После фильтрации содержания цинка, меди и железа в полученных растворах были определены методом атомно-абсорционной спектроскопии на приборе Therm Fisher Scientific iCE 3500 (США).
Результаты и их обсуждение
Элементный состав цинкового кека представлен в табл. 1, их дифрактограмма – на рис. 1.
Таблица 1 – Химический состав цинкового кека ПАО «ЧЦЗ», %

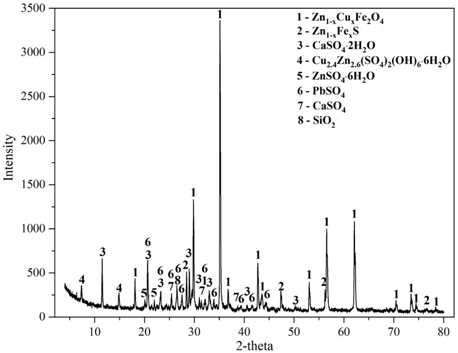
Рис. 1 – Дифрактограмма образца цинкового кека ПАО «ЧЦЗ»
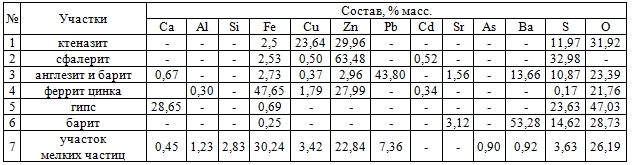
Установлено, что цинковый кек имеет в своём составе более 15% цинка и чуть менее 3% меди. Основными фазами цинкового кека являются феррит цинка-меди Zn1-xCuxFe2O4, сфалерит Zn1-xFexS, гипс CaSO4∙2H2O, ктеназит Cu2.4Zn2.6(SO4)2∙(OH)6∙6H2O, бианкит ZnSO4∙6H2O и англезит PbSO4. Микроструктура образца цинкового кека с обозначением участков показана на рис.2, состав участков представлен в табл. 2.

Рис. 2 – Микроструктура образца цинкового кека:
1 – сульфат цинка-меди (ктеназит); 2 – сульфид цинка (сфалерит); 3 – сульфаты свинца и бария (англезит и барит); 4 – феррит цинка-меди; 5 – сульфат кальция (гипс); 6 – сульфат бария (барит); 7 – участок мелких частиц
Таблица 2 – Состав обозначенных цифрами 1-7 участков цинкового кека ПАО «ЧЦЗ»
Исследования микроструктуры показали, что основная часть цинкового кека представлена в виде субмикронных частиц, основную часть которой представлена в ферритной форме. Также присутствуют отдельные частицы гипса, ктеназита, сфалерита, барита и англезита размером более 10 мкм.
На рис. 3 и 4 представлены результаты термодинамических расчётов в программе HSC Chemistry.
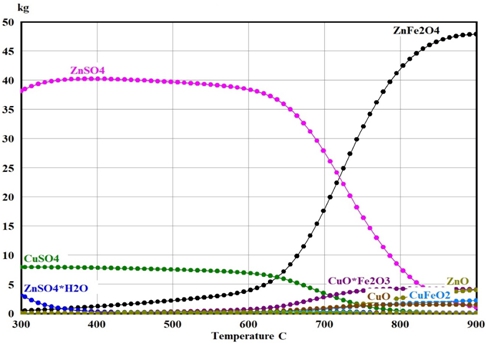
Рис. 3 – Температурная зависимость равновесных количеств соединений цинка и меди в цинковом кеке при 300-900°C при добавлении 100 кг FeSO4∙7H2O
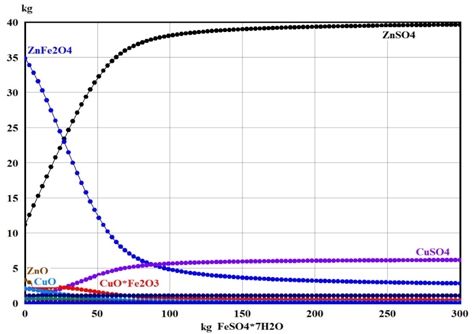
Рис. 4 – Зависимость равновесных количеств соединений цинка и меди от количества добавляемого FeSO4∙7H2O к 100 кг цинкового кека при 625°C
Расчёты показали, что сульфатизация более 90% цинка и меди, содержащихся в цинковом кеке, возможна в интервале температур 300‑650°C. При повышении температуры выше 650°С количество феррита цинка в системах резко возрастает, а получаемых сульфатов цинка и меди – падает. При добавлении в систему FeSO4∙7H2O и Fe2(SO4)3∙9H2O были получены качественно схожие результаты, однако количественно они оказались различными. Установлено, что для сульфатизации более 90% цинка и меди к 100% цинкового кека необходимо добавить не менее 95% FeSO4∙7H2O или не менее 55% Fe2(SO4)3∙9H2O. Также расчёты показали, что железо во всех случаях будет переходить в гематит Fe2O3. Таким образом, процесс взаимодействия ферритов цинка и меди с сульфатами железа идёт по следующим общим реакциям:
| 4ZnFe2O4 + 4FeSO4 + O2(г) = 4ZnSO4 + 6Fe2O3 |
(1) |
| 3ZnFe2O4 + Fe2(SO4)3 = 3ZnSO4 + 4Fe2O3 | (2) |
| 4CuFe2O4 + 4FeSO4 + O2(г) = 4CuSO4 + 6Fe2O3 | (3) |
| 3CuFe2O4 + Fe2(SO4)3 = 3CuSO4 + 4Fe2O3 | (4) |
Реакции (1)-(4) термодинамически возможны во всём исследуемом интервале температур.
Для достоверной проверки возможности сульфатизации цинка и меди были проведены эксперименты со смесями при значительном избытке сульфатов к цинковому кеку по отношению к расчётным значениям. Их результаты представлены в табл. 3. Для сравнения необработанный цинковый кек без предварительного сульфатизирующего обжига также был подвергнут водной отмывке.
Таблица 3 – Степень извлечения компонентов из цинкового кека и огарков после обжига смесей при 625°C в течение 6 часов и последующей водной отмывки, %
| № | Компоненты смесей | Массовое соотношение | Степень извлечения, % | ||
| Zn | Cu | Fe | |||
| 1 | Цинковый кек без обжига | - | 23,5 | 1,8 | - |
| 2 | Цинковый кек + FeSO4∙7H2O | 1:2 | 99,5 | 88,9 | 2,6 |
| 3 | Цинковый кек + Fe2(SO4)3∙9H2O | 1:1 | 98,5 | 89,1 | 1,8 |
Как следует из приведенных данных, сульфатизирующий обжиг обеспечил значительно более полное извлечение цинка и меди в раствор по отношению к необожжённому кеку. В процессе отмывки цинкового кека в раствор переходит лишь небольшая доля цинка и меди, вероятно, находящаяся в виде сульфатных соединений. Из обожжённых образцов в раствор перешло более 98% цинка и более 88% меди, при этом степень перехода железа в раствор оказалась незначительной.
Полученные результаты свидетельствуют о высокой эффективности сульфатизирующего обжига для перевода содержащихся в цинковых кеках цинка и меди из ферритной в водорастворимую форму при использовании обоих сульфатов железа. При этом железосодержащий осадок с железом в форме гематита имеет перспективы быть использованным в качестве сырья в чёрной металлургии. Параметры обжига и отмывки для конкретных условий производства могут быть оптимизированы в части количества сульфатизаторов, температуры процесса и времени обжига. Предложенный подход может быть использован для переработки других материалов, содержащих цинк и медь в виде труднорастворимых ферритов.
| Финансирование Статья подготовлена по результатам работы, выполненной по программе Президиума РАН №39 (проект № АААА-А18-118031490126-8) | Funding The article was prepared based on the results of the work carried out under the program of the Presidium of the Russian Academy of Sciences No. 39 (project No. AAAA-A18-118031490126-8). |
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Информационный справочник по наилучшим доступным технологиям ИТС 13-2016. Производство свинца, цинка и кадмия. М.: Бюро НДТ, 2016. – 253 с.
- Kozlov P. A. The Waelz Process / P. A. Kozlov. – Moscow: Ore and metals publishing house, 2003. – 160 p.
- Fugleberg S. Finnish expert report on best available techniques in zinc production / S. Fugleberg. – Helsinki: Edita Ltd, 1999. – 45 p.
- Alizadeh R. Recovery of zinc from leach residues with minimum iron dissolution using oxidative leaching / R. Alizadeh, F. Rashchi, R. Vahidi // Waste Management & Research. – 2011. – V. 29, Iss. 2. – P. 165–171. doi: 10.1177/0734242X10372661
- Chumarev V. M. Carbon metallothermic smelting of zinc cakes in the electric furnace / V. M. Chumarev, E. N. Selivanov, G. P. Kharitidi, et al. // Proceedings – European Metallurgical Conference, EMC 2009. – 2009. – V. 3. – P. 817–832.
- Peng N. Decomposition of zinc ferrite in zinc leaching residue by reduction roasting / N. Peng, B. Peng, L. Y. Chai, et al. // Procedia Environmental Sciences. – 2012. – V.16. – P. 705-714. doi: 10.1016/j.proenv.2012.10.097
- Zheng Y. X. An innovative technology for recovery of zinc, lead and silver from zinc leaching residue / Y. X. Zheng, J. F. Lu, W. Liu // Physicochemical Problems of Mineral Processing. – 2016. – V. 52, Iss. 2. – P. 943–954. doi: 10.5277/ppmp160233
- Zhang Y. Zinc recovery from franklinite by sulphation roasting / Y. Zhang, X. Yu, X. Li // Hydrometallurgy. – 2011. – V. 109. – P. 211–214. doi: 10.1016/j.hydromet.2011.07.002
- Алкацева В. М. Принципиальная схема переработки цинковых кеков / В. М. Алкацева // Известия вузов. Цветная металлургия. – 2014. – №3. – С. 28–32.
- Roine A. Outokumpu HSC Chemistry for Windows. Chemical Reaction and Equilibrium Software with Extensive Thermochemical Database / A. Ronie. – Pori: Outokumpu Research OY, 2002. – 448 p.
Список литературы на английском языке / References in English
- Informatsionnyy spravochnik po nailuchshim dostupnym tekhnologiyam ITS 13-2016. Proizvodstvo svintsa, tsinka i kadmiya [Best Available Technique information guide ITS 13-2016. Production of lead, zinc and cadmium]. M. : Byuro NDT, 2016. – 253 p. [In Russian]
- Kozlov P. A. The Waelz Process / P. A. Kozlov. – Moscow: Ore and metals publishing house, 2003. – 160 p.
- Fugleberg S. Finnish expert report on best available techniques in zinc production / S. Fugleberg. – Helsinki: Edita Ltd, 1999. – 45 p.
- Alizadeh R. Recovery of zinc from leach residues with minimum iron dissolution using oxidative leaching / R. Alizadeh, F. Rashchi, R. Vahidi // Waste Management & Research. – 2011. – V. 29, Iss. 2. – P. 165–171. doi: 10.1177/0734242X10372661
- Chumarev V. M. Carbon metallothermic smelting of zinc cakes in the electric furnace / V. M. Chumarev, E. N. Selivanov, G. P. Kharitidi, et al. // Proceedings – European Metallurgical Conference, EMC 2009. – 2009. – V. 3. – P. 817–832.
- Peng N. Decomposition of zinc ferrite in zinc leaching residue by reduction roasting / N. Peng, B. Peng, L. Y. Chai, et al. // Procedia Environmental Sciences. – 2012. – V.16. – P. 705-714. doi: 10.1016/j.proenv.2012.10.097
- Zheng Y. X. An innovative technology for recovery of zinc, lead and silver from zinc leaching residue / Y. X. Zheng, J. F. Lu, W. Liu // Physicochemical Problems of Mineral Processing. – 2016. – V. 52, Iss. 2. – P. 943–954. doi: 10.5277/ppmp160233
- Zhang Y. Zinc recovery from franklinite by sulphation roasting / Y. Zhang, X. Yu, X. Li // Hydrometallurgy. – 2011. – V. 109. – P. 211–214. doi: 10.1016/j.hydromet.2011.07.002
- Alkatseva V. M. Printsipial'naya skhema pererabotki tsinkovykh kekov [The principal diagram of zinc cakes processing] / V. M. Alkatseva // Izvestiya vuzov. Tsvetnaya metallurgiya. – 2014. – №3. – P. 28–32. [In Russian]
- Roine A. Outokumpu HSC Chemistry for Windows. Chemical Reaction and Equilibrium Software with Extensive Thermochemical Database / A. Ronie. – Pori: Outokumpu Research OY, 2002. – 448 p.