АНАЛИЗ МИКРОФЛОРЫ ПРИ ВОЗДЕЙСТВИИ ЛАЗЕРНЫМ ИЗЛУЧЕНИЕМ НИЗКОЙ ИНТЕНСИВНОСТИ ПРИ ЛЕЧЕНИИ ГЛУБОКОГО КАРИЕСА
АНАЛИЗ МИКРОФЛОРЫ ПРИ ВОЗДЕЙСТВИИ ЛАЗЕРНЫМ ИЗЛУЧЕНИЕМ НИЗКОЙ ИНТЕНСИВНОСТИ ПРИ ЛЕЧЕНИИ ГЛУБОКОГО КАРИЕСА
Аннотация
При глубоком кариесе околопульпарный слой дентина подвержен повреждению, что приводит к риску возникновения инфекционных и воспалительных процессов в пульпе и к разрушению большего объема твердых тканей зубов. В настоящее время актуальным является внедрение лазерных технологий в алгоритм лечения глубокого кариеса для оказания обезболивающего, противовоспалительного и противоотечного, противокариозного и бактерицидного действия, что способствует сохранению витальности пульпы. Цель исследования состоит в оценке микробной обсемененности глубоких кариозных полостей при использовании алгоритма лечения с применением низкоинтенсивного лазерного излучения. Материалы и методы. В 48 клинических случаях глубокого кариеса для подтверждения диагноза была проведена дентинометрия на этапе препарирования, далее были применены лазерные технологии в определенных комбинациях с последующим пломбированием методом слоенной реставрации. Для оценки микробной обсемененности проводили микробиологическое исследование материала со дна сформированных полостей до и после применения красного и инфракрасного лазера. Результаты. На основании дентинометрии подтвердили поставленный диагноз – глубокий кариес. По результатам качественного и количественного состава микрофлоры в исследуемых группах выявили единичное и умеренное содержание патогенного β-гемолитического стрептококка, условно-патогенных микроорганизмов и отсутствие анаэробов. Заключение. Микробиологическое исследование подтвердило эффективность бактерицидного действия инфракрасного лазерного излучения при лечении глубокого кариеса.
1. Введение
По мнению современных авторов, после этапа препарирования кариозных дефектов отмечается единичное или умеренное наличие патогенных бактерий, единичное присутствие условно-патогенных микроорганизмов и отсутствие представителей анаэробов , . Этиология кариеса предполагает наличие патогенного β-гемолитического стрептококка в сформированных полостях путем их препарирования, а в условиях работы без абсолютной изоляции преобладает умеренное количество патогенных бактерий, что обусловлено их попаданием с ротовым дыханием и из инфицированной ротовой жидкости. Одновременное выявление патогенных и условно-патогенных микроорганизмов говорит об их возможности объединяться и образовывать микробные ассоциации, что способствует повышению их вирулентности , .
Стандартным этапом лечения глубокого кариеса в соответствии с протоколом, рекомендованным Стоматологической Ассоциацией России (СтАР), является наложение лечебной прокладки на основе гидроокиси кальция . Благодаря высокому уровню pH, основными свойствами лечебных прокладок являются обеззараживание инфицированного слоя дентина, стимуляция образования заместительного дентина путем запечатывания дентинных трубочек при применении метода непрямого покрытия пульпы. Однако выделяют ряд отрицательных свойств, а именно: высокий pH вызывает некроз пульпы, лечебные прокладки со временем растворяются, отсутствует адгезия к дентину, что образует условия для дальнейшего инфицирования. Поэтому, если при неосторожном нанесении лечебного материала он остался на стенках отпрепарированной полости, риск адгезии микроорганизмов становится выше, что способствует образованию рецидивирующего кариеса .
Несмотря на существующее многообразие методов лечения глубокого кариеса, сохраняется высокий процент возникновения рецидива кариеса под пломбой, нередко приводящий к его осложнению, что связано с затруднениями во время диагностики, некорректно составленным планом лечения и ошибками на его этапах, обусловливающими повторное инфицирование тканей зубов .
Ряд авторов считают использование диодного лазера эффективным при лечении глубокого кариеса за счет обезболивающего, противовоспалительного и противоотечного действия на пульпу излучением красного спектра и противокариозным и бактерицидным – лазером инфракрасного (ИК) , , . ИК низкоинтенсивное лазерное излучение (НИЛИ) на пульпу зуба стимулирует лимфо- и гемомикроциркуляцию, что активирует секрецию эмалевой и дентинной жидкостей и приводит к ускорению метаболизма твердых тканей зубов и к образованию заместительного дентина . Таким образом, происходит стимуляция местных факторов иммунной защиты, поэтому резистентность тканей зубов к воздействию патогенных микроорганизмов повышается и осложнения кариеса практически минимальны , .
Цель исследования – оценить микробную обсемененность глубоких кариозных полостей при использовании алгоритма лечения с применением низкоинтенсивного лазерного излучения.
2. Материалы и методы
Рисунок 1 - Измерение толщины надпульпарного дентина аппаратом EndoEst 3D (Geosoft)
Для оценки микробной обсемененности и определения бактерицидных свойств ИК лазерного излучения было проведено микробиологическое исследование материала со дна полостей после препарирования и антисептической обработки сформированной полости и после применения красного лазера в основной группе и группе сравнения, после ИК лазера – только в основной группе.
Забор материала со дна сформированных полостей производили при помощи тампона. Полученный материал ресуспендировали в 1 мл физиологического раствора. Далее 10 мкл полученной взвеси засевали на чашки с кровяным агаром, шоколадным агаром, лактобакагаром (ФБУН ГНЦ ПМБ) и растирали шпателем Дригальского по всей поверхности чашки. Посевы на кровяном агаре также культивировали в анаэробных условиях, для создания которых использовали анаэростат AnaeroJar™ 2.5L (Thermo Scientific, Oxoid, США) и газ-пакеты AnaeroGen™ 2.5L (Oxoid). Контроль анаэробных условий проводили при помощи Anaerobic indicator (Oxoid).
После 24 часов инкубации оценивали количество выросших колоний и проводили оценку культуральных и морфологических свойств. Идентификацию бактерий проводили при помощи оценки их сахаро- и протеолитических свойств.
3. Результаты и обсуждения
На основании основных и дополнительных методов исследования в исследуемых группах был поставлен диагноз глубокий кариес. Так, на этапе препарирования диагноз подтвердили результатами дентинометрии: в основной группе среднее значение толщины надпульпарного дентина составило 0,73±0,25 мм, а в группе сравнения – 0,84±0,24 мм.
При изучении качественного и количественного состава микрофлоры в основной группе и в группе сравнения выяснили, что все кариозные полости содержали патогенный β-гемолитический стрептококк. В основной группе и в группе сравнения зарегистрировали единичное содержание β-гемолитического стрептококка на дне антисептически обработанных полостей после препарирования и после воздействия красным лазерным излучением в 72,0±20,0% случаев, и умеренное в 28,0±10,0% (см. табл. 1).
Таблица 1 - Распространенность микрофлоры кариозных полостей после препарирования и после воздействия красным и ИК лазерным излучением в основной и группе сравнения
Микрофлора | Степень обсемененности (КОЕ/ тампон) | Основная группа, % (M±m) | Группа сравнения, % (M±m) | |||
после препарирования и антисептической обработки | после применения красного лазера | после ИК лазера | после препарирования и антисептической обработки | после красного лазера | ||
Стрептококк β-гемолитический | единично | 72,0±20,0 | 72,0±20,0 | 80,0±20,0 | 72,0±20,0 | 72,0±20,0 |
умеренно | 28,0±10,0 | 28,0±10,0 | 20,0±10,0 | 28,0±10,0 | 28,0±10,0 | |
Лактобактерии | единично | 20,0±10,0 | 20,0±10,0 | 20,0±10,0 | 20,0±10,0 | 20,0±10,0 |
умеренно | 12,0±10,0 | 12,0±10,0 | 12,0±10,0 | 12,0±10,0 | 12,0±10,0 | |
Нейссерии | единично | 12,0±10,0 | 12,0±10,0 | 12,0±10,0 | 12,0±10,0 | 12,0±10,0 |
Анаэробы | единично | 0 | 0 | 0 | 0 | 0 |
После применения ИК лазера в область сформированных полостей основной группы процент патогенного β-гемолитического стрептококка единичной флоры вырос до 80,0±20,0%, умеренной стал ниже – 20,0±10,0%. Условно-патогенные нейссерии и лактобактерии высеивались единично в 20,0±10,0% и 12,0±10,0% случаев соответственно в исследуемых группах. Анаэробы в исследуемых образцах не определялись (см. табл. 1).
В основной группе (25,98±2,00 КОЕ/тампон) и в группе сравнения (25,11±2,00 КОЕ/тампон) высеивался β-гемолитический стрептококк после препарирования и воздействия красным лазером, а после применения ИК в основной группе снизилось количество патогенного β-гемолитического стрептококка на 9% (до 23,74±2,00 КОЕ/тампон). В условиях абсолютной изоляции условно-патогенные микроорганизмы в основной группе (лактобактерии 1,68±1,30 КОЕ/тампон, нейссерии 1,38±1,30 КОЕ/тампон), как и в группе сравнения (лактобактерии 1,59±1,30 КОЕ/тампон, нейссерии 1,34±1,30 КОЕ/тампон) были обнаружены в одинаковом количестве до и после воздействия лазерным излучением низкой интенсивности (см. рис.2).
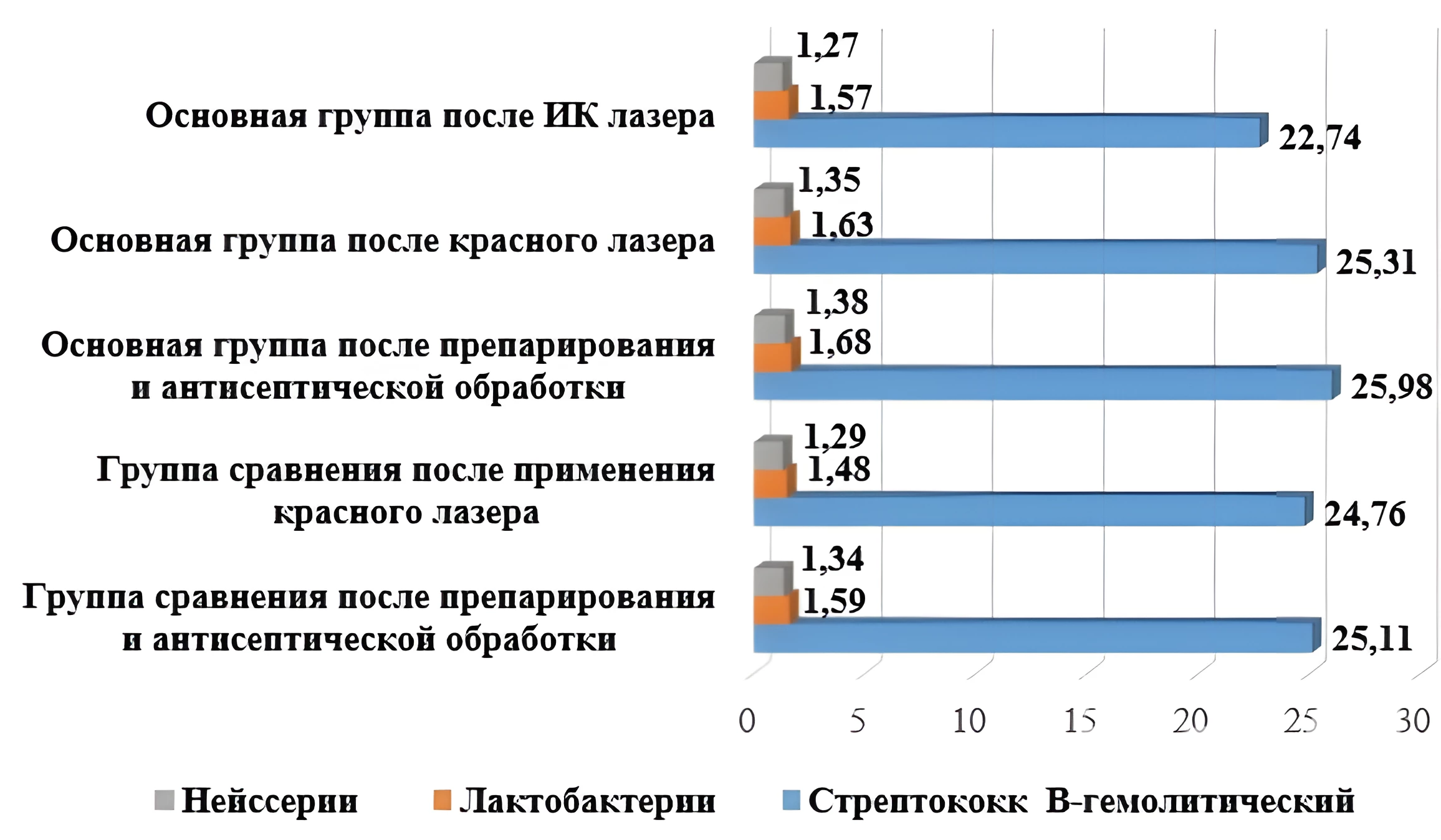
Рисунок 2 - Микробный состав в основной группе и в группе сравнения
4. Заключение
В целом результаты микробиологического исследования показали, что после препарирования глубоких полостей и воздействия на них красным лазером низкой интенсивности в исследуемых группах отмечали присутствие умеренной и преимущественно единичной патогенной и условно-патогенной микрофлоры, при этом анаэробные микроорганизмы не высеивались. В основной группе после ИК лазерного излучения в области сформированных полостей зафиксировали снижение количества патогенного β-гемолитического стрептококка до 9%, что подтверждает бактерицидное действие ИК лазера.
