ВЛИЯНИЕ ВЫСОКОКАЛОРИЙНОЙ ДИЕТЫ НА МОРФОФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ПЕЧЕНИ И УРОВЕНЬ СТЕАРИЛ-КОЭНЗИМ-А-ДЕСАТУРАЗЫ В ЭКСПЕРИМЕНТЕ
ВЛИЯНИЕ ВЫСОКОКАЛОРИЙНОЙ ДИЕТЫ НА МОРФОФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ПЕЧЕНИ И УРОВЕНЬ СТЕАРИЛ-КОЭНЗИМ-А-ДЕСАТУРАЗЫ В ЭКСПЕРИМЕНТЕ
Аннотация
Целью данного исследования явилось изучение влияния высококалорийной диеты на морфофункциональное состояние печени и уровень стеарил-коэнзим-А-десатуразы у крыс линии Wistar. Для проведения эксперимента было отобрано 30 крыс-самцов, из которых были сформированы две группы: контрольная (n=15) и опытная (n=15). Животные контрольной группы получали основной рацион, а животные опытной группы – высококалорийную диету. Высококалорийная диета на протяжении 12 недель приводила к увеличению массы тела, нарушению углеводного и липидного обменов, а также развитию мелкокапельной жировой дистрофии печени у лабораторных животных опытной группы. Отмечалось достоверное увеличение уровня стеарил-коэнзим-А-десатуразы в печени опытной группы относительно контроля на 19,3%.
1. Введение
Исследования последних лет показывают, что во всем мире уже более 1,9 миллиарда взрослых людей имеют избыточный вес, 650 миллионов страдают ожирением , . По данным Международной федерации диабета установлено, что 451 миллион человек страдают сахарным диабетом 2 типа и ожидается, что к 2045 году эти цифры увеличатся до 693 миллионов. Насчитывается 374 миллиона человек с нарушением толерантности к глюкозе, у 21,3 миллиона женщин развивалась гипергликемия во время беременности . Одной из ключевых детерминант развития данных патологий является так называемый «западный тип питания», который характеризуется потреблением большого количества калорий . По данным J. Speakman, питание современного человека характеризуются беспрецедентно высоким уровнем потребления высококалорийной пищи .
При изучении механизмов возникновения ожирения и сахарного диабета 2 типа в последнее время исследователями акцентируется внимание на роли фермента стеарил-коэнзим-А-десатуразы (SCD, EC 1.14.19.1), являющегося ключевым в биосинтезе мононенасыщенных жирных кислот в большинстве тканей человека и грызунов, особенно в печени . Учитывая многочисленные роли данных жирных кислот, можно ожидать, что вариации уровня и активности SCD будут влиять на ряд ключевых физиологических процессов связанных с углеводным и липидным обменами. По данным ряда авторов SCD-1 представляет собой терапевтическую мишень для контроля ожирения и прогрессирования сопутствующих метаболических заболеваний , . В связи с этим целью данного исследования явилось изучение влияния высококалорийной диеты на морфофункциональное состояние печени и уровень SCD у крыс линии Wistar.
2. Методы и принципы исследования
Настоящее исследование выполнено на базе экспериментально-биологической клиники (вивария) ФГБНУ «Федеральный научный центр биологических систем и агротехнологий РАН». Эксперимент выполнен на крысах линии Wistar в соответствии с протоколами Женевской конвенции и принципами надлежащей лабораторной практики (Национальный стандарт Российской Федерации ГОСТ 33044–2014 «Принципы надлежащей лабораторной практики»). Для проведения эксперимента было отобрано 30 крыс-самцов в возрасте 5 месяцев с исходной массой тела 170-180 г, из которых были сформированы две группы: контрольная (n=15) и опытная (n=15). Животные контрольной группы получали основной рацион калорийностью 270 ккал/100 г (полнорационный корм, соответствующий ГОСТ-Р 50258-92), а животные опытной группы – высококалорийную диету. Сочетание большого количества углеводов и жиров разного происхождения более точно имитирует диету человека, в связи с этим высококалорийная диета основана на добавлении к основному рациону свиного сала, кокосового и подсолнечного масел, в качестве питья использовали 10% раствор фруктозы , . В ходе эксперимента калорийность диеты ступенчато увеличивалась на 30% (1-4 недели), 60% (5-8 недели) и 90% (9-12 недели) от калорийности основного рациона. Ступенчатую диету использовали с целью снижения стрессовой реакции организма при увеличении калорийности питания. По окончании 12 недель животные выводились из эксперимента для забора биоматериала. В рамках выполнения эксперимента проводилась регистрация морфометрических параметров (масса тела, масса печени, массовый коэффициент печени). Контрольные определения уровня глюкозы крови, общего холестерина, липопротеидов высокой плотности (ЛПВП) и триглицеридов определяли с помощью биохимического экспресс-анализатора CardioChek (Polymer Technology System, США). На основании данных общего холестерина и ЛПВП рассчитывался коэффициент атерогенности. Пероральный глюкозотолерантный тест проводился путем внутрижелудочного введения 40% раствора глюкозы в дозе 2 г/кг и оценке уровня глюкозы через 30, 60, 90 и 120 минут . Для гистологического анализа после извлечения образцы ткани печени немедленно помещали в 10% забуференный формалин. Исследуемый материал фиксировали в течение суток в растворе молекулярного фиксатора, затем вырезали фрагменты печени и подвергали автоматической гистологической проводке, после чего изготавливались парафиновые блоки, с которых делали серийные срезы на ротационном микротоме Sakura Accu-Cut SRM200 (Япония). Нанесенные на предметное стекло срезы депарафинировали в ксилоле, обезвоживали в спиртах и окрашивали гематоксилином Майера и эозином по стандартному протоколу. Содержание SCD оценивалось в сыворотке крови и печени лабораторных животных методом иммуноферментного анализа с использованием коммерческого набора ELISA Kit for Stearoyl Coenzyme A Desaturase для количественного определения SCD в плазме/сыворотке крови, гомогенатах тканей и других биологических жидкостях крыс, этапы анализа соответствовали инструкции к набору. Обработку полученных данных проводили при помощи методов вариационной статистики с применением статистического пакета STATISTICA 10 (StatSoft Inc., США). Гипотеза о принадлежности данных нормальному распределению была отклонена во всех случаях с вероятностью 95%, что обосновало применение непараметрического U-критерия Манна-Уитни.
3. Результаты и их обсуждение
Результаты исследований показали, что ступенчатое увеличение калорийности рациона на протяжении 12 недель приводит к увеличению массы тела и печени, нарушению углеводного и липидного обменов (табл. 1).
Таблица 1 - Влияние высококалорийной диеты на морфометрические и биохимические показатели
Показатели | Контрольная группа | Опытная группа | |
Масса тела, г | 251,5 (248,7-255) | 363 (360,5-370,7)** | |
Масса печени, г | 5,9 (5,84-5,95) | 10,9 (10,00-12,53)** | |
Массовый коэффициент печени, % | 2,38 (2,29-2,42) | 3,07 (2,66-3,46)* | |
Глюкоза натощак, ммоль/л | 4,95 (4,83-5,15) | 7,55 (7,43-7,68)** | |
ПГТТ | 30 мин. | 7,17 (7,1-7,35) | 9,15 (8,95-9,28)** |
60 мин. | 6,45 (6,3-6,75) | 9,4 (9,23-9,5)** | |
90 мин. | 5,65 (5,6-5,7) | 8,45 (8,33-8,73)** | |
120 мин. | 5,16 (5,12-5,22) | 7,95 (7,75-8,08)** | |
Холестерин, ммоль/л | 1,6 (1,56-1,64) | 2,25 (2,13-2,45)** | |
ЛПВП, ммоль/л | 0,98 (0,97-0,99) | 0,72 (0,69-0,74)** | |
Триглицериды, ммоль/л | 0,59 (0,48-0,69) | 1,34 (1,28-1,4)** | |
КА, % | 0,64 (0,61-0,71) | 2,17 (1,97-2,35)** | |
Примечание: Me (Q25-Q75); *, ** – достоверная разница между опытной группой и контролем при p ≤ 0,05 и p ≤ 0,01; ПГТТ – пероральный глюкозотолерантный тест; КА – коэффициент атерогенности
В опытной группе наряду с избыточной массой тела отмечалось увеличение массы печени на 84,7% и её массового коэффициента на 29%. По результатам биохимического анализа крови к концу исследования было установлено статистически значимое увеличение уровня глюкозы на 52,5%, общего холестерина на 40,6%, триглицеридов на 127%, коэффициент атерогенности на 239% и снижение уровня ЛПВП на 26,5%. Наблюдаемые атерогенные сдвиги в липидном профиле происходили на фоне снижения ЛПВП и повышения уровня холестерина и триглицеридов, что привело к увеличению коэффициент атерогенности, отражающего риск развития поражения сосудов. Результаты перорального глюкозотолерантного теста к 12 недели эксперимента показали существенные различия между опытной и контрольной группами. Уровень глюкозы после нагрузки в контрольной группе стал снижаться после 30 минуты и к 120 минуте возвращался к практически исходным значениям; в то время как в опытной группе снижение начиналось только после 60 минуты, что может свидетельствовать о нарушениях углеводного обмена. Нарушение толерантности к глюкозе является предиктором сахарного диабета 2 типа и служит фактором риска развития сердечно-сосудистых заболеваний . Полученные данные могут свидетельствовать о развивающейся на фоне избыточного веса инсулинорезистентности, которая, в свою очередь, будет усугублять накопление и задержку жира в организме.
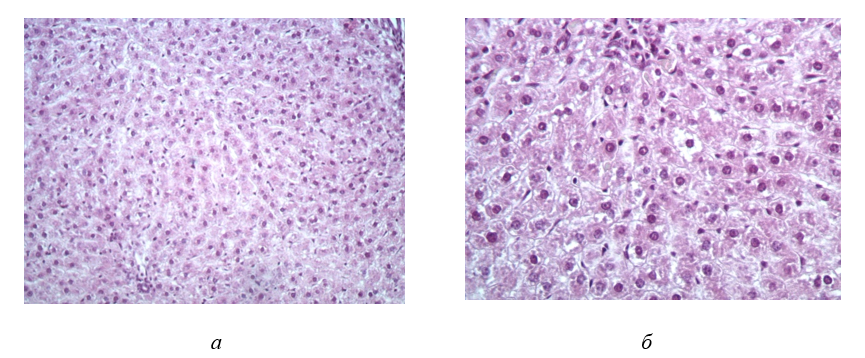
Рисунок 1 - Фрагмент ткани печени крысы контрольной группы:
а – Ув. об. 20; ок. 10; б – Ув. об. 40; ок 10
Примечание: фиксация – 10% раствор нейтрального формалина, окраска – гематоксилин Майера и эозин
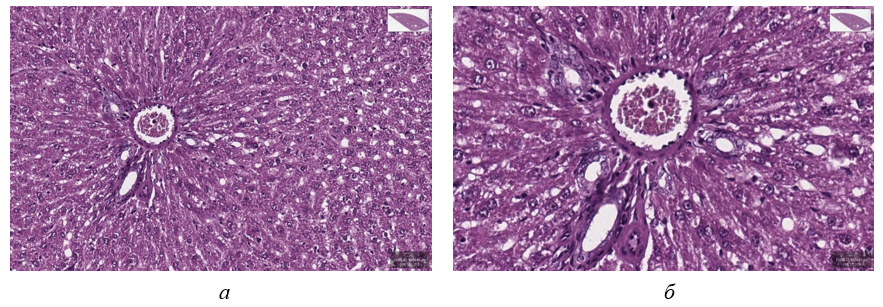
Рисунок 2 - Фрагмент ткани печени крысы опытной группы:
а – Ув. об. 20; ок. 10; б – Ув. об. 40; ок. 10
Примечание: фиксация – 10% раствор нейтрального формалина, окраска – гематоксилин Майера и эозин
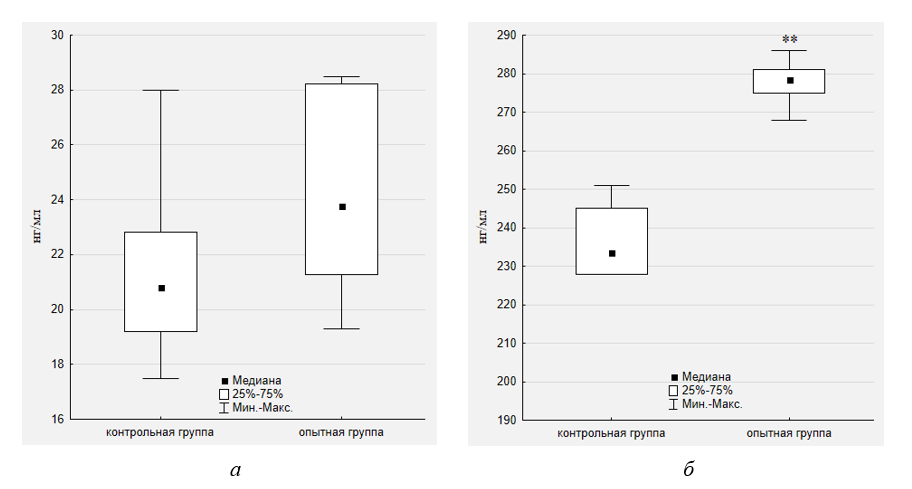
Рисунок 3 - Влияние высококалорийной диеты на концентрацию SCD-1 в сыворотке крови (а) и печени (б) лабораторных животных
Примечание: ** – достоверная разница между опытной группой и контролем при p ≤ 0,01
Известно, что при жировой дистрофии печени жирные кислоты накапливаются в гепатоцитах, что по мнению многих исследователей, обусловлено нарушением окислительных процессов . Ряд экспериментальных исследований показывают, что изменение внутриклеточного метаболизма липидов в печени при жировой дистрофии сопровождается нарушением функционально-структурной целостности клеточных мембран из-за нарушения текучести мембран и изменения их проницаемости . Наблюдаемые в нашем исследовании изменения в виде развития мелкокапельной жировой дистрофии у животных опытной группы закономерны на фоне увеличения массового коэффициента печени и увеличения уровня SCD.
В настоящее время у приматов и человека выделено две изоформы фермента (SCD-1 и SCD-5), а у грызунов – четыре (SCD-1-4). Изоформа SCD-1 грызунов является ортологом SCD-1 человека, которые на 85% гомологичны , . SCD представляет собой микросомальный фермент, локализованный в эндоплазматическом ретикулуме. Реакции, контролируемые данными ферментами, называются реакциями десатурации, они катализируют стадию ограничения скорости биосинтеза ненасыщенных жирных кислот в клетках человека и животных путем введения цис-двойной связи в Δ9-положении. В результате реакции десатурации стеариновой (C18:0) и пальмитиновой (С16:0) насыщенных жирных кислот образуются олеиновая (C18:1n-9) и пальмитолеиновая (C16:1n-7) кислоты, которые являются основными мононенасыщенными жирными кислотами в жировых депо и мембранных фосфолипидах. Работа SCD важна для поддержания нормальных физиологических процессов . Полученные нами данные демонстрируют, что уровень SCD чувствителен к изменениям в питании. Большинство метаболических изменений, связанных с нарушениями углеводного и липидного обменов ассоциируют с соотношением мононенасыщенных жирных кислот к насыщенным жирным кислотам . Данное соотношение контролирует структурную целостность и текучесть мембран клеток, тем самым влияя на широкий спектр физиологических функций. Достоверное увеличение уровня печеночной SCD в опытной группе может быть косвенным свидетельством нарушения соотношения мононенасыщенных жирных кислот к насыщенным жирным кислотам в печени, а также нарушения проницаемости мембран клеток. Согласно результатам исследований ряда авторов, доказана роль SCD при патогенезе многочисленных патологических состояний, включая ожирение, сахарный диабет 2 типа и сердечно-сосудистые заболевания , .
Таким образом, поддержание адекватного уровня мононенасышенных жирных кислот, посредством регуляции уровня SCD является основополагающим фактором для сохранения состояния здоровья организма.
4. Заключение
1. Представленный рацион позволяет моделировать нарушения метаболизма и доказывают эффективность его дальнейшего использования в исследованиях по изучению нарушений углеводного и липидного обменов на лабораторных животных.
2. Полученные данные демонстрируют, что концентрация SCD чувствительна к изменениям в питании. Длительная высококалорийная диета приводит к достоверному увеличению уровня SCD-1 в печени на 19,3%.
