ИЗУЧЕНИЕ СТРУКТУРНО-ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ МИКРОЦИРКУЛЯТОРНОГО РУСЛА, ВЗАИМОСВЯЗЬ С ПОКАЗАТЕЛЯМИ АКТИВНОСТИ У ПАЦИЕНТОВ С МНОЖЕСТВЕННОЙ МИЕЛОМОЙ ДО НАЧАЛА ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ
ИЗУЧЕНИЕ СТРУКТУРНО-ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ МИКРОЦИРКУЛЯТОРНОГО РУСЛА, ВЗАИМОСВЯЗЬ С ПОКАЗАТЕЛЯМИ АКТИВНОСТИ У ПАЦИЕНТОВ С МНОЖЕСТВЕННОЙ МИЕЛОМОЙ ДО НАЧАЛА ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ
Аннотация
Цель – изучить структурно-функциональные показатели микроциркуляторного русла (МЦР) у пациентов с впервые диагностированной множественной миеломой (ММ) до начала специфической химиотерапии (ХТ) и оценить возможное влияние парапротеинемического гемобластоза на изменения микроциркуляции.
Материал и методы. В исследование включено 15 пациентов с впервые установленным диагнозом ММ, которым было запланировано проведение ХТ. Всем больным проведены стандартные общетерапевтические (общеклинический и биохимический анализы крови, коагулограмма, 12-канальная электрокардиография, ультразвуковое исследование органов брюшной полости и почек, рентгенография органов грудной клетки, костей черепа и таза) и гематологические (электрофорез сывороточных белков, миелограмма, иммунохимический анализ белков сыворотки крови и мочи, определение концентрации β2-микроглобулина) исследования, а также дополнительно проведена компьютерная видеокапилляроскопия (КВК) околоногтевого ложа в покое и с функциональными пробами (реактивная гиперемия, венозная окклюзия).
Результаты. Средний возраст пациентов составил 58±12 (95% ДИ 50-66), по половому составу превалировали женщины (66,7%, n = 10). По результатам КВК у исследуемой когорты пациентов присутствовали структурные изменения МЦР в виде снижения плотности капиллярной сети (ПКС) в пробе с венозной окклюзией до 68,75±20,21 кап/мм2 (95% ДИ 55,91-81,59) (N от 87 кап/мм2). Также отмечались функциональные нарушения: уменьшение процента капиллярного восстановления до 11,92±9,31% (95% ДИ 6,01-17,84) (N 16,5±7,1%). В ходе корреляционного анализа были выявлены отрицательные обратные умеренные взаимосвязи уровня β2-микроглобулина с ПКСп (r = -0,460; p = 0,133) и ПКСрг (r = -0,480; p = 0,114), а также статистически значимая заметная зависимость схожей направленности – с ПКСво (r = -0,575; p = 0,05).
Заключение. В ходе данного исследования впервые проанализировано состояние МЦР у пациентов с ММ и изучена взаимосвязь основных показателей КВК с показателями активности основного заболевания. Определено наличие структурно-функциональных изменений сосудов в исследуемой когорте больных до начала ХТ, что может рассматриваться как один из факторов, повышающий кардиоонкологический риск пациентов с ММ, и подтверждает необходимость тщательного мониторинга, профилактики васкулотоксических осложнений ХТ в данной группе больных.
1. Введение
Развитие современной науки стремительно способствует решению глобальных вопросов в онкологии. Так, последние два десятилетия были ознаменованы впечатляющими успехами в лечении ряда злокачественных новообразований, что сделало реальным достижение стойкой ремиссии у значительного числа пациентов, а в некоторых случаях позволило обсуждать вопрос о потенциальном излечении от онкопатологии. В свете данных событий, внимание ученых и клиницистов в последнее время все больше привлекает проблема отдаленных последствий противоопухолевой терапии и качества жизни пациентов. Среди этих осложнений поражение сердечно-сосудистой системы (ССС) встречается наиболее часто и может приводить к летальным исходам даже спустя годы после успешного завершения лечения , . Потребность в создании отдельного мультидисциплинарного направления в медицине привела к формированию на стыке этих двух специальностей кардиоонкологии.
В первых Клинических рекомендациях по кардиоонкологии Европейского общества кардиологов (2022 г.) были подробно объяснены определения и основные проявления токсичности, связанной с лечением злокачественных новообразований, как со стороны сердца, так и сосудистого русла, в том числе на уровне микроциркуляции . Однако, если для кардиотоксических осложнений противоопухолевого лечения в арсенале кардиологов и кардиоонкологов есть целый спектр лабораторно-инструментальных методов диагностики, то для мониторинга васкулотоксичности доказанных маркеров на сегодняшний день нет, а инструментальные исследования не получили широкого распространения. С учетом высокой частоты встречаемости представляется перспективным поиск и внедрение в клиническую практику новых диагностических методик и исследование их связи с показателями активности основного заболевания с целью прогнозирования возникновения и предотвращения последствий васкулотоксичности химиотерапии (ХТ).
Множественная миелома (ММ) – второе по частоте заболеваемости злокачественное заболевание крови и кроветворных органов; встречается преимущественно у лиц старше 65 лет , . ММ относится к группе плазмоклеточных неоплазий и характеризуется сложностью патогенеза. Подвергшиеся различным генетическим аберрациям клональные плазмоциты секретируют патологические иммуноглобулины или их отдельные цепи, что приводит к поражению почек (cast-нефропатии), гипервискозному синдрому, электролитным нарушениям, в том числе гиперкальциемии. К клиническим проявлениям ММ также относится анемия, вызванная инфильтрацией костного мозга опухолевыми плазматическими клетками, и извращенный иммунный ответ, обусловленный секрецией как непосредственно самими плазмоцитами, так и клетками микроокружения, провоспалительных цитокинов (IL-6, TNFα, VEGF, cNF-κB и др.) . Все указанные особенности данного заболевания косвенно или напрямую влияют на состояние ССС у пациентов с ММ. Принимая во внимание кардиоваскулотоксичность препаратов, входящих в протоколы терапии ММ, а также исходный отягощенный сердечно-сосудистый статус больных, у которых заболевание дебютирует чаще в пожилом возрасте, становится очевидным, что данная когорта пациентов подвержена высокому кардиоонкологическому риску. Таким образом, ранняя профилактика и своевременная диагностика связанных с лечением сердечно-сосудистых осложнений (ССО) представляются крайне актуальными.
Цель – изучить структурно-функциональные показатели микроциркуляторного русла (МЦР) у пациентов с впервые диагностированной ММ до начала специфической ХТ и оценить возможное влияние парапротеинемического гемобластоза на изменения микроциркуляции.
2. Материал и методы
В пилотное, поперечное, одноцентровое, нерандомизированное исследование было включено 15 пациентов с впервые установленным диагнозом ММ. При инициации исследования были определены следующие критерии включения: впервые установленный диагноз ММ, отсутствие показаний к проведению трансплантации аутологичных гемопоэтических стволовых клеток крови (возраст пациентов старше 65 лет, либо моложе 65 лет при наличии соматического статуса ECOG >2 баллов), наличие показаний к проведению химиотерапевтического лечения. Основными критериями невключения были: морфологически верифицированный амилоидоз и/или критерии, позволяющие предполагать его наличие (согласно Согласительному документу Европейского общества кардиологов по диагностике и лечению амилоидоза сердца 2021 года ), наличие в анамнезе другого онкологического заболевания, химио- и/или лучевой терапии, как по поводу другой злокачественной нозологии, так и по поводу ММ, возможность проведения трансплантации аутологичных гемопоэтических стволовых клеток крови (возраст <65 лет), перенесенные в течении 3-х месяцев до начала исследования острые коронарные события, острое нарушение мозгового кровообращения, а также наличие декомпенсации любых хронических неинфекционных заболеваний, в том числе тяжелое нарушение функции печени (превышение уровня печеночных ферментов более чем в 3 нормы при верхних границах нормальных значений АЛТ 50 и 35 Ед/л для мужчин и женщин соответственно, АСТ – 37 и 31 Ед/л для мужчин и женщин соответственно), почек (СКФ <40 мл/мин/1,73м2 при расчете по CKD-EPI). Набор пациентов осуществлялся в гематологическом отделении на базе Университетской клинической больницы №1 Сеченовского Университета. Верификация диагноза ММ производилась на основании критериев утвержденных Минздравом РФ «Клинических рекомендаций по диагностике и лечению множественной миеломы» 2020 года , согласующихся с современными рекомендациями Европейского общества гематологов (European Hematology Association, EHA) и Национальной Всеобщей Онкологической Сети (National Comprehensive Cancer Network, NCCN) . С целью стадирования онкогематологического процесса были использованы Международная система стадирования (International Staging System, ISS) и классификация B. Durie/S. Salmon. Всеми включенными в исследование пациентами было подписано информированное добровольное согласие, представленное исследование было одобрено Локальным этическим комитетом Сеченовского Университета и проведено в соответствии с принципами Хельсинской декларации.
На момент верификации онкогематологической патологии, помимо стандартных общетерапевтических (общеклинический, биохимический анализы крови, коагулограмма, 12-канальная электрокардиография, ультразвуковое исследование органов брюшной полости и почек, рентгенография органов грудной клетки, костей черепа и таза) и гематологических (электрофорез сывороточных белков, миелограмма, иммунохимический анализ белков сыворотки крови и мочи, определение концентрации β2-микроглобулина) методов исследования, необходимых для установки диагноза ММ, была также проведена компьютерная видеокапилляроскопия (КВК) околоногтевого ложа в покое и с функциональными пробами (реактивная гиперемия, венозная окклюзия) с целью неинвазивной оценки исходного состояния микроциркуляторного русла в описанной когорте пациентов. Также дополнительно были оценены основные факторы риска (ФР) сердечно-сосудистых заболеваний (ССЗ) (наличие артериальной гипертензии (АГ), сахарного диабета (СД) 2 типа, дислипидемии, отягощенного по заболеваниям ССС семейного анамнеза, избыточной массы тела на основании подсчета индекса массы тела, курения), наличие установленной кардиоваскулярной патологии и объем терапии, применяемой для ее лечения.
На основании отобранной информации была сформирована база данных при помощи пакета Microsoft Office 2017. Статистическая обработка собранных данных была произведена с помощью SPSS Statistics v.23 (IBM, США) и проверена с использованием программы StatTech v.3.1.8 (ООО «Статтех», Россия). Полученные результаты были представлены в виде категориальных и количественных показателей: категориальные представлены с указанием процента распределения признака в выборке и в виде абсолютного значения; для определения типа распределения количественных показателей выборки, с учетом ее размера (менее 50 исследуемых), использовался критерий Шапиро-Уилка, а также метод «колокольной кривой» (метод Гаусса). При подтверждении нормального распределения признака, полученные результаты описывались посредством средних арифметических величин (М) и стандартного отклонения (SD), границ 95% доверительного интервала (95% ДИ). При выявлении ненормального распределения, данные представлялись в виде медианы (Ме) и интерквартильного размаха (Q1–Q3). Для оценки внутригрупповых различий количественных переменных был использован метод Краскела-Уоллиса с апостериорным сравнением с поправкой Холма. Корреляционный анализ количественных показателей проводился с использованием коэффициента корреляции Пирсона (при нормальном распределении) и коэффициента ранговой корреляции Спирмена (в случае ненормального распределения данных). Корреляционная связь считалась статистически значимой при р <0,05.
3. Результаты
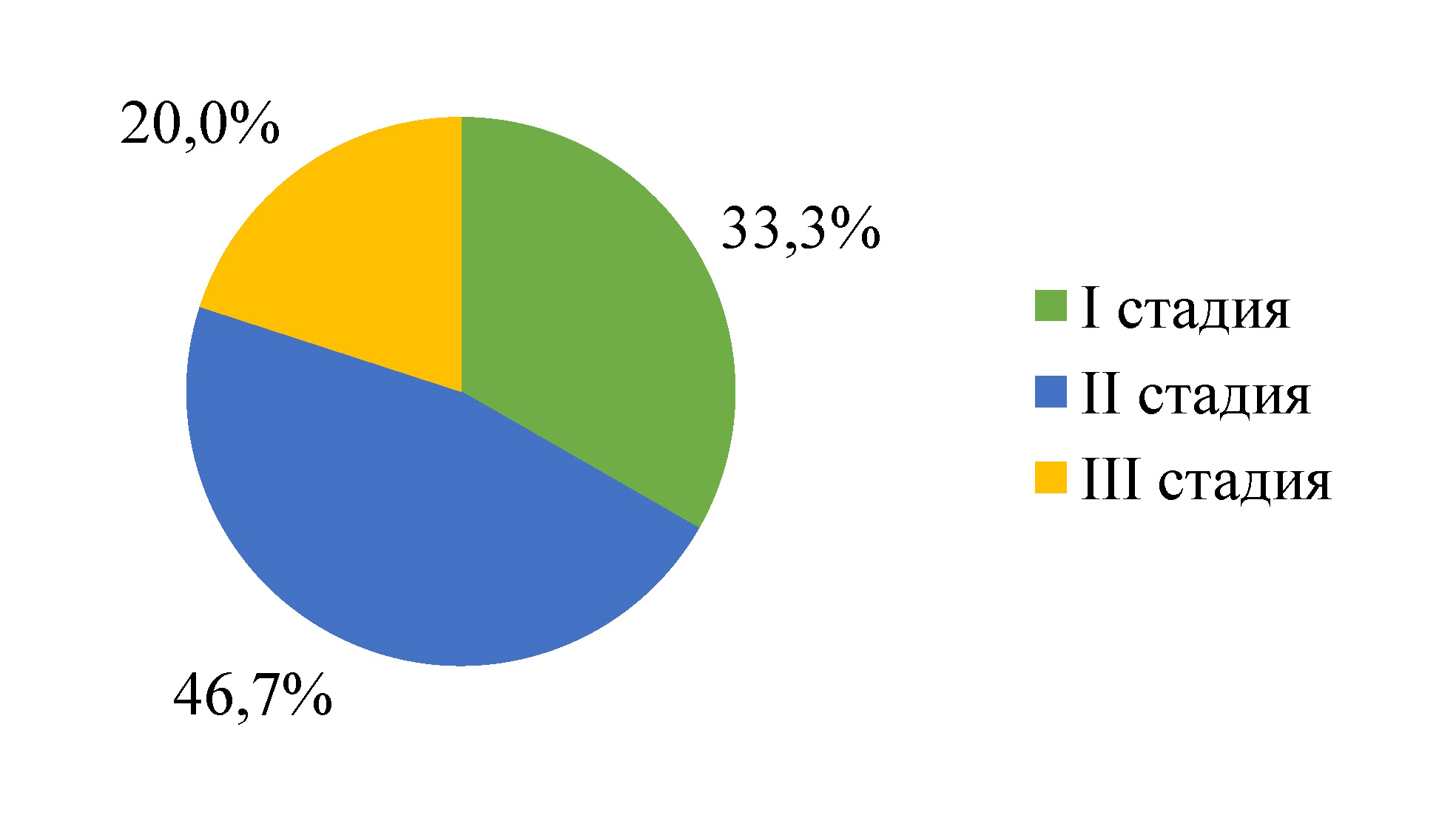
Рисунок 1 - Распределение выборки пациентов с ММ в зависимости от стадии заболевания согласно системе стадирования ISS
Таблица 1 - Основные лабораторные показатели ММ у исследуемых пациентов
Показатель | M±SD / Me | 95% ДИ / Q1–Q3 |
Гемоглобин, г/л (N 115–160) | 110,9±10,5 | 102,1–119,6 |
Общий белок, г/л (N 57–82) | 101,9±27,9 | 85,1–118,8 |
М-градиент, г/л (N 0) | 41,5±25,2 | 26,2–56,7 |
СОЭ по Вестергрену, мм/ч (N 0–20) | 52±25 | 37–68 |
СРБ, мг/мл (N 0–5) | 1 | 1–6 |
ЛДГ, Ед/л (N 208–378) | 161 | 146–209 |
Креатинин, мкмоль/л (N 80–115) | 84,03±21,53 | 71,02–97,04 |
СКФ (CKD-EPI), мл/мин/1,73м2 (N 80–120) | 77,66±20,23 | 65,43–89,88 |
Кальций общий, ммоль/л (N 2,1–2,55) | 2,30±0,27 | 2,13–2,46 |
Калий, ммоль/л (N 3,5–5,1) | 4,5 | 3,8–4,9 |
Глюкоза, ммоль/л (N 3,3–5,5) | 5,7 | 4,8–6,1 |
Фибриноген, г/л (N 2–4) | 3,2±1,6 | 1,7–4,7 |
Плазматические клетки, % (N 0–1) | 24,27±14,79 | 15,33–33,20 |
β2-микроглобулин, мг/л (N 1,16–2,52) | 3,3±2,56 | 0,16–6,52 |
Примечание: данные представлены как среднее значение ± стандартное отклонение или как медиана [25-й процентиль; 75-й процентиль]. ЛДГ – лактатдегидрогеназа; СКФ – скорость клубочковой фильтрации; СОЭ – скорость оседания эритроцитов; СРБ – С-реактивный белок
Стоит отметить, что пациенты с высокой опухолевой нагрузкой, а, значит, с выраженными электролитными нарушениями и почечной дисфункцией не были включены в настоящее исследование.
В ходе оценки исходного сердечно-сосудистого статуса включенных в исследование пациентов было продемонстрировано, что у 6 пациентов (46,2%) в анамнезе имела место АГ, причем трое из них (23,1% из всей выборки) ранее перенесли инфаркт миокарда, по поводу чего им выполнялось чрескожное коронарное вмешательство. У этих же пациентов была диагностирована хроническая сердечная недостаточность (ХСН) с умеренно сниженной фракцией выброса левого желудочка. Анамнез остальных пациентов не был отягощен ишемической болезнью сердца и ХСН. Среди пациентов с АГ у троих имела место III стадия ММ по ISS, тогда как у второй половины – I стадия. Среди других ФР ССЗ также встречались отягощенный семейный анамнез, СД 2 типа, повышенный ИМТ, дислипидемия, курение (табл. 2).
Таблица 2 - Распространенность ФР ССЗ в исследуемой выборке пациентов с ММ
Факторы риска сердечно-сосудистых заболеваний | Пациенты | |
n | % | |
Отягощенный семейный анамнез | 11 | 73,3 |
Избыточная масса тела | 6 | 40,0 |
СД 2 типа | 5 | 33,3 |
Дислипидемия | 3 | 20,0 |
Курение | 1 | 6,7 |
Примечание: данные представлены как абсолютные и относительные значения. СД – сахарный диабет
При анализе получаемой кардиальной терапии продемонстрировано, что 33,3% (n = 5) пациентов принимали ингибиторы ангиотензинпревращающего фермента; 6,7% (n = 1) – ангиотензиновых рецепторов и неприлизина ингибитор; 26,7% (n = 4) – блокаторы медленных кальциевых каналов, тиазидные диуретики, β-адреноблокаторы, статины и антиагреганты. На этом фоне показатели артериального давления были скомпенсированы: медианы САД и ДАД составили 124 и 82 мм рт.ст. с интерквартильным размахом [109; 137] и [73; 89] для обоих показателей соответственно.
Для оценки морфофункционального состояния микроциркуляторного русла (МЦР) всем пациентам была проведена КВК околоногтевого ложа в условиях покоя и в пробах с реактивной гиперемией и венозной окклюзией. Проанализированы следующие основные показатели, отражающие структурное состояние МЦР:
- ПКСп – плотность капиллярной сети в условиях покоя (количество капилляров на единицу площади, кап/мм2);
- ПКСво – плотность капиллярной сети в пробе с венозной окклюзией (кап/мм2).
Также проведена оценка следующих функциональных показателей:
- ПКСрг – плотность капиллярной сети в пробе с реактивной гиперемией (кап/мм2);
- ПКВ – процент капиллярного восстановления, рассчитывается по формуле: ПКВ = (ПКСрг – ПКСп)/ПКСво × 100%;
- ППК – процент перфузируемых капилляров, формула для расчета: ППК = (ПКСрг/ПКСво) × 100%.
Результаты полученного исследования представлены в табл. 3. Следует отметить, что на данный момент нет стандарта норм для показателей КВК, поэтому нормальные значения основаны на результатах предыдущих работ, проведенных в этой области .
Таблица 3 - Результаты анализа основных показателей КВК у пациентов с ММ
Показатель | M±SD | 95% ДИ |
Структурное состояние | ||
ПКСп, кап/мм2 (N ~53) | 59,17±20,82 | 45,94–72,39 |
ПКСво, кап/мм2 (N ~87) | 68,75±20,21 | 55,91–81,59 |
Функциональное состояние | ||
ПКСрг, кап/мм2 (N ~59) | 66,83±21,91 | 52,91–80,76 |
ПКВ, % (N 16,5±7,1) | 11,92±9,31 | 6,01–17,84 |
ППК, % (N 92,5±5,3) | 95,82±14,44 | 86,65–104,99 |
Примечание: данные представлены как среднее значение ± стандартное отклонение. ПКВ – процент капиллярного восстановления; ПКСп – плотность капиллярной сети в условиях покоя; ПКСрг – плотность капиллярной сети в пробе с реактивной гиперемией; ПКСво – плотность капиллярной сети в пробе с венозной окклюзией; ППК – процент перфузируемых капилляров
В ходе анализа межгрупповых различий результатов КВК в зависимости от стадии заболевания по ISS были обнаружены зависимости как морфологических, так и функциональных параметров МЦР, при этом различие ПКСво оказалось статистически достоверным (табл. 4).
Таблица 4 - Внутригрупповые различия основных показателей КВК в зависимости от стадии ММ по системе ISS
Показатель | Стадия ISS | Статистическая значимость (р) | ||
I | II | III | ||
ПКСп, кап/мм2 (N ~53) | 66 [59–70] | 54 [50–61] | 33 [31–37] | 0,120* |
ПКСрг, кап/мм2 (N ~59) | 72 [71–89] | 61 [55–64] | 44 [44–48] | 0,067* |
ПКСво, кап/мм2 (N ~87) | 86 [76–93] | 57 [53–64] | 53 [53–55] | 0,016* pII-I = 0,025** pIII-I = 0,019** |
ПКВ, % (N 16,5±7,1) | 17 [6–19] | 11 [3–14] | 9 [9–10] | 0,358* |
ППК, % (N 92,5±5,3) | 95 [93–100] | 98 [93–108] | 83 [83–86] | 0,390* |
Примечание: данные представлены как медиана [25-й процентиль; 75-й процентиль]. p* – статистическая значимость оценена с применением критерия Фридмана; p** – статистическая значимость оценена с применением критерия Вилкоксона. ПКВ – процент капиллярного восстановления; ПКСп – плотность капиллярной сети в условиях покоя; ПКСрг – плотность капиллярной сети в пробе с реактивной гиперемией; ПКСво – плотность капиллярной сети в пробе с венозной окклюзией; ППК – процент перфузируемых капилляров
В ходе корреляционного анализа были выявлены отрицательные взаимосвязи уровня β2-микроглобулина с плотностью капиллярной сети, как в покое, так и при проведении функциональных проб: обратная умеренная взаимосвязь показана с ПКСп (r = -0,460; p = 0,133) и ПКСрг (r = -0,480; p = 0,114), а также статистически значимая заметная зависимость схожей направленности – с ПКСво (r = -0,575; p = 0,05) (рис. 2).
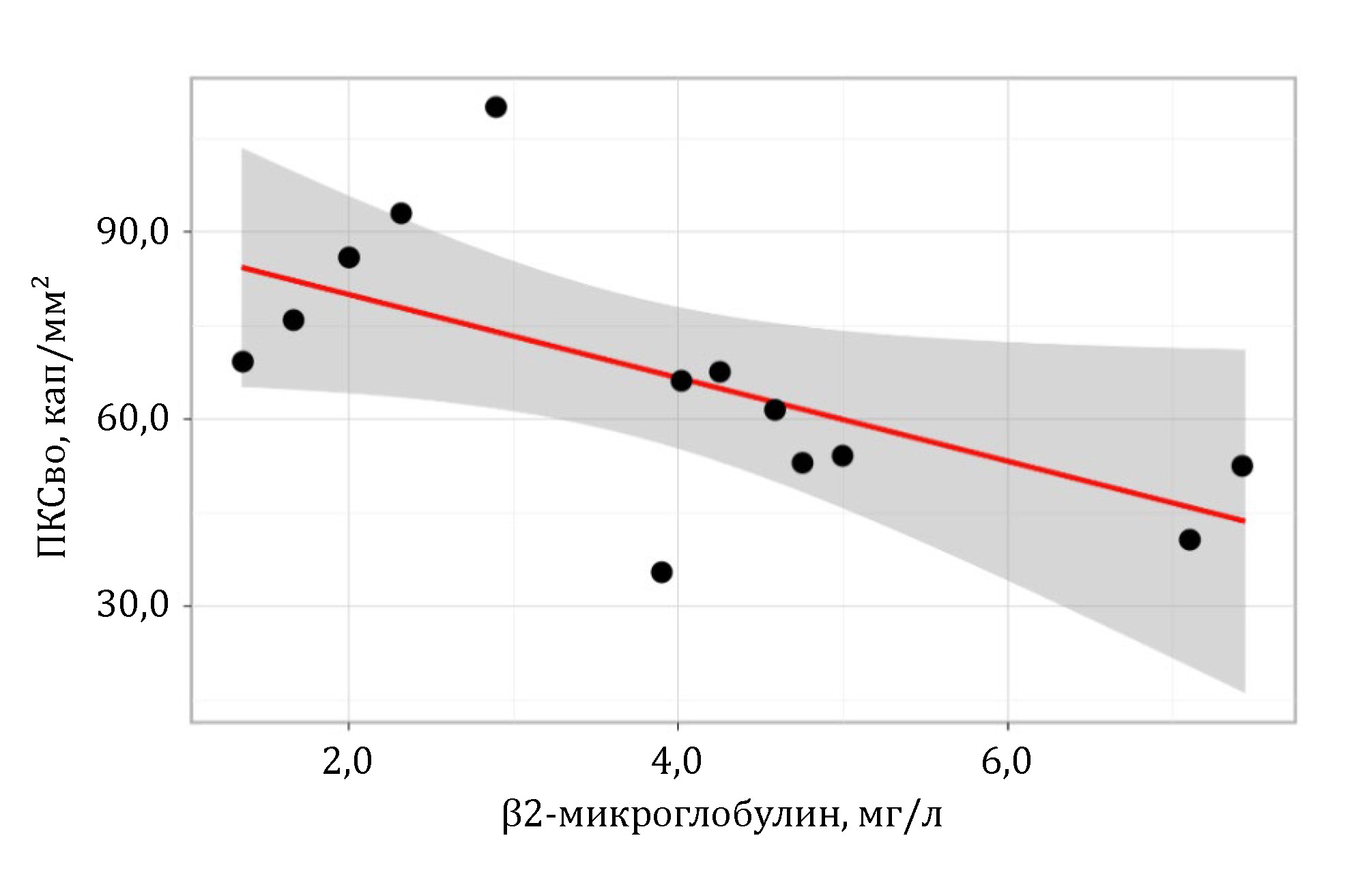
Рисунок 2 - Взаимосвязь уровня β2-микроглобулина с ПКСво у пациентов с впервые установленным диагнозом ММ
Примечание: ПКСво – плотность капиллярной сети в пробе с венозной окклюзией
4. Обсуждение
В настоящем исследовании впервые проведена оценка структурно-функционального состояния МЦР с использованием КВК у пациентов с ММ до начала специфической терапии и исследованы корреляции данных параметров с показателями активности основного заболевания.
В последние годы стало уделяться больше внимания изучению морфофункциональных изменений сосудов у больных различными заболеваниями. Основным механизмом, вовлеченным в развитие и прогрессирование ССО, представляется эндотелиальная дисфункция (ЭД), которая проявляется потерей вазорелаксантных свойств эндотелия, подавлением сосудистых репаративных функций, что потенцирует ремоделирование сосудов с повышением их жесткости и играет важную роль в патогенезе АГ, ИБС и ХСН , .
Из всех методов, которые используются для оценки морфофункционального состояния МЦР, КВК обладает преимуществом, поскольку она является неинвазивной и простой в исполнении. КВК прочно заняла свое место в практике врачей-ревматологов и применяется для оценки сосудистого русла у больных системной склеродермией, синдромом Рейно и ряде других заболеваний соединительной ткани . С другой стороны, научных работ, посвященных изучению данной проблемы среди пациентов с онкологическими заболеваниями, единицы, несмотря на высокую распространенность ССО среди данной когорты больных. Так, группой итальянских ученых под руководством Cardone M. было проведено исследование структурных изменений при КВК на группе из 25 пациенток с раком молочной железы (средний возраст 55,48 лет; медиана времени от начала ХТ – 12 мес.), находящихся в процессе активного лечения . Установлено, что эктазия капиллярных петель и капиллярные кровоизлияния могут рассматриваться как потенциальные маркеры сосудистого повреждения на уровне МЦР, возникшие на фоне проведения противоопухолевого лечения. Данные изменения были более выражены у пациенток, которые дольше находились на ХТ, и в меньшей степени зависели от возраста. Coschignano M.A. и соавт. провели исследование функционального состояния сосудов у пациентов, получавших антиангиогенные препараты (ингибиторы тирозинкиназ или анти-VEGF моноклональные антитела), непосредственно до инициации терапии, а также спустя 3 и 6 месяцев от ее начала . Среди 20 включенных в протокол пациентов с опухолями различной локализации лишь 14 полностью завершили исследование. При помощи КВК ученые анализировали ПКС в покое и после пробы с венозной окклюзией. Так, спустя 3 и 6 месяцев (p = 0,03 и p = 0,02, соответственно) после начала ХТ у пациентов отмечалось закономерное снижение ПКС в покое, однако в отношении ПКСво достоверной динамики выявлено не было. Ряд исследований также показал снижение ПКС у пациентов, принимающих анти-VEGF-A моноклональное антитело бевацизумаб , , . Отдельно стоит отметить исследование Кириченко Ю.Ю. и соавт., в котором исследовались структурно-функциональные параметры МЦР у 25 пациентов с аденокарциномой желудка, которым было выполнено оперативное лечение с последующим проведением ХТ с включением 5-фторурацила или капецитабина и препаратов платины. Полученные данные были проанализированы и сопоставлены с группой сравнения (n = 15, установленный диагноз ССЗ) и группой контроля (n = 25, здоровые добровольцы) . Так, у всех исследуемых групп при КВК определялась дисфункция капилляров в виде снижения ПКВ и ПКСрг, а также разрежение ПКСп и ПКСво, причем эти изменения у онкологических пациентов достоверно ухудшались на фоне лечения. При этом между результатами в группе пациентов с ССЗ и здоровыми добровольцами статистически значимых различий выявлено не было.
В настоящем исследовании на основании проведенной КВК правомочно обсуждать наличие у пациентов с ММ еще до начала противоопухолевого лечения признаков ЭД, поскольку отмечались как структурные изменения в виде снижения ПКС в пробе с венозной окклюзией, так и нарушения функции сосудов МЦР – снижение ПКВ. Научный интерес представляют полученные в ходе анализа взаимосвязи показателя ПКСво и параметров активности ММ. Так, достоверные различия были получены в зависимости от стадии ММ по системе ISS: чем выше опухолевая нагрузка и, следовательно, стадия, тем ниже была ПКСво. Также примечательны результаты корреляционного анализа, которые продемонстрировали наличие заметной обратной взаимосвязи уровня β2-микроглобулина и ПКСво. Уровень β2-микроглобулина может рассматриваться не только как один из критериев активности ММ, но он также служит как один из параметров, отражающих функциональное состояние почек , что, безусловно вносит свой вклад в развитие васкулотоксических осложнений у пациентов с ММ при проведении специфической терапии, и подчеркивает важность комплексного подхода к лечению и профилактике риска ССО у данной когорты больных.
Развитие современной медицины меняет подход к ведению онкологических пациентов. С увеличением их выживаемости важным представляется улучшение качества жизни, которое во много обусловлено наличием осложнений противоопухолевого лечения, в большей степени кардиоваскулярных. Одним из ключевых звеньев развития кардиоваскулотоксических осложнений ХТ является ЭД. Доказано, что исходное состояние МЦР играет важную роль в инициировании новых или прогрессировании уже имеющихся ССЗ. Пациенты с ММ представляют особый интерес, поскольку состояние их ССС определяется особенностями течения основного заболевания (гипервискозный синдром, электролитные нарушения, поражение почек), что подтверждает необходимость не только тщательной стратификации кардиоонкологического риска больных, но и мониторинга васкулотоксических осложнений у данной когорты пациентов, для чего требуется проведение дальнейших исследований на больших выборках пациентов.
Ограничения исследования: малая выборка пациентов; отсутствие группы сравнения (пациенты, сопоставимые по полу и возрасту, с наличием ССЗ, без ЗНО в анамнезе) и группы контроля (здоровые добровольцы).
5. Заключение
Полученные авторами результаты подтверждают необходимость более тщательного мониторинга состояния ССС у пациентов с онкологическими заболеваниями и ММ, в частности. Следует рассмотреть возможность разработки отдельных шкал для оценки кардиоонкологического риска больных данной плазмоклеточной неоплазией с учетом показателей структурно-функционального состояния сосудистого русла, в том числе, с применением перспективного неинвазивного метода КВК. Выявленные морфофункциональные изменения в совокупности с наличием парапротеинемии и высокой опухолевой активностью онкогематологического заболевания могут потенцировать васкулотоксические эффекты применяемой ХТ. Требуются новые подходы к стратификации кардиоонкологического риска пациентов с ММ, основой которых должны стать дальнейшие проспективные сравнительные исследования, проведенные на больших выборках пациентов.
