Твердые электролиты гидроксидов натрия и калия в пористых слоях привитых к микрочастицам аморфного диоксида кремния и пришитых к волокнам целлюлозной ткани
Твердые электролиты гидроксидов натрия и калия в пористых слоях привитых к микрочастицам аморфного диоксида кремния и пришитых к волокнам целлюлозной ткани
Аннотация
Синтезированы твердые донорные электролиты, которые состоят из пористого слоя глицинатных производных ПВХ, привитых к микрочастицам аэросила и к волокнам целлюлозной ткани, и растворенных в них аквакомплексов гидроксидов натрия или калия. Исследованы сорбционные характеристики растворителей по содержанию воды и титриметрическим методом установлено содержание щелочи в них. Методом ИК-спектроскопии исследовано влияние сорбируемых гидроксидов на состав твердого электролита, зависимость тока от напряжения в цепи Pt (+) – раствор МOH (анолит) – мостик из твердого электролита – раствор МOH (католит) - Pt (-) и внутреннее сопротивление исследуемых растворов (где M – Na или K). Лимитирующей стадией движения зарядов в цепи является их перенос через твердый электролит. Показано, что полученные твердые электролиты ведут себя как OH-проводящие мембраны.
1. Введение
Пористые слои циклических ацетат-N-замещенных аминов, привитые к поверхности гидрофильного пирогенного диоксида кремния (далее аэросил) и химически пришитые к волокнам целлюлозной ткани, перспективны как двухфазные матричные растворители [1]. Примерами являются ионопроводящие твердые электролиты сульфатов натрия и калия [1], [2], [3]. Донорные атомы из ->N и -СОО-*M+ групп полимера, ->Si-O-Si<- и ->Si-OH групп аэросила и ->Si-О-С< групп на границе фаз координируются ионами Na+ и К+. Из катионов, анионов и молекул воды образуются многоядерные комплексы с координационными фрагментами [М2SO4(H2O)j]n, в которых j+2 меньше координационного числа М+. Согласно [4], при сорбции в аэросил растворов МОН группы ->Si-OH превращаются в ->Si-O-* М+. В нашем случае, наиболее вероятно, что продуктами сорбции будут электролиты МОН в твердом растворителе, в фазе аэросила которого будут ->Si-O-Si<- и ->Si-O-* М+ группы, а в порах будут многоядерные комплексы с координационными фрагментами [МОН(H2O)j]n. В настоящее время такие электролиты в литературе не описаны.
Цель исследования: Синтезировать электролиты МОН в твердом матричном растворителе с ->Si-O- группами, измерить их ионную проводимость и зависимость тока от напряжения в цепи: катод - анолит - электролит (мостик) - катлит - анод, в которой мостик находится на воздухе.
2. Экспериментальная часть и результаты
Матричные растворители были синтезированы по методике [1]. Использовались 3М водные растворы гидроокиси натрия и калия (х.ч.).
Методы исследования:
- препаративный, химический анализ;
- ИК-Фурье спектроскопия (ИК -Фурье спектрометр Perkin-Elmer 2000), отнесение полос проводили согласно [4], [5], [7], [8];
- измерение электропроводности твердых электролитов проводили по методике [1], [2], используя прямоугольные отрезки твердых электролитов: длина 10 см, ширина 10 см. Погрешность измерения не более 100 Ом;
- измерения напряжение величины Е0, при которой начинается перенос зарядов в цепи катод - раствор МОН - электролит (мостик) - раствор МОН – анод, и константы скорости переноса проводили методом вольтамперометрии согласно [1], [3], используя 3 моль/л растворы МОН и отрезки твердого электролита длиной 20 см и шириной 10 см, концы которого опущены в растворы на 4 см каждый.
Погрешность измерения тока J в цепи при заданном напряжении составила 0.05 мА.
Для синтеза твердых электрлитов образцы матричных растворителей известной массы (mo) выдерживали в растворах NaOH или КОН, удаляли окклюдированную жидкость с помощью фильтровальной бумаги и сушили при 110-115оС до постоянной массы (m1), по ходу синтеза периодически записывая их ИК-спектры. Процесс считали законченным, когда в ИК- спектрах исчезали полосы 1004 и 690 см-1 колебаний (-О)3Si -OH групп и появлялись полосы 1100, 1040-1050, 770 см-1, в которых находятся полосы колебаний (-О)3Si -O- групп. Электролиты, содержащие гидроокись натрия обозначены как I(NaOH), II(NaOH), III(NaOH), с гидроокисью калия - I(КOH), II(КOH) и III(КOH), где I, II и III - твердые электролиты с содержанием аэросила 24,3%, 45,9%, и 76,1% соответственно.
Для определения содержания МОН и j (среднего числа молекул воды, приходящихся на один катион), образец электролита массы m помещали в воду, добавляли раствор фенолфталеина, тировали 0.01 н раствором соляной кислоты, кипятили в воде и сушили при 110о до постоянной массы m1. Содержание гидроокиси (ммоль/г) рассчитывали по формуле СМОН = 0.01V/m1, где V – число мл раствора соляной кислоты, пошедшей на титрование. Содержание воды рассчитывали по формуле Сaq = (m- m1 - СМОН Mr), где Mr – молекулярная масса гидроокисей, после чего рассчитывали значения j = Сaq/ СМОН (табл. 1).
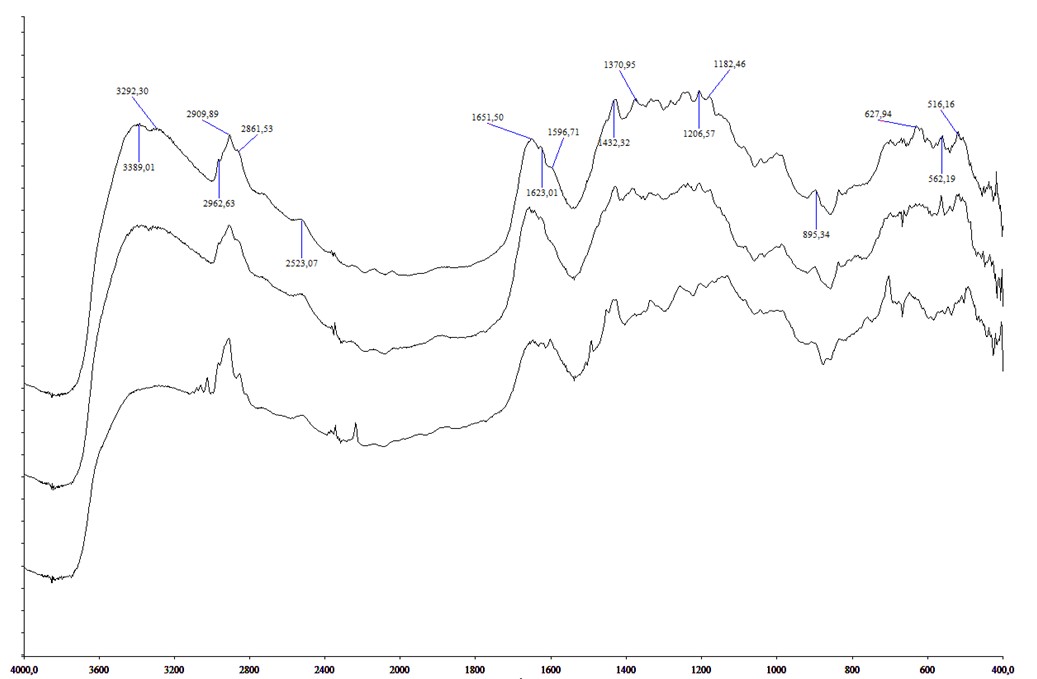
Рисунок 1 - ИК-спектры, сверху вниз III(КОН), II(КОН), I(КОН)
Таблица 1 - Содержание МОН и среднее число молекул воды, приходящихся на один катион в электролитах
Электролит | СNaOH, ммоль/г | j, ммоль/г | Электролит | СKOH, ммоль/г | j, ммоль/г |
I(NaOH) | 1,03 | 3,63 | I(КOH) | 0,98 | 2,61 |
II(NaOH) | 3,79 | 2,99 | II(КOH) | 2,94 | 2,86 |
III(NaOH) | 6,95 | 2,38 | III(КOH) | 3,76 | 2,79 |
Из таблицы видно, что значения j+2 меньше координационного числа катиона в акваионах, равного 6 для Na+ и 6-8 для К+ [9], [10], [11], [12]. В таких условиях ОН- и Н2О выступают как мостиковые лиганды, объединяя центральные атомы через донорные атомы кислорода. В электролитах остальные места в координационных сферах занимают донорные атомы из групп растворителя. Следовательно, в порах находятся многоядерные комплексы с координационными фрагментами [MOH(H2O)j]n. Значения СМОН возрастает с увеличением массовой доли аэросила. Для каждого растворителя СNaOH>СKOH. В случае NaOH значения j падает с увеличением массовой доли аэросила, а КОН – мало зависит от этих величин.
Таблица 2 - Электропроводность электролитов
Электролит | σ, 10- 5, См | Электролит | σ, 10-5 , См |
I(NaOH) | 2,22 | I(КOH) | 3,57 |
II(NaOH) | 2,54 | II(КOH) | 3,84 |
III(NaOH) | 3,33 | III(КOH) | 4,00 |
Судя по значениям σ (табл. 2) полученные твердые электролиты являются диэлектриками. Значениям σ электролитов уменьшается с увеличением доли аэросила, то есть подвижность ионов в комплексах в фазе аэросила меньше, чем в фазе полимера. Это связано с тем, что структура пор полимера не жесткая со множеством конформаций, тогда как пор аэросила – жесткая. В каждом случае подвижность ионов в электролитах КОН больше, чем в электролитах NaOH, а электропроводность возрастает при увеличении доли аэросила.
При пропускании тока через цепи: катод- анолит – мостик - католит - анод, на катоде выделяется водород, а на аноде – кислород. Это означает, что твердые электролиты с МОН ионопроводящие. Зависимости J от Е приведены на рис. 2.
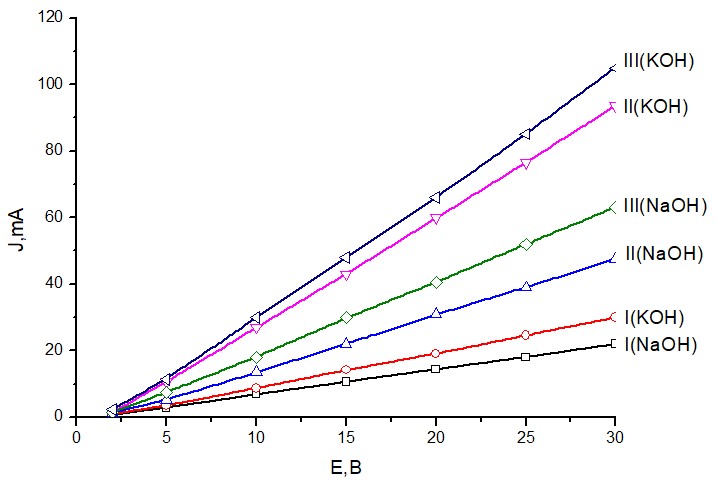
Рисунок 2 - Зависимости тока от напряжения в цепи
Таблица 3 - Напряжение начала движения ОН- и константа скорости переноса в электролитах
Электролит | Е0, В | kск 105, мг-экв/секВ | Электролит | Е0, В | kск*105, мг-экв/секВ |
I(NaOH) | 1,05 | 0,76 | I(КOH) | 1,05 | 1,57 |
II(NaOH) | 1,69 | 1,97 | II(КOH) | 1,79 | 3,29 |
III(NaOH) | 2,23 | 2,28 | III(КOH) | 1,96 | 3,66 |
Из таблицы видно, что с увеличением доли аэросила возрастают как Енач, так и kск. При этом для одного и то же растворителя kск в электролитах NaOH меньше, чем КОН.
3. Заключение
Выделение водорода на катоде и кислорода на аноде в цепи: катод- раствор МОН – электролит (мостик) - раствор МОН - анод, происходят по реакциям 2Н2О + 2е- = 2ОН- + Н2 и 4ОН- - 4е = О2 + 2Н2О. В растворе с катодом возникает избыток, в растворе с анодом – недостаток ОН-. Избыточные ОН- из раствора с катодом сорбируются в участок твердого электролита, контактирующего с раствором, а из твердого электролита в раствор с анодом происходит десорбция ОН-. На концах твердого электролита возникают отрицательный и положительный заряды, а в электролите – электрическое поле. Как было показано выше в многоядерных комплексах координированные ОН- и молекул воды образуют агрегаты с группами из фрагментов типа Н2О-М-ОН*ОН2*ОН-М. При напряжении Е0 напряженность поля достигает такой величины, при которой начинается эстафетный перенос гидроксид-ионов между ОН- и Н2О через поры. Подобные процессы характерны для ОН- проводящих мембран.
