ИСПОЛЬЗОВАНИЕ МЕТОДА ТФЭ ДЛЯ ЭКСТРАКЦИИ ПРОИЗВОДНОГО 3-ГИДРОКСИ-3-ПИРРОЛИН-2-ОНА ИЗ ПЛАЗМЫ КРОВИ
ИСПОЛЬЗОВАНИЕ МЕТОДА ТФЭ ДЛЯ ЭКСТРАКЦИИ ПРОИЗВОДНОГО 3-ГИДРОКСИ-3-ПИРРОЛИН-2-ОНА ИЗ ПЛАЗМЫ КРОВИ
Научная статья
Булгакова Е.А.1, *, Карпенко Ю.Н.2
1, 2 Пермская государственная фармацевтическая академия, Пермь, Россия
* Корреспондирующий автор (bulgakova_pfa[at]mail.ru)
АннотацияВысокий рост заболеваний, связанных с нарушениями основных когнитивных функций, обуславливает необходимость поиска и внедрения в медицинскую практику новых и эффективных ноотропных препаратов.
Синтезированное в Пермской государственной фармацевтической академии биологически активное соединение 1-аминокарбонилметил-4-ацетил-5-(4-бромфенил)-3-гидрокси-3-пирролин-2-он было рекомендовано для доклинических исследований как потенциальное ноотропное средство.
В настоящее время широкое применение в практике доклинических исследований для изолирования лекарственных препаратов из биологических жидкостей находит метод твердофазной экстракции (ТФЭ), позволяющий сочетать изолирование и очистку от соэкстрактивных веществ биологической матрицы.
Ключевые слова: твердофазная экстракция, высокоэффективная жидкостная хроматография, валидация биоаналитических методик.
USE OF SFE METHOD FOR THE EXTRACTION OF A DERIVANT OF 3-HYDROXY-3-PYRROLIN-2-ONE FROM BLOOD PLASMA
Research article
Bulgakova E.A.1, *, Karpenko Yu.N.2
1, 2 Perm State Pharmaceutical Academy, Perm, Russia
* Corresponding author (bulgakova_pfa[at]mail.ru)
AbstractThe high growth of diseases associated with impaired basic cognitive functions necessitates the search and implementation of new and effective nootropic drugs in medical practice.
The biologically active compound of 1-aminocarbonylmethy-4-acetyl-5-(4-bromophenyl)-3-hydroxy-3-pyrrolin-2-one synthesized at the Perm State Pharmaceutical Academy was recommended for preclinical studies as a potential nootropic agent.
Currently, the practice of preclinical studies for the isolation of drugs from biological fluids is widely used in solid-phase extraction (SPE), which allows one to combine isolation and purification from coextracting substances of the biological matrix.
Keywords: solid-phase extraction, high-performance liquid chromatography, validation of bioanalytical methods.
В современном мире существенно возросла проблема, связанная с увеличением числа заболеваний и пограничных состояний, которые сопровождаются нарушением функций мозга. Для ее решения требуется разработка и внедрение в медицинскую практику новых и эффективных ноотропных препаратов.
В настоящее время на этапе доклинических исследований в качестве потенциального ноотропа находится соединение КОН-2 (1-аминокарбонилметил-4-ацетил-5-(4-бромфенил)-3-гидрокси-3-пирролин-2-он (5), синтезированное в Пермской государственной фармацевтической академии под руководством профессора Гейна В.Л. [3].
При проведении фармакокинетических исследований важной задачей является разработка методик определения лекарств в биологических жидкостях и тканях. Для изолирования лекарственных препаратов из биологических жидкостей широкое применение находит метод твердофазной экстракции (ТФЭ) [6], [7]. Данный способ пробоподготовки сочетает в себе не только извлечение анализируемого вещества, но и очистку от соэкстрактивных веществ, что позволяет получать высокоочищенные пробы, пригодные для анализа методом высокоэффективной жидкостной хроматографии [1], [8].
Целью данной работы явилась разработка и валидация методики изолирования КОН-2 из плазмы крови методом ТФЭ.
Изучение условий изолирования КОН-2 методом твердофазной экстракции проводили на картриджах для твердофазной экстракции Strata C18-E (Phenomenex). Данные патроны упакованы сорбентом на основе силикагеля с привитой обращенной фазой С18. Пробоподготовку осуществляли на установке для твердофазной экстракции с вакуумной камерой на 10 позиций VACMASTER.
Анализ полученных извлечений проводили на жидкостном хроматографе «Shimadzu LC-20», снабженным колонкой с обращено-фазным сорбентом и спектрофотометрическим детектором (диодная матрица).
При разработке методики учитывались следующие факторы: условия подготовки патрона (кондиционирование, удаление соэкстрактивных веществ плазмы), состав элюента и условия элюирования целевого компонента.
Предварительно были изучены условия твердофазной экстракции КОН-2 из водных растворов. Для этого были проанализированы водные растворы КОН-2 с концентрацией 5 мкг/мл.
Пробоподготовка включала следующие стадии: кондиционирование патрона; загрузка анализируемого образца; промывка патрона от соэкстрактивных веществ; элюирование анализируемого вещества.
На этапе кондиционирования через патрон последовательно со скоростью 1 мл/мин пропускали 1 мл метанола и 1 мл воды. Далее загружали 1 мл водного раствора КОН-2 с концентрацией 5 мкг/мл. Для промывки патрона использовали 10% раствор метанола (1 мл) и воду (1 мл). В качестве элюентов были апробированы метанол и ацетонитрил. Элюирование осуществляли двумя порциями растворителя – 1 и 0,5 мл. Результаты анализа полученных элюатов отражены в таблице 1.
Таблица 1 – Содержание КОН-2 в элюатах при ТФЭ на патронах StrataC18-E
| Элюент | Степень извлечения КОН-2 из водного раствора, % (n=6) | |
| Метанол | 1,0 мл | 23,37 ± 1,26 |
| 0,5 мл | 3,72 ± 0,78 | |
| Ацетонитрил | 1,0 мл | 26,81 ± 0,74 |
| 0,5 мл | - | |
Установлено, что 1 мл растворителя недостаточно для полного элюирования КОН-2 метанолом, и более 3% аналита обнаруживается после повторного элюирования 0,5 мл растворителя.
Также были проанализированы фракции, полученные на этапе промывки 10% метанолом и водой. Установлено, что значительная часть КОН-2 (более 20%) теряется на данной стадии. Результаты представлены в таблице 2.
Таблица 2 – Содержание КОН-2 в «промывочных» фракциях
| «Промывочные» фракции | Содержание КОН-2, % (n=6) |
| 10% раствор метанола | 23,37 |
| Вода дистиллированная | 3,72 |
Чтобы снизить потери аналита на этапе промывки патрон после загрузки образца промывали 0,01М раствором кислоты хлористоводородной и водой дистиллированной. Использование кислоты привело к лучшей сорбции КОН-2 на сорбенте (за счет перехода вещества в молекулярную форму) и отсутствию анализируемого вещества в «промывочных» фракциях.
Для увеличения выхода КОН-2 на этапе элюирования нами были апробированы метанол и ацетонитрил, подщелоченные аммиаком водным до рН 10, с целью переведения вещества в ионизированное состояние. В случае использования подщелоченного метанола степень экстракции КОН-2 возросла до 74%.
Данные условия были апробированы на модельных смесях плазмы крови с концентрацией КОН-2 5 мкг/мл. Установлено, что использование на этапе промывки патрона от соэкстрактивных веществ 0,01М раствора кислоты хлористоводородной и воды дистиллированной, и элюирование метанолом, подщелоченным аммиаком водным до рН 10 позволило извлечь более 62 % аналита.
Таким образом, на основании проведенных исследований нами предложена следующая схема изолирования КОН-2 из плазмы крови методом твердофазной экстракции:
- Кондиционирование патрона путем последовательного промывания 1 мл метанола и 1 мл воды очищенной.
- Загрузка патрона 1 мл плазмы.
- Промывка патрона с целью удаления белков и других эндогенных компонентов плазмы 1 мл 0,01 М раствора кислоты хлористоводородной и 1 мл воды очищенной.
- Элюирование сорбированных аналитов 1,5 мл метанола pH
Валидация
Валидацию разработанной биоаналитической методики проводили в соответствии с современными требованиями [2], [4,] [5] по следующим параметрам: специфичность, линейность, правильность, прецизионность, предел обнаружения и количественного определения.
Для определения специфичности разработанных условий проводили анализ стандартных растворов КОН-2 (5 мкг/мл), холостого образца плазмы крови и модельной смеси плазмы с известным содержанием аналита. Примеры хроматограмм приведены на рис. 1.
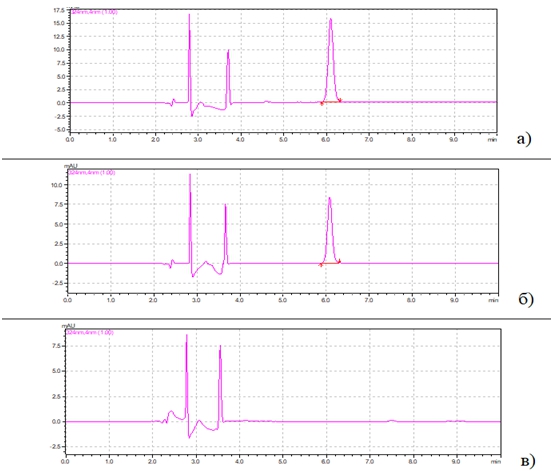
Рис. 1 – Хроматограммы: а) стандартного раствора КОН-2 (5 мкг/мл); б) извлечения из модельной смеси плазмы крови с КОН-2 (5 мкг/мл); в) извлечения из холостой пробы плазмы крови
Идентификацию пика КОН-2 проводили по времени удерживания и УФ- спектру, сравнивая с аналогичными параметрами стандартного раствора вещества. Анализ хроматограммы извлечения из холостой пробы плазмы крови показал отсутствие мешающих пиков на месте выхода исследуемых соединений.
Для установления линейности методики были проанализированы 7 образцов модельных смесей плазмы с содержанием КОН-2 в диапазоне 0,2 – 10 мкг/мл. Образцы готовили к анализу в соответствии с разработанной методикой пробоподготовки и хроматографировали по 3 раза. Результаты определения линейности приведены на рис. 2.
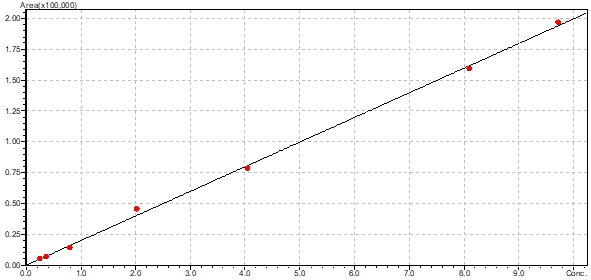
Рис. 2 – Калибровочный график количественного определения КОН-2
Коэффициент корреляции составил 0,9987315, что подтверждает линейность методики в указанном диапазоне концентраций. Уравнение калибровочного графика имеет вид Y = 1972,49*X (Y – площадь пика, X – концентрация, мкг/мл).
Предел обнаружения КОН-2 при использовании разработанной методики – 0,1 мкг/мл, предел количественного определения – 0,2 мкг/мл.
Для оценки пригодности методики по параметрам прецизионность и правильность были приготовлены 6 модельных биообразцов на 4 уровнях концентраций КОН-2. Пробоподготовку образцов осуществляли в соответствии с предложенной методикой. Прецизионность и правильность методики оценивалась по величинам относительного стандартного отклонения (RSD,%) и относительной величине систематической ошибки (δ,%), соответственно (таблица 3).
Таблица 3 – Оценка правильности и прецизионности методики определения КОН-2 в плазме крови
| Концентрация КОН-1 в модельной смеси, мкг/мл | (n = 6) | SD | RSD,% | ε,% |
| 0,29 | 0,26 | 0,019 | 7,2976 | -10,3 |
| 0,44 | 0,44 | 0,0469 | 10,6265 | 0 |
| 4,42 | 4,53 | 0,3111 | 6,8616 | 2,49 |
| 6,94 | 6,95 | 0,4759 | 6,8465 | 0,14 |
Полученные величины относительного стандартного отклонения и относительной погрешности не превышают 15%, что соответствует требованиям действующих руководств.
Таким образом, предложена высокочувствительная и эффективная методика изолирования КОН-2 из плазмы крови, соответствующая современным требованиям валидации биоаналитических методик.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Динамическое концентрирование органических веществ на неполярных сорбентах / О.А.Филиппов [и др.] // Журн. аналит. химии. – 2003. – Т. 58, №5. – С. 454-479.
- Руководство по экспертизе лекарственных средств. Том первый / А. Н. Миронов - Москва: Гриф и К, 2013. – 328 с.
- Шуклина Н.С. Поиск соединений, обладающих ноотропной активностью, в ряду 3-пирролин-2-онов: автореф. дис. …канд. биол. наук: 14.00.25 / Шуклина Наталья Сергеевна. – Пермь, 2001. – 21 с.
- Guidance for Industry: Bioanalytical method validation / U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evolution and Research (CDER). U.S. Government Printing Office. Washington, DC, 2001. – 25 p.
- Guideline on validation of bioanalytical methods (draft) / European Medicines Agency. Committee for medicinal products for human use. London, 2009. – 23 p.
- McDonald P.D. Solid Phase Extraction Applications guide and Bibliography. / McDonald P.D., E.S.P Bouvier. // A Resource for Sample Preparation Methods Development / Waters, Milford, MA, 1995. – 420 р.
- Soltes L. Effective One/Two Step Purification of Various Materials by Solid-phase Extraction Soltes, L., Sebille B. // Biomedical Chromatography. -1997. - Vol. 11. - P. 348–351.
- Żwir-Ferenc A. Solid phase extraction technique – trends, opportunities and applications (Review) / Żwir-Ferenc A., Biziuk M. / Polish J. of Environ. Stud. – 2006. - Vol. 15, No. 5. – P. 677-690.
Список литературы на английском языке / References in English
- Dinamicheskoye kontsentrirovaniye organicheskikh veshchestv na nepolyarnykh sorbentakh [Dynamic concentration of organic substances on non-polar sorbents] / O.A. Filippov // Zh. analyt. Khimii. [Journal of Analytical Chemistry] – 2003. – V. 58, No. 5. – P. 454-479. [in Russian]
- Rukovodstvo po ekspertize lekarstvennykh sredstv. Tom pervyy [Guidelines for examination of medicines. Volume One] / A. N. Mironov – Moscow: Grif and K, 2013. – 328 p. [in Russian]
- Shuklina N.S. Poisk soyedineniy, obladayushchikh nootropnoy aktivnost'yu, v ryadu 3-pirrolin-2-onov [Search for compounds with nootropic activity in the series 3-pyrrolin-2-ones] / Shuklina N.S. Abstract of PhD in Biology: 14.00.25 / Shuklina Natalya Sergeevna. – Perm, 2001. – 21 p. [in Russian]
- Guidance for Industry: Bioanalytical method validation / U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evolution and Research (CDER). U.S. Government Printing Office. Washington, DC, 2001. – 25 p.
- Guideline on validation of bioanalytical methods (draft) / European Medicines Agency. Committee for medicinal products for human use. London, 2009. – 23 p.
- McDonald P.D. Solid Phase Extraction Applications guide and Bibliography. / McDonald P.D., E.S.P Bouvier. // A Resource for Sample Preparation Methods Development / Waters, Milford, MA, 1995. – 420 р.
- Soltes L. Effective One/Two Step Purification of Various Materials by Solid-phase Extraction Soltes, L., Sebille B. // Biomedical Chromatography. -1997. - Vol. 11. - P. 348–351.
- Żwir-Ferenc A. Solid phase extraction technique – trends, opportunities and applications (Review) / Żwir-Ferenc A., Biziuk M. / Polish J. of Environ. Stud. – 2006. - Vol. 15, No. 5. – P. 677-690.
