НОВЫЙ ПУТЬ СИНТЕЗА ЗАМЕЩЕННЫХ АНТРАХИНОНОВ В ПРИСУТСТВИИ БИФУНКЦИОНАЛЬНЫХ КАТАЛИЗАТОРОВ
Гогин Л.Л.1, Жижина Е.Г.2, Пай З.П.3
1ORCID: 0000-0001-8127-8220, кандидат технических наук, 2ORCID: 0000-0001-6419-7568, доктор химических наук, 3ORCID: 0000-0002-4622-5323, доктор технических наук, Институт катализа им. Г.К. Борескова СО РАН
Работа выполнена в рамках государственного задания ФГБУН ИК СО РАН (проект № 0303-2016-0008)
НОВЫЙ ПУТЬ СИНТЕЗА ЗАМЕЩЕННЫХ АНТРАХИНОНОВ В ПРИСУТСТВИИ БИФУНКЦИОНАЛЬНЫХ КАТАЛИЗАТОРОВ
Аннотация
Производные 9,10-антрахинона (АХ) широко востребованы, однако существующие способы их производства давно устарели: процессы неэкономичны и неэкологичны. В настоящей работе на примере получения 2,3,6,7-тетраметил-9,10-АХ (ТМАХ) исследован новый путь синтеза замещенных АХ из гидрохинона (ГХ) и замещенных диенов (здесь – 2,3-диметилбутадиена, ДМБ). В качестве бифункционального (кислотного и окислительного) катализатора в one-pot процессе использован раствор высокованадиевый гетерополикислоты состава H17P3Mo16V10O89 (ГПК-10).
Исследовано влияние ряда параметров на ключевые показатели процесса. В выбранных условиях за 24 ч получена малорастворимая смесь двух продуктов (80% ТМАХ и 20% ДГТМАХ – недоокисленного дигидропроизводного ТМАХ), которая может быть использована в качестве эффективного катализатора делигнификации древесины. Полученные результаты открывают реальные перспективы создания малоотходных процессов синтеза замещенных АХ из ГХ и замещенных 1,3-диенов в присутствии растворов ГПК. Катализаторы обладают высокой активностью, стабильностью и эффективностью.
Ключевые слова: катализ, окисление, кислород, диеновый синтез, one-pot процессы, окислительно-восстановительный потенциал, замещенные антрахиноны, кислоты.
Gogin L.L.1, Zhizhina E.G.2, Pai Z.P.3
1ORCID: 0000-0001-8127-8220, PhD in Engineering, 2ORCID: 0000-0001-6419-7568, PhD in Chemistry, 3ORCID: 0000-0002-4622-5323, PhD in Engineering, Boreskov Institute of Catalysis of SB RAS
The study was conducted in the framework of state task of the FSBIN of the SB RAS (project No. 0303-2016-0008)
NEW WAY OF SYNTHESIS OF SUBSTITUTED ANTHRAQUINONS IN THE PRESENCE OF BIFUNCTIONAL CATALYSTS
Abstract
The derivatives of 9,10-anthraquinone (AQ) are in great demand nowadays. However, the existing methods for their production have long been outdated. Current processes are uneconomical and environmentally unfriendly. In the present work, a new way of synthesizing substituted AQ from hydroquinone (HQ) and substituted dienes (here it is 2,3-dimethylbutadiene, DMB) are studied using the example of 2,3,6,7-tetramethyl-9,10-AQ (TMAQ) preparation. As a bi-functional (acidic and oxidizing) catalyst, a high-vanadium heteropolyacids solution of H17P3Mo16V10O89 (HPA-10) composition was used in one-pot process.
The influence of a number of parameters on key process indicators is studied. Under the selected conditions, an insoluble mixture of two products (80% of TMAQ and 20% of DGTMAQ, an under-oxidized dihydro derivative of TMAQ) was obtained in 24 hours, which can be used as an effective wood delignification catalyst. The obtained results open real prospects for the development of low-waste processes for the synthesis of substituted AQ from HQ and substituted 1,3-dienes in the presence of solutions of HPA. The catalysts are characterized by high activity, stability and efficiency.
Keywords: catalysis, oxidation, oxygen, diene synthesis, one-pot processes, oxidation-reduction potential, substituted anthraquinones, acids.
9,10-Антрахинон (АХ) и его производные являются важными продуктами органического синтеза [1], [2], [3], [4], [5], [6], [7], [8]. Они применяются в производстве красителей [2], [3], [4], пероксида водорода [3], [5], лекарственных препаратов [3], [6], [7], как катализаторы делигнификации древесины [3] и др. Существующие промышленные методы синтеза производных АХ уже давно устарели, они, как правило, многостадийны и сопровождаются обильными отходами, в частности кислыми стоками. Так, для промышленного производства 2-алкил- и 2-хлоро-АХ используется метод синтеза из фталевого ангидрида и соответствующих монозамещенных бензолов с получением о-бензоилбензойных кислот с их последующей циклизацией в присутствии сильных кислот [2]. В качестве исходного сырья в многостадийных синтезах 1- и полизамещенных АХ используется незамещенный АХ, который переводят в сульфо- или нитропроизводные с дальнейшей модификацией боковой цепи [2]. Применяемый для синтеза незамещенного АХ метод окисления антрацена (получаемого из каменноугольной смолы) в случае замещенных АХ непригоден ввиду дефицитности исходного сырья – замещенных антраценов [2].
Одним из возможных методов получения замещенных АХ является диеновый синтез. Он базируется на реакции между 1,4-нафтохиноном (НХ) и замещенными 1,3-бутадиенами [3]. Возможно также использование нафтохинонов с одинаковыми заместителями в 6, 7 и (или) 5, 8 положениях. Аддукты получают в органических растворителях (при синтезе АХ процесс ведут под давлением 1,3-бутадиена 0,3-2 МПа, для снижения давления используют органические кислоты). Аддукты диенового синтеза могут быть далее окислены в АХ сильными окислителями в кислой среде (CuCl2, H2O2 или NaClO3 [9]) или кислородом воздуха в щелочной среде [10].
Таким образом, в настоящий момент очень актуальна проблема разработки экологически благоприятного процесса получения АХ и его замещенных производных.
В качестве окислителей различных органических субстратов (Su) кислородом с успехом могут быть использованы водные растворы Мо-V-P гетерополикислот (ГПК). Последние отличает то, что они являются обратимо действующими окислителями, т.е. их восстановленные формы могут быть окислены кислородом в исходные ГПК [11]. Следовательно, в присутствии раствора ГПК можно создать двухстадийный каталитический процесс окисления Su кислородом, в котором стадия (2) – это регенерация ГПК. Сумма этих 2-х реакций является каталитическим циклом реакции:
Su + 1/2 O2 → SuO.
Высокая производительность гомогенных катализаторов на основе ГПК обеспечивается высокой концентрацией V(V), поскольку именно атомы ванадия в каталитических двухстадийных процессах (1) + (2) претерпевают редокс-превращения (VV→VIV→VV). Эффективность катализаторов достигается использованием модифицированных (некеггиновских) высокованадиевых растворов Мо-V-P ГПК. Эти растворы обладают не только высокой окислительной ёмкостью, но и более высокой термостабильностью по сравнению с традиционными кеггиновскими растворами состава H3+xPMo12-xVxO40 (x=1-4) [12],[13].
С точки зрения катализа очень важно, что растворы Мо-V-P ГПК являются сильными бренстедовскими кислотами. Поэтому их можно использовать в качестве бифункциональных (кислотных и окислительных) катализаторов.
Ранее [14],[15],[16],[17] был разработан one-pot процесс получения 9,10-антрахинона и его производных из НХ и 1,3-бутадиена в присутствии модифицированных растворов ГПК брутто-составов H15P4Mo18V7O89 (ГПК-7) и H17P3Mo16V10O89 (ГПК-10), позволяющий при 80 °С, при полной конверсии НХ получать АХ с выходом 70% и содержанием основного вещества до 97%. Были использованы смешивающиеся с водой органические растворители. Растворы ГПК после их регенерации кислородом использовали в целевой реакции (1) многократно.
В качестве исходного субстрата для получения АХ диеновым синтезом можно использовать не только НХ, но и 1,4-бензохинон (БХ) [16]. Поскольку БХ легко получается окислением гидрохинона (ГХ), то при проведении реакции между ГХ и замещенными диенами в присутствии ГПК можно ожидать получения производных АХ.
Целью настоящего исследования была оценка перспектив разработки каталитических one-pot процессов синтеза замещенных АХ из ГХ (нового сырья) в присутствии модифицированных растворов ГПК в качестве бифункциональных катализаторов. В качестве примера представлены данные по получению тетраметилантрахинона (ТМАХ) при взаимодействии ГХ с 2,3-диметилбутадиеном (ДМБ) в присутствии упомянутого выше модифицированного раствора ГПК-10 (см. рис. 1).
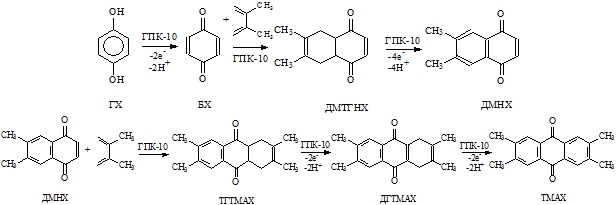
Рис. 1 – One-pot процесс получения 2,3,6,7-тетраметил-9,10-АХ (ТМАХ) при взаимодействии гидрохинона (ГХ) с 2,3-диметилбутадиеном в присутствии раствора ГПК-10 (ДМТГНХ – 4а,5,8,8а-тетрагидро-6,7-диметил-1,4-НХ; ДМНХ – 6,7-диметил-1,4-НХ; ТГТМАХ – 1,4,4а,9а-тетрагидро-ТМАХ; ДГТМАХ – 1,4-дигидро-ТМАХ)
Процесс начинается с быстрого и количественного окисления ГХ гетерополикислотой в БХ, который в кислой среде конденсируется с ДМБ. Аддукты циклоприсоединения окисляются в 6,7-диметил-1,4-нафтохинон (ДМНХ), который вступает в реакцию диенового синтеза со второй молекулой ДМБ. В результате образуется новый аддукт ТГТМАХ (1,4,4а,9а-тетрагидро-ТМАХ), окисление которого приводит к целевому ТМАХ. Малорастворимый продукт реакции, представляющий собой смесь антрахиноновых производных, практически количественно выпадает в осадок из реакционного раствора.
Было установлено, что выход ТМАХ в таком процессе возрастает с ростом его длительности: 61% за 14 ч, 70% за 18 ч, 76% за 24 ч. Поскольку дальнейший рост замедляется, время реакции в исследованиях было ограничено 24 ч.
Предыдущие исследования показали, что природа органического растворителя (ОР) может играть ключевую роль в направлении и скорости протекания процессов с участием органических веществ [18]. Поэтому в данной работе было изучено влияние природы гидрофильного ОР (для лучшего смешения ГПК и органических веществ) на показатели процесса. Среди использованных ОР были диоксан, диглим и этанол, которые существенно отличаются по свойствам, в частности, по полярности и основности. Лучшим оказался 1,4-диоксан. В его присутствии за 24 ч реакция диенового синтеза с образованием антрахиноновых аддуктов протекала полностью (данные ВЭЖХ и Н1 ЯМР показали отсутствие производных НХ), содержание ТМАХ в твердом продукте реакции достигало 79%, а его выход был 74%. Кроме того, после завершения целевого процесса (перед регенерацией катализатора) диоксан отделяли от водного раствора отгонкой его азеотропа с водой (т. кип. 88 °С) и вновь использовали в one-pot процессе на следующем цикле. Поскольку диглим кипит при более высокой температуре (161°С), его труднее отделять от реакционного раствора. Это было еще одним основанием в пользу выбора диоксана в качестве растворителя для проведения процесса по схеме 1.
Оценивая влияние кислотности среды на ключевые показатели процесса, установлено, что незначительные изменения рН реакционной среды не оказывают на них заметного влияния. В опытах кроме раствора свободной ГПК-10 использована ее кислая соль брутто-состава KH16P3Mo16V10O89, полученная частичной нейтрализацией раствора ГПК-10 поташом. Кроме того, с целью снижения кислотности реакционного раствора был опробован разбавленный в 2 раза раствор ГПК-10, в котором количество ГПК было таким же, а концентрация ее в 2 раза ниже. Полученные результаты позволили сделать вывод о том, что концентрация протонов в растворах ГПК-10 и ее кислых солей (рН во всех случаях ниже 0) высока и вполне достаточна для протекания кислотно-каталитической реакции диенового синтеза, т.е. [H+] не лимитирует скорость всего one-pot процесса схемы 1. Именно поэтому мы не наблюдаем влияния кислотности среды на ключевые показатели процесса.
Увеличения выхода ТМАХ удалось добиться увеличением мольного соотношения ДМБ : ГХ (Табл. 1). Вероятно, здесь сказывается тот факт, что реакция диенового синтеза является обратимой [19]. Поэтому при повышении количества диена и смещении вправо реакции циклоприсоединения наблюдается ускорение последующих стадий one-pot процесса по схеме 1. Из данных таблицы 1 следует, что при увеличении избытка диена в 2 раза выход целевого продукта (ТМАХ) увеличивается более чем в 2 раза.
Таблица 1 – Влияние мольного отношения ДМБ : ГХ на показатели one-pot процесса синтеза ТМАХ
Условия: ГХ – 1.3´10-3 моля (0.143 г), ГПК-10 – 3.5´10-3 моля (14 мл 0.25 М раствора), мольное отношение ГПК : ГХ 2.7, объемное отношение диоксан : водный раствор 1:1; 90 °С, 24 ч.
| Мольное отношение ДМБ : ГХ | Количество ДМБ по отношению к стехиометрическому количеству | Содержание ТМАХ в твердом продукте, % | Выход ТМАХ, % |
| 3.3 | 1.65 | 76* | 34 |
| 5 | 2.50 | 77** | 59 |
| 6.6 | 3.30 | 79** | 74 |
Примечание: *– многокомпонентная смесь НХ и АХ производных; **– смесь ТМАХ и ДГТМАХ (данные ВЭЖХ и Н1 ЯМР).
Таким образом, в ходе исследования было установлено, что в присутствии раствора ГПК-10 в качестве бифункционального катализатора можно с успехом организовать one-pot процесс получения ТМАХ при взаимодействии ГХ с ДМБ. Наибольшее влияние на ключевые показатели процесса оказывают: время реакции, наличие гидрофильного растворителя и мольное отношение ДМБ : ГХ. Эксперименты, проведенные в выбранных условиях, обеспечили получение малорастворимой смеси двух продуктов: ~ 80% ТМАХ и ~ 20% ДГТМАХ (недоокисленного дигидропроизводного ТМАХ). Для достижения полного превращения всех промежуточных продуктов в ТМАХ по схеме 1 необходимы дополнительные исследования по оптимизации one-pot процесса, однако полученная смесь из двух антрахиноновых производных очень важна сама по себе. Она может быть использована в качестве эффективного катализатора делигнификации древесины [1].
Полученные в работе результаты открывают реальные перспективы создания малоотходных процессов получения различных замещенных АХ из гидрохинона и замещенных 1,3-диенов в присутствии модифицированных растворов Мо-V-P ГПК. Такие катализаторы обладают высокой активностью и стабильностью, а возможность их быстрой регенерации обеспечивает их эффективность.
Список литературы / References
- Полотнюк О.-В. Я. К истории становления в Советском Союзе первого производства антрахинона. Часть 1. Разработка и внедрение промышленного производства антрахинона окислением антрацена кислородом воздуха в неподвижном слое катализатора / О.-В. Я. Полотнюк // Катализ в промышленности. – 2013. – № 5. – С. 59–65.
- Bien H.-S. Anthraquinone Dyes and Intermediates / H.-S. Bien, J. Stawitz, K. Wunderlich // Ullmann’s Encyclopedia of Industrial Chemistry. – 2000. – P. 137-153. doi:10.1002/14356007.a02_355
- Cofrancesco A. J. Anthraquinone / A. J. Cofrancesco // Kirk-Othmer Encyclopedia of chemical technology. – 2000. – P. 410-418.doi:1002/0471238961.0114200803150618.a01
- Chang J. B. Dichroic and spectral properties of anthraquinone-based azo dyes for PVA polarizing film / J. B. Chang, S. B. Yuk, J. S. Park and others // Dyes and Pigments. – 2012. – Vol. 92(1). – P. 737–744. doi.org/10.1016/j.dyepig.2011.06.024
- Valim R. Electrogeneration of hydrogen peroxide in gas diffusion electrodes modified with tert-butyl-anthraquinone on carbon black support / R. B. Valim, R. M. Reis, P. S. Castro and others // Carbon. – 2013. – Vol. 61. – P. 236–244. doi.org/10.1016/j.carbon.2013.04.100
- Abdel-Hamid A. M. Chapter One – Insights into lignin degradation and its potential industrial applications / A. M. Abdel-Hamid, J. O. Solbiati, I. K. O Cann // Advances in Appl. – 2013. – Vol. 82. – P. 1–28. doi.org/10.1016/B978-0-12-407679-2.00001-6
- Zhang C. Chapter 27 – Antimetastasis effect of anthraquinones from marine fungus, Microsporum sp. / C. Zhang, S.-K. Kim // Advances in Food and Nutrition Research. – –Vol. 65. – P. 415–421. doi.org/10.1016/B978-0-12-416003-3.00027-5
- Caldiran Z. I–V–T (current–voltage–temperature) characteristics of the Au/Anthraquinone/p-Si/Al junction device / Z. Caldiran, A. R. Deniz, F. M. Coskun and others // Alloys and Compounds. – 2014. – Vol. 584. – P. 652–657. doi.org/10.1016/j.jallcom.2013.09.006
- Пат. 2001004856 Южная Корея. Preparation of naphtoquinone and anthraquinone using oxidizing agent / H. S. Ju, Y. J. Ju, J. E. Kim, J. I. Won. 2001.
- Пат. 2000001821 Южная Корея. Method of manufacturing anthraquinone from 1,4-naphtoquinone and 1,3-butadiene / H. S. Ju, Y. J. Ju, J. E. Kim, J. I. Won, 2000.
- Kozhevnikov I. V. Catalysis by heteropoly acids and multicomponent polyoxometalates in liquid-phase reactions / I. V. Kozhevnikov // Chem. Rev. – 1998. – Vol. 98(1). – P. 171–198. doi:10.1021/cr960400y
- Zhizhina E. G. Homogeneous catalytic oxidation of propene to acetone and butene-1 to butanone in the presence of palladium and molybdovanadophosphoric heteropoly acid / E. G. Zhizhina, M. V. Simonova, V. F. Odyakov and others // Appl. Catal. A: General. – 2007. – Vol. 319. – P. 91–97. doi.org/10.1016/j.apcata.2006.11.024
- Жижина E. Г. Каталитические процессы окисления органических соединений кислородом в присутствии растворов Мо-V-фосфорных гетерополикислот / E. Г. Жижина, В. Ф. Одяков, M. В. Симонова // Кинетика и катализ. – 2008. – Т. 49(6). – С. 814–823.
- Пат. 2230612С1 Российская Федерация, МПК B01J23/44, B01J27/199, B01J27/26, C07C49/10. Катализатор и способ получения метилэтилкетона / Матвеев К. И., Жижина Е. Г., Одяков В. Ф.; заявитель и патентообладатель Институт катализа им. Г.К. Борескова Сибирского отделения Российской Академии наук. – № 20031090070/04; заявл. 31.03.03; опубл. 20.06.04, Бюл. № 17. – С. 389.
- Жижина E. Г. Каталитический синтез 9,10-антрахинона в присутствии растворов Мо-V-фосфорных гетерополикислот / E. Г. Жижина, M. В. Симонова, В. В. Русских и др. // Катализ в промышленности. – 2005. – № 1. – С. 12–17.
- Zhizhina E. G. Aqueous solutions of Mo-V-phosphoric heteropoly acids as bifunctional catalysts for preparation of 9,10-anthraquinone and its hydrogenated derivatives / E. G. Zhizhina, V. F. Odyakov // – 2012. – Vol. 4. – P. 1405–1410. doi: 10.1002/cctc.201200039
- Гогин Л. Л. Перспективы использования растворов Мо-V-фосфорных гетерополикислот в качестве бифункциональных катализаторов процессов получения антрахинона и его замещенных производных / Л. Л. Гогин, Е. Г. Жижина, З. П. Пай и др. // Известия РАН, Сер. хим. – – № 9. – С. 2069–2075.
- Жижина Е. Г. Каталитическое окисление 2,3,6-триметилфенола и 2-метилнафтола-1 в соответствующие пара-хиноны кислородом в присутствии растворов Mo-V-фосфорных гетерополикислот – ключевые стадии синтеза витаминов Е и К / Е. Г. Жижина, В. Ф. Одяков, К. И. Матвеев // Катализ в промышленности. – 2005. – № 6. – С. 19–27.
- Бартон Д. Общая органическая химия. Том 1. Стереохимия, углеводороды, галогенсодержащие соединения / Д. Бартон, У. Д. Оллис; под общ. ред. Н. К. Кочеткова. – М. : Химия, 1981. – 736 с.
Список литературы на английском языке / References in English
- Polotnyuk О.-V. Ya. K istorii stanovlenija v Sovetskom Sojuze pervogo proizvodstva antrahinona. Chast' 1. Razrabotka i vnedrenie promyshlennogo proizvodstva antrahinona okisleniem antracena kislorodom vozduha v nepodvizhnom sloe katalizatora [To the history of the first production of anthraquinone in the Soviet Union. Part 1. Development and implementation of industrial production of anthraquinone by the oxidation of anthracene with air oxygen in a fixed catalyst bed] / О.-V. Ya. Polotnyuk // Kataliz v promyshlennosti [Catalysis in Industry]. – 2013. – №. 5. – P. 59–65. [in Russian]
- Bien H.-S. Anthraquinone Dyes and Intermediates / H.-S. Bien, J. Stawitz, K. Wunderlich // Ullmann’s Encyclopedia of Industrial Chemistry. – 2000. – P. 137-153. doi:10.1002/14356007.a02_355
- Cofrancesco A. J. Anthraquinone / A. J. Cofrancesco // Kirk-Othmer Encyclopedia of chemical technology. – 2000. – P. 410-418.doi:10.1002/0471238961.0114200803150618.a01
- Chang J. B. Dichroic and spectral properties of anthraquinone-based azo dyes for PVA polarizing film / J. B. Chang, S. B. Yuk, J. S. Park and others // Dyes and Pigments. – 2012. – Vol. 92(1). – P. 737–744. doi.org/10.1016/j.dyepig.2011.06.024
- Valim R. Electrogeneration of hydrogen peroxide in gas diffusion electrodes modified with tert-butyl-anthraquinone on carbon black support / R. B. Valim, R. M. Reis, P. S. Castro and others // Carbon. – 2013. – Vol. 61. – P. 236–244. doi.org/10.1016/j.carbon.2013.04.100
- Abdel-Hamid A. M. Chapter One – Insights into lignin degradation and its potential industrial applications / A. M. Abdel-Hamid, J. O. Solbiati, I. K. O Cann // Advances in Appl. – 2013. – Vol. 82. – P. 1–28. doi.org/10.1016/B978-0-12-407679-2.00001-6
- Zhang C. Chapter 27 – Antimetastasis effect of anthraquinones from marine fungus, Microsporum sp. / C. Zhang, S.-K. Kim // Advances in Food and Nutrition Research. – – Vol. 65. – P. 415–421. doi.org/10.1016/B978-0-12-416003-3.00027-5
- Caldiran Z. I–V–T (current–voltage–temperature) characteristics of the Au/Anthraquinone/p-Si/Al junction device / Z. Caldiran, A. R. Deniz, F. M. Coskun and others // Alloys and Compounds. – 2014. – Vol. 584. – P. 652–657. doi.org/10.1016/j.jallcom.2013.09.006
- 2001004856 South Korea. Preparation of naphtoquinone and anthraquinone using oxidizing agent / H. S. Ju, Y. J. Ju, J. E. Kim, J. I. Won. 2001.
- 2000001821 South Korea. Method of manufacturing anthraquinone from 1,4-naphtoquinone and 1,3-butadiene / H. S. Ju, Y. J. Ju, J. E. Kim, J. I. Won, 2000.
- Kozhevnikov I. V. Catalysis by heteropoly acids and multicomponent polyoxometalates in liquid-phase reactions / I. V. Kozhevnikov // Chem. Rev. – 1998. – Vol. 98(1). – P. 171–198. doi:10.1021/cr960400y
- Zhizhina E. G. Homogeneous catalytic oxidation of propene to acetone and butene-1 to butanone in the presence of palladium and molybdovanadophosphoric heteropoly acid / E. G. Zhizhina, M. V. Simonova, V. F. Odyakov and others // Appl. Catal. A: General. – 2007. – Vol. 319. – P. 91–97. doi.org/10.1016/j.apcata.2006.11.024
- Zhizhina E. G. Kataliticheskie processy okislenija organicheskih soedinenij kislorodom v prisutstvii rastvorov Mo-V-fosfornyh geteropolikislot [Catalytic processes of oxidation of organic compounds by oxygen in the presence of solutions of Mo-V-phosphoric heteropoly acids] / E. G. Zhizhina, V. F. Odyakov, M. V. Simonova // Kinetika i kataliz [Kinet. Catal.]. – 2008. – Vol. 49(6). – P. 814–823. [in Russian]
- 2230612С1 Russian Federation, MPK B01J23/44, B01J27/199, B01J27/26, C07C49/10. Katalizator i sposob poluchenija metiljetilketona [Catalyst and method for producing methyl ethyl ketone] / Matveev K. I., Zhizhina E. G., Odyakov V. F.; the applicant and the patentee Boreskov Institute of Catalysis SB RAS. – № 20031090070/04; appl. 31/03/03; publ. 20.06.04, Bul. Number 17. – P. 389. [in Russian]
- Zhizhina E. G. Kataliticheskij sintez 9,10-antrahinona v prisutstvii rastvorov Mo-V-fosfornyh geteropolikislot [Catalytic synthesis of 9,10-anthraquinone in the presence of solutions of Mo-V-phosphoric heteropoly acids] / E. G. Zhizhina, M. V. Simonova, V. V. Russkikh and others // Kataliz v promyshlennosti [Catalysis in Industry]. – 2005. – № 1. – С. 12–17. [in Russian]
- Zhizhina E. G. Aqueous solutions of Mo-V-phosphoric heteropoly acids as bifunctional catalysts for preparation of 9,10-anthraquinone and its hydrogenated derivatives / E. G. Zhizhina, V. F. Odyakov // – 2012. – Vol. 4. – P. 1405–1410. doi: 10.1002/cctc.201200039
- Gogin L. L. Perspektivy ispol'zovanija rastvorov Mo-V-fosfornyh geteropolikislot v kachestve bifunkcional'nyh katalizatorov processov poluchenija antrahinona i ego zameshhennyh proizvodnyh [Prospects of application of Mo-V-phosphoric heteropolyacid solutions as bifunctional catalysts for syntheses of anthraquinones and their substituted derivatives] / L. Gogin, E. G. Zhizhina, Z. P. Pai and others // Izvestija RAN, Serija himicheskaja [Russian Chemical Bulletin, International Edition]. – 2015. – Vol. 64(9). – С. 2069–2075. [in Russian]
- Zhizhina E. G. Kataliticheskoe okislenie 2,3,6-trimetilfenola i 2-metilnaftola-1 v sootvetstvujushhie para-hinony kislorodom v prisutstvii rastvorov Mo-V-fosfornyh geteropolikislot – kljuchevye stadii sinteza vitaminov E i K [The catalytic oxidation of 2,3,6-trimethylphenol and 2-methylnaphthol-1 to the corresponding paraquinones with oxygen in the presence of solutions of Mo-V-phosphoric heteropoly acids is the key stages in the synthesis of vitamins E and K] / E. G. Zhizhina, V. F. Odyakov, К. I. Matveev // Kataliz v promyshlennosti [Catalysis in Industry]. – 2005. – № 6. – P. 19–27. [in Russian]
- Barton D. Obshhaja organicheskaja himija. Tom 1. Stereohimija, uglevodorody, galogensoderzhashhie soedinenija [General organic chemistry. Volume 1. Stereochemistry, hydrocarbons, halogenated compounds] / D. Barton, Y. D. Ollis ; edited by N. K. Kochetkova. –: Himija, 1981. – 736 p. [in Russian]
