КОМПОЗИЦИОННЫЕ ПОЛИМЕРНЫЕ МАТЕРИАЛЫ НА ОСНОВЕ ФТОРПОЛИМЕРА С НАПОЛНИТЕЛЕМ Li2SiF6
Дружинин К.В.1, Стельмах Л.С.2
1 Кандидат химических наук, ФГБУН "Институт высокотемпературной электрохимии Уральского отделения Российской академии наук", ФГБОУ "Уральский федеральный университет имени первого Президента России Б.Н. Ельцина", 2 Бакалавр, Уральский Федеральный университет
Работа выполнена при поддержке гранта президиума УрО РАН № 15-20-3-19
КОМПОЗИЦИОННЫЕ ПОЛИМЕРНЫЕ МАТЕРИАЛЫ НА ОСНОВЕ ФТОРПОЛИМЕРА С НАПОЛНИТЕЛЕМ Li2SiF6
Аннотация
В статье представлены данные о получении плёночных материалов на основе фторполимера и литиевой соли, включая структурообразование и данные по электропроводности полученных образцов.
Ключевые слова: композиционный полимерный материал, электропроводность.
Druzhinin K.V.1, Stelmah L.S.2
1PhD in Chemistry, Institute of High-Temperature Electrochemistry of Ural Branch of RAS, Ural Federal University, 2Bachelor, Ural Federal University
COMPOSITE POLYMER MATERIALS BASED ON FLUORINATED POLYMER AND Li2SiF6 FILLER
Abstract
The article considers data of preparation of fluorinated polymer films with lithium salt filler. Data include structure of films and conductivity measurement of samples.
Keywords: composite polymer material, electrical conductivity.
Разработка новых функциональных материалов для литий-ионных аккумуляторов является актуальной задачей научного электрохимического сообщества. В частности, ведётся поиск и новых литий-проводящих соединений, которые могут служить электролитом. С точки зрения повышения безопасности и устойчивости при нестандартных условиях эксплуатации источников тока, поиск твердофазных электролитов, являющихся одновременно и сепараторами в литий-ионных аккумуляторах, представляет собой достаточно важную задачу. При замене жидкого электролита на полностью твердофазный полимерный электролит, мы получим ряд преимуществ, таких как:
- Существенное снижение размеров и веса — возможность изготовления батарей размером и толщиной с кредитную карточку, из-за уменьшения расстояния между катодом и анодом. Металлический корпус необязателен, так как материал не вскипает и не протекает;
- Безопасность при механических воздействиях (на разлом, на прокол);
- Улучшенная пожаробезопасность — аккумулятор более стоек к перегрузкам, не подвержен утечкам электролита, используется нетоксичный материал, устойчивый к более высоким рабочим температурам.
Твердые полимерные электролиты (ТПЭ) представляют собой растворы солей в полимерной матрице, выступающей в качестве макромолекулярного растворителя. Обязательным условием образования такого раствора является наличие в полимере полярных групп. В этом случае полимер способен растворять в себе соли до высоких концентраций [1].
Основным недостатком использования твердых полимерных электролитов является их термодинамическая неустойчивость. Даже несмотря на достаточно высокие величины проводимости, такие системы, как правило, недолговечны и пока не находят массового применения в циклируемых устройствах. Нередко причиной ухудшения характеристик ТПЭ в ходе циклирования становится выпадение неорганического компонента в осадок. Выпадающая в осадок соль-ионоген также может являться проводником по катионам лития, но, очевидно, что нарушение сплошности ограничивает транспорт катионов через объём электролита.
В случае композиционных твёрдых электролитов известен эффект повышения электропроводности катионного проводника при добавлении к нему нанодисперсного непроводящего порошка [2]. Это явление получило название «композиционный эффект» и, чаще всего, является следствием положительного влияния процессов на границе гранул компонентов композита на облегчение миграции заряженных частиц. Такой эффект был позже обнаружен и для смеси катионных проводников. Это приводит к заключению о возможности использования композиционного эффекта и для случая системы твёрдый полимерный электролит, находящийся в равновесии с неорганической фазой собственной соли-ионогена.
Целью работы является изготовление и исследование структуры полимерного материала с растворённой в нём литиевой неорганической солью при разном содержании соли.
Матрицей полимерного электролита был выбран фторопласт-62 из-за его высокой термической (Tпл = 130-150 °С [3]) и химической устойчивости [4].
Двойные фториды привлекают внимание исследователей благодаря тому, что эти соли отлично зарекомендовали себя в составе жидких электролитов классических литий-ионных аккумуляторов. Наиболее распостраненной солью-ионогеном является фторфосфат лития LiPF6. Жидкие электролиты на основе этой соли обладают высокой электропроводностью, однако сама соль является термодинамически неустойчивой и требует тщательного подбора органического растворителя для повышения стабильности электролита [5]. В связи с этим активно идёт поиск новых солей-ионогенов не только для твёрдополимерных, но и для жидких электролитов. В первую очередь рассматриваются ближайшие аналоги LiPF6, хорошие результаты в жидком электролите показал фторарсенат лития LiAsF6 [6], в твердополимерных и жидких растворителях большие надежды подаёт борфтористый литий LiBF4. Для изготовления полимерного электролита был выбран кремнефтористый литий Li2SiF6 из-за его более высокой химической и термической устойчивости по сравнению с LiPF6, обычным ионогеном в жидких электролитах. Данное исследование проводится в рамках цикла исследований полимерных электролитов с солями-ионогенами – двойными фторидами лития. Предварительно была исследована система Ф-62 – LiPF6 [7]. Результаты исследований показали, что электропроводность твердополимерных электролитов несколько ниже жидкофазных электролитов с той же солью-ионогеном, однако оставляют надежду на возможность нахождения системы с более высокими характеристиками среди аналогов гексафторфосфата лития.
Методики эксперимента
Композиционные пленки готовили методом полива из совместного раствора полимера и литиевой соли. Методика является стандартной для изготовления полимерных плёнок и описана подробно в [7]. В качестве растворителя брали ацетонитрил H3C-CN марки «осч» сорт 0. Растворитель предварительно подвергали перегонке и очистке от следов воды молекулярными ситами. Чистоту растворителя контролировали с помощью ИК-спектроскопии. Все операции с исходными компонентами и полученными плёнками проводили в сухом аргоновом боксе.
Рис. 1 - Полимерный электролит в виде пленки
Для рентгенофазового анализа образцов использовали дифрактометр Rigaku с вертикальным гониометром, Cu Kα-излучение, интервал 2θ = 15-80°. Неорганические компоненты и их кристаллические параметры определяли по набору характерных рефлексов. Для идентификации соединений использовали «базу порошковых стандартов JCDPS» (версия 2005г.).
Полимерный компонент на дифрактограммах проявлялся в виде аморфного гало в районе 2θ = 15-25°. Рентгенографические параметры кристаллических компонентов вычисляли с помощью программного обеспечения DMAX 2000 для дифрактометра Rigaku.
ИК-спектроскопическое исследование образцов полимерных плёнок проводили со съёмкой сигнала на отражение. Съемку спектров вели на спектрометре Tensor 27 Bruker с призмой KBr (область частот 400-4000 см-1). ИК-спектры исходные органические компоненты сравнивали с литературными спектрами из базы данных к программному обеспечению прибора (фирма Netzch). Характерные пики органических компонентов находили в области 600 – 4000 см-1.
Макроструктуру плёнок (распределение частиц неорганической фазы в объёме полимера) определяли с помощью оптического микроскопа AmScope B100B-MS-P (США), съёмку вели при увеличении 40x. Источник света располагался под предметным столиком, съёмку образцов вели на просвет, таким образом тёмные пятна на фотографиях представляют собой силуэт объекта, состоящего из оптически непрозрачного материала, в нашем случае – частиц неорганической соли. Полимерный материал является оптически прозрачным.
Измерения электропроводности проводили методом импеданс-спектроскопии, измеритель иммитанса Е7-25 МНИПИ (г.Минск, Беларусь), диапазон частот 25 – 106 Гц, внешнее напряжение 0,04В.
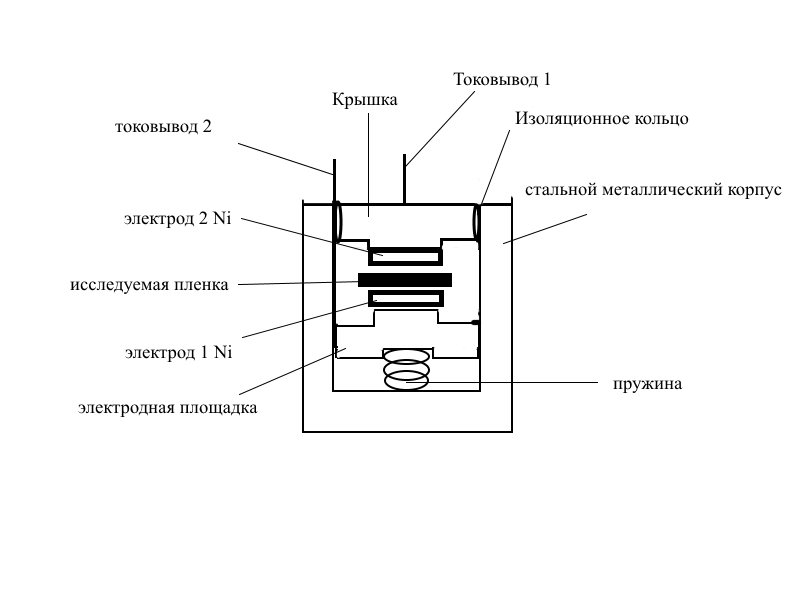
Измерительная ячейка схематически представлена на рисунке 2. Измерения проводили двухэлектродным способом на индифферентных никелевых электродах.
Исследование электронной составляющей проводимости проводили методом циклической вольтамперометрии с помощью потенциостата-гальваностата P30-I, Elins, Черноголовка. Измерения проводили на плёнках разной толщины, что позволило в итоге вычесть поляризационное сопротивление и определить характеристики непосредственно электролита. Измерения проводили в той же измерительной ячейке, что и измерения методом импеданс-спектроскопии, на тех же никелевых электродах, блокирующих перенос ионов лития и обеспечивающих перенос только электронов.
Рис. 2 - Схема измерительной ячейки
Результаты
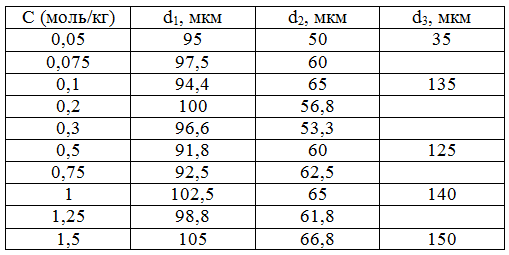
Составы изготовленных плёнок с указанием толщины образцов сведены в таблицу 1.
Таблица 1. - Перечень составов исследованных плёнок (указано содержание неорганической соли на массу полимерной матрицы) с указанием толщины изготовленных плёнок.
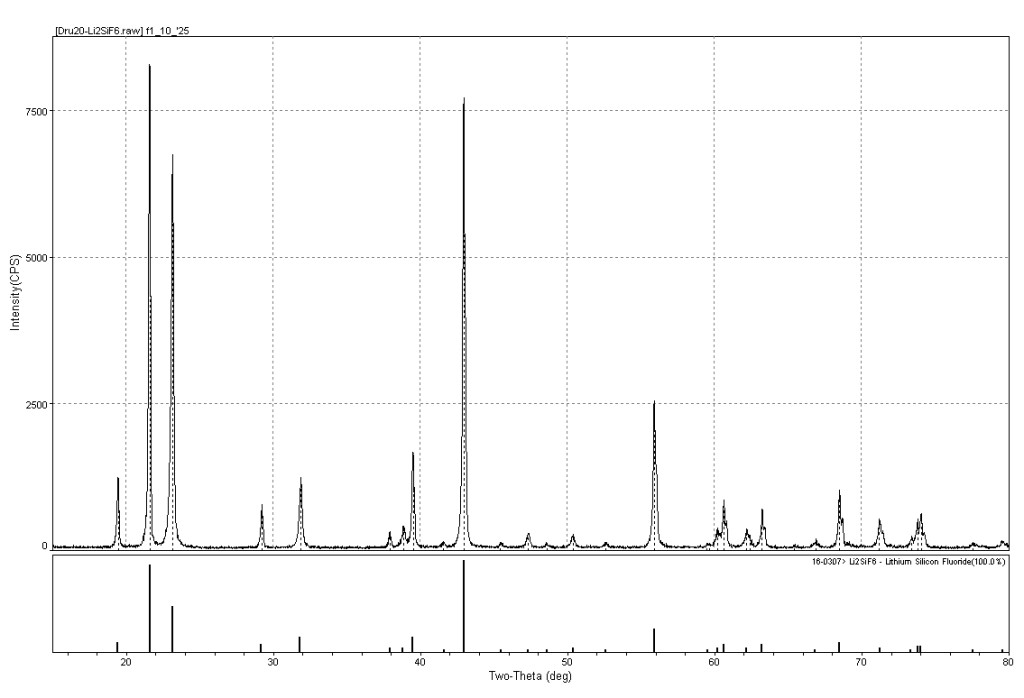
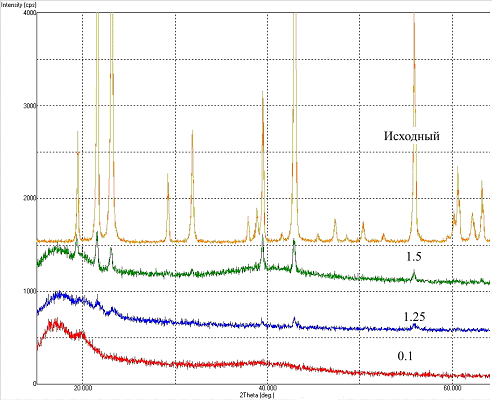
На рис.3 представлен спектр исходного порошка Li2SiF6 в сравнении с литературным спектром этого соединения из базы данных JCPDS. На рис.4 представлены спектры изготовленных полимерных плёнок с разными концентрациями введённой соли в сравнении со спектром сходного порошка кремнефтористого лития. На спектрах плёнок отчётливо видны пики исходного неорганического компонента, их интенсивность возрастает с увеличением содержания соли. Помимо этого, на спектрах присутствует гало (15 – 25 °), соответствующее полмерному материалу.
Рис. 3 - Cпектр исходного порошка Li2SiF6 в сравнении с литературным спектром
Спектры ИК полимерных плёнок с различным содержанием кремнефтористого лития практически неотличимы по положениям пиков от спектра исходного чистого полимера Ф-62. По совокупности данных РФА и ИКС можно сделать вывод об отсуствии какого-либо взаимодействия между компонентами в изготовленных плёнках.
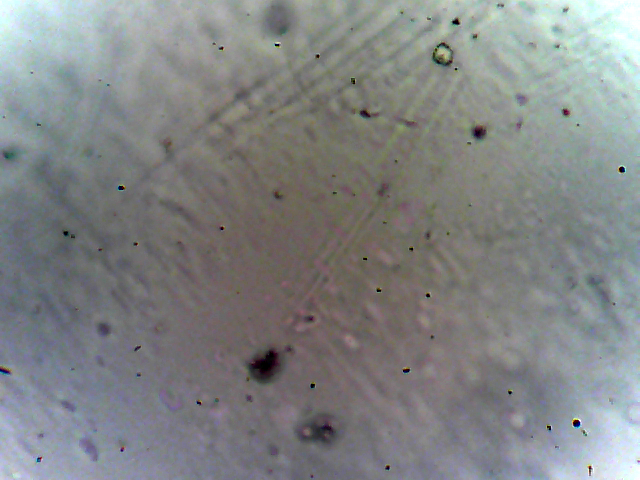
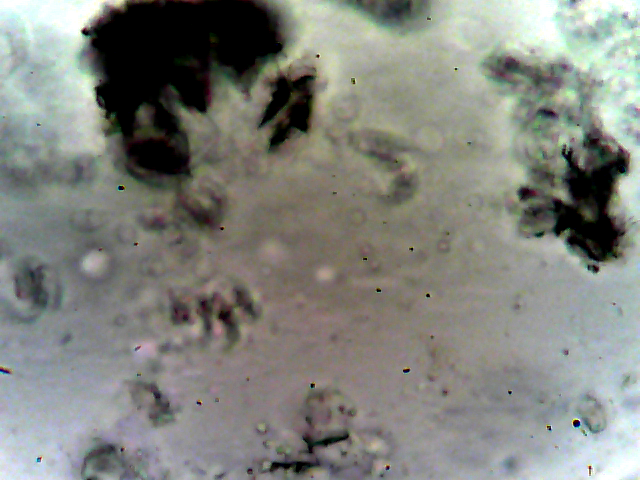
На всех микрофотографиях плёнок, даже при минимальных содержаниях неорганического компонента видны кристаллы непроводящей фазы, см. рисунок 5. С увеличением содержания неорганического компонента, размер его зёрен увеличивается от единиц до сотни микрометров. Верхний предел лимитируется толщиной изготавливаемой плёнки, при этом все кристаллы находятся не на поверхности плёнки, а в её объёме, то есть защищены от контакта с компонентами воздуха.
Рис. 4 - Спектры изготовленных полимерных плёнок с разными концентрациями (0,1; 1,25 и 1,5 моль/кг) введённой соли в сравнении со спектром исходного порошка
 |
 |
 |
| а) | б) | в) |
Рис. 5 - Образцы микрофотографий пленок Li2SiF6 с содержанием литиевой соли 0,05 моль/кг (а), 0,5 моль/кг (б) и 1,5 моль/кг (в). Увеличение 40x
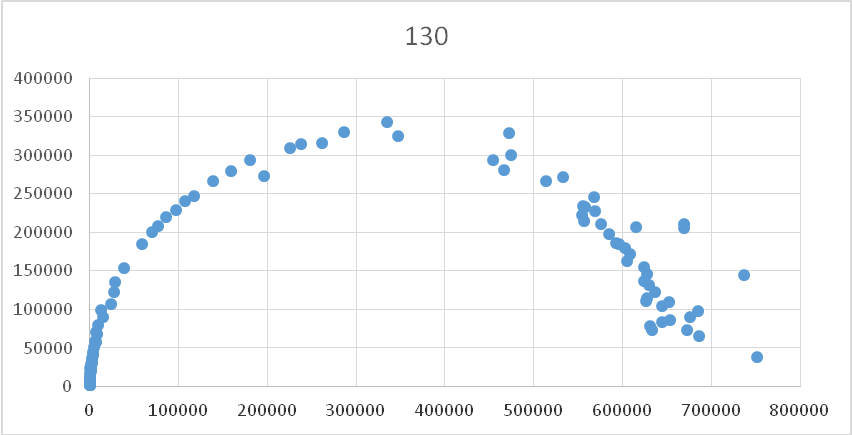
Полученные годографы импеданса, как правило, имели вид полностью законченнной или незаконченной полуокружности, выходящей из начала координат (образец представлен на рис.6). На пересечении годографа с осью координат (R,0) получаем значение, соответствующее сопротивлению ячейки. Во всех случаях эта велличина оказалась настолько большой, что сопротивлением электродов и проводов можно пренебречь и считать эту величину сопротивлением электролита.
Рис. 6 - Образец годографа импеданса для плёнки с содержанием Li2SiF6 0,5 моль/кг при температуре 130 °С.
Поскольку полученные методом импеданс-спектроскопии значения электропроводности очень низки, есть вероятность, что большой вклад в электропроводность вносит перенос электронов. Для проверки этого утверждения были проведены исследования проводимости методом циклической вольтамперометрии. Определённые по вольтамперограммам величины сопротивления ячейки с плёнкой электролита разной толщины при соответствующих температурах соотносили по простому уравнению:
ρ = S·(R2 – R1)/(l2 – l1),
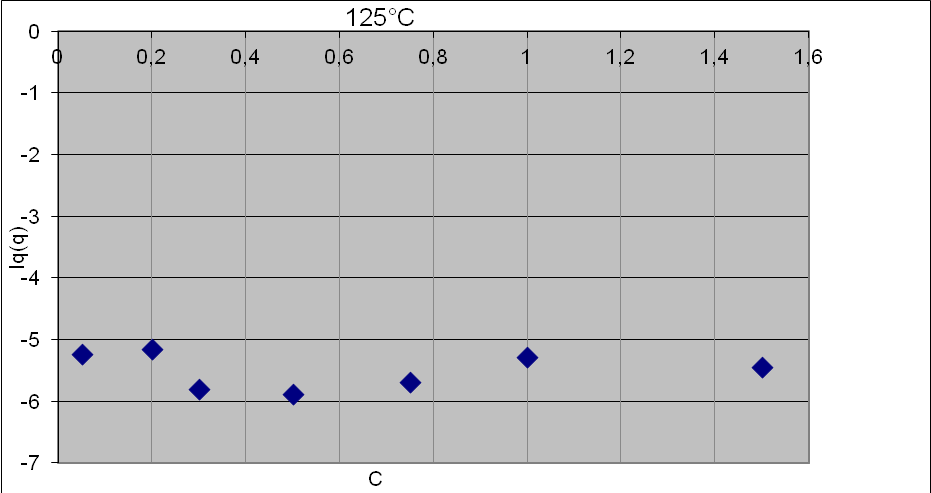
Вычисленные таким образом величины удельного сопротивления практически совпадают с определёнными методом импеданс-спектроскопии, из чего следует вывод, что вся электропроводность через материал является электронной. При этом, значения электропроводности совпадают с чистой электронной проводимостью полимерной матрицы (10-10 См/см при комнатной температуре). Значения электропроводности практически не зависят от содержания неорганического компонента (см. рис.7). Температурные зависимости электропроводности всех плёнок практически линейны в координатах уравнения Аррениуса (электропроводность возрастает с температурой).
Рис.7 - Зависимость логарифма электропроводности при температуре 125 °С от содержания литиевой соли.
Причину такого значительного различия в поведении гексафторфосфата и гексафторсиликата лития в полимерной матрице, очевидно, следует искать в энергии связи литий – фтористый анион. Согласно расчётным литературным данным, энергия связи илитя с гексафторсиликат-ионом составляет порядка 400 ККал/моль [8], что более чем в два раза больше соответствующей энергии связи для гексафторфосфата лития (около 135 ККал/моль)
Заключение
По совокупности данных рентгенофазового анализа, инфракрасной спектроскопии и оптической микроскопии можно сделать вывод, что между компонентами нет никакого взаимодействия, в том числе и взаимной растворимости. Весь Li2SiF6 выпадает в осадок, ионов Li+ в пленках не образуется.
По графику концентрационной зависимости электропроводности можно судить о том, что электропроводность, в пределах погрешности измерений, не зависит от количества введенной литиевой соли.
Выводы
- Изготовлены плёнки твердофазных композиционных полимерных материалов системы фторопласт-62 – гексафторсиликат лития Li2SiF6. Комбинацией методов рентгенофазового анализа, инфракрасной спектроскопии и оптической микроскопии исследована растворимость соли в полимерной матрице.
- Определено, что исследованная соль не растворяется в полимерной матрице, а выпадает в осадок в виде кристаллов, размер которых лимитируется вязкостью полимера.
- Методами импеданс-спектроскопии и циклической вольтамперометрии исследована электронная и общая электропроводность плёнок. Показано, что электронная проводимость вносит значительный вклад в общую проводимость и практически сравнивается с электронной проводимостью чистой полимерной матрицы.
Литература
- Dias F.B., Plomp L., Veldhuis J.B.J. Trends in polymer electrolytes for secondary lithium batteries // J.Pow.Sour., 2000, v.88, pp. 169-191.
- Nagasubramanian G., Attia A.I., Halpert G., Peled. E. Composite solid electrolyte for Li battery application // Electrochemical society meeting, Toronto, Canada, 1992, pp.311-313.
- Данные производителя ОАО "ФторПолимер" [Электронный ресурс]. Режим доступа: http://www.ftorpolymer.ru/fluorpolymers.html
- Бюллер К.У. Тепло- и термостойкие полимеры. Пер. с нем. – М.: Химия. 1984. 1056 с.
- Edstrom K., Gustaffson T., Thomas J. The cathode-electrolyte interface in lithium-ion. / in Lithium-ion batteries: Solid-electrolyte interphase ed. by P. Balbuena, Y. Wang, World Scientific, Singapore, 2004.
- Moumouzias G., Ritzoulis G., Siapkas D., Terzidis D. Comparative study of LiBF4, LiAsF6, LiPF6 and LiClO4 as electrolytes in propylene carbonate-diethyl carbonate solutions for Li/LiMn2O4 cells // J.Pow.Sour., 2003, v.122, №1, pp.57-66.
- Druzhinin K.V. Composite polymer electrolytes based on lithium salts: solubility and conductivity // Chemical bulletin of KazNU, 2014, №3, pp.3-11.
- Liivat A., Aabloo A., Thomas J.O. Development of a force field for Li2SiF6. // Journal of comp. chem., 2005, v.26, №7, pp.716-724.
References
- Dias F.B., Plomp L., Veldhuis J.B.J. Trends in polymer electrolytes for secondary lithium batteries // J.Pow.Sour., 2000, v.88, pp. 169-191.
- Nagasubramanian G., Attia A.I., Halpert G., Peled. E. Composite solid electrolyte for Li battery application // Electrochemical society meeting, Toronto, Canada, 1992, pp.311-313.
- Producer data from: http://www.ftorpolymer.ru/fluorpolymers.html / ОАО "ФторПолимер".
- Bueller K.U. Heat- and thermostable polymers М.: Khimiya. 1984. 1056 p.
- Edstrom K., Gustaffson T., Thomas J. The cathode-electrolyte interface in lithium-ion. / in Lithium-ion batteries: Solid-electrolyte interphase ed. by P. Balbuena, Y. Wang, World Scientific, Singapore, 2004.
- Moumouzias G., Ritzoulis G., Siapkas D., Terzidis D. Comparative study of LiBF4, LiAsF6, LiPF6 and LiClO4 as electrolytes in propylene carbonate-diethyl carbonate solutions for Li/LiMn2O4 cells // J.Pow.Sour., 2003, v.122, №1, pp.57-66.
- Druzhinin K.V. Composite polymer electrolytes based on lithium salts: solubility and conductivity // Chemical bulletin of KazNU, 2014, №3, pp.3-11.
- Liivat A., Aabloo A., Thomas J.O. Development of a force field for Li2SiF6. // Journal of comp. chem., 2005, v.26, №7, pp.716-724.