Оценка терапевтического потенциала микровезикул из мезенхимных стволовых клеток при моделировании остеоартроза на крысах
Оценка терапевтического потенциала микровезикул из мезенхимных стволовых клеток при моделировании остеоартроза на крысах
Аннотация
В настоящее время методы терапии на основе мезенхимных стволовых клеток (МСК) применяются в медицине и ветеринарии повсеместно. Однако, несмотря на эффективность МСК, все же имеется ряд ограничений при их использовании, таких как эктопическая дифференцировка, образование опухолей и генетическая нестабильность. Для преодоления этих ограничений в настоящее время часто используют микровезикулы (МВ) из МСК или других клеток. Данная работа посвящена исследованию влияния МВ из МСК жировой ткани лошади для лечения остеоартроза (ОА) лошадей. В этой работе МВ применяли при моделировании остеоартроза на крысах. Эффективность МВ оценивали при помощи гистологии менисков коленного сустава. Проведенные эксперименты показали, что МВ значительно улучшают состояние хрящевой ткани мениска.
1. Введение
Остеоартроз — это хроническое заболевание суставов, которое характеризуется дегенерацией суставного хряща с потерей матрикса, фибрилляцией, образованием трещин и в конечном итоге полной потерей хрящевой поверхности . ОА одна из частых причин хромоты у животных. Для лошадей это заболевание приносит весьма ощутимый урон, при чем урон не столько из-за стоимости лечения, сколько из-за восстановления до соревновательных кондиций . По статистике заболеваний суставов у лошадей остеоартроз встречается крайне часто. Особой уязвимостью характеризуются путовой, коленный и локтевой суставы. Данные показывают, что примерно у 60% лошадей ОА является причиной всех случаев хромоты . Основной причиной развития ОА является повреждение суставного хряща. Суставной хрящ может быть поврежден в результате обычного износа или патологических процессов, таких как аномальная механическая нагрузка или травма. На ранних стадиях ОА поверхность хряща остается неповрежденной. Сначала изменяются молекулярный состав и организация внеклеточного матрикса . Суставные хондроциты, которые обладают небольшой регенеративной способностью и имеют низкую метаболическую активность в нормальных суставах, демонстрируют транзиторную пролиферативную реакцию и повышенный синтез матрикса (Col2, аггрекан и т. д.), пытаясь инициировать восстановление, вызванное патологической стимуляцией. Этот ответ характеризуется клонированием хондроцитов с образованием кластеров и гипертрофической дифференцировкой, включая экспрессию гипертрофических маркеров, таких как Runx2, ColX и Mmp13. Изменения в составе и структуре суставного хряща дополнительно стимулируют хондроциты к производству большего количества катаболических факторов, участвующих в деградации хряща. По мере разрушения протеогликанов, а затем и коллагеновой сети, целостность хряща нарушается. Суставные хондроциты затем подвергаются апоптозу, и суставной хрящ в конечном итоге полностью исчезает. Сужение суставного пространства, вызванное полной потерей хряща, приводит к трению между костями, что приводит к боли и ограничению подвижности суставов .
ОА является трудноизлечиваемым заболеванием. Современные стратегии лечения остеоартроза в основном направлены на устранение симптомов. Наиболее часто используемыми методами лечения являются использование кортикостероидов, нестероидных противовоспалительных препаратов, гиалуроновой кислоты и полисульфатированного гликозаминогликана . Эти препараты не останавливают прогрессирование заболевания и, как правило, не предусматривают комплексных стратегий, направленных на патогенез ОА .
В настоящее время в медицине и ветеринарии практикуется использование клеточных методов терапии, включающих мезенхимные стволовые клетки (МСК), а также используют микровезикулы (МВ), полученные из МСК. Этот метод лечения в настоящее время считается инновационным. В литературе описаны случаи применения МВ в лечении многих заболеваний, в том числе и ОА. Однако этот метод лечения находится на начальных этапах исследования. МВ в ветеринарии апробированы в опытах in vitro и in vivo .
Цель настоящего исследования продемонстрировать эффективность микровезикул из мезенхимных стволовых клеток, полученных при помощи цитохалазина Б при моделировании ОА в опытах in vivo.
2. Методы и принципы исследования
2.1. Одобрение этического комитета
Протокол данного исследования был одобрен Экспертным комитетом по биомедицинской этике Казанского федерального университета (Протокол 3, дата 5 мая 2015 г.) в соответствии как с институциональными, так и с международными этическими рекомендациями ARRIVE.
2.2. Получение МСК лошади
МСК были выделены из жировой ткани лошади. Жировую ткань получили в ветеринарной клиники Казанского ипподрома. Работа по выделению и культивированию клеток проводили в условиях лаборатории. Жировую ткань очищали от соединительной ткани, промывали фосфатным буферизованным физиологическим раствором (PBS, Панэко, Россия) и измельчали вручную. Измельченную ткань инкубировали 1 ч в шейкере-инкубаторе с 0,2% коллагеназой краба. Далее для осаждения клеток проводили центрифугирование, супернатант сливали, осадок ресуспендировали в физиологическом растворе. Клетки осаждали при помощи центрифуги в течение 10 мин при 800 g. Отмытый осадок клеток повторно суспендировали в среде для выращивания, состоящей из DMEM-Glutamax I (high glucose, Панэко, Россия) с добавлением 10% сыворотки плодов коров (FВS, Панэко, Россия) и 1% пенициллина-стрептомицина, и высевали на фласки. Через 24 ч прикрепившиеся клетки отмывали физиологическим раствором и полученную культуру клеток поддерживали в ростовой среде (10%FBS, DMEM: F12, L- глутамин, антибиотики) в увлажненной атмосфере 95% О2 и 5% CO2. Смену среды проводили через 3 дня.
2.3. Получение МВ из МСК лошади
Получение МВ из культуры клеток МСК лошади осуществляли по методике, опубликованной ранее [9]. При получении культурой клеток плотности монослоя 90%, отбирали питательную среду, дважды промывали культуру от остатков среды с помощью PBS. Клетки открепляли с культурального пластика при помощи 0,25% раствора трипсина-ЭДТА (ПанЭко, Россия), затем отмывали клетки PBS. Полученную суспензию инкубировали в DMEM без сыворотки крови, содержащей 10 μг/мл цитохалазина B (Sigma-Aldrich, США) в течение 30 мин при 37°С во влажной атмосфере, содержащей 5% CO2. Далее осуществляли серию последовательных центрифугирований: 500 об/мин 10 мин, супернатант отбирали и центрифугировали 500 об/мин 20 минут, супернатант отбирали и центрифугировали 3000 об/мин 25 минут. Осадок, содержащий МВ, отмывали большим количеством PBS, центрифугируют при 3000 об/мин 25 минут. Полученный осадок МВ использовали далее в работе.
2.4. Фенотипирование полученных клеток
Принадлежность клеток к клеточному пулу стволовых клеток определяли при помощи методов иммуноцитохимии. Для этого применяли антитела: CD 44 (Biolegend, clone IM7, USA), CD 90 (Sony Biotechnology, cat № 1612630, USA). В качестве отрицательного контроля окрашивали антителами к CD 34 (ICO115) (Santa Cruz, sc-7324, USA), CD 45 (BioLegend, cat №202205, USA). Анализ результатов производили при помощи проточного цитофлюориметра Guava EasyCyte 8HT (Millipore, USA). Результат проточной цитометрии выражен в % от общего числа клеток в образце (не менее 100 тыс. клеток на 1 аликвоту).
Также для подтверждения биологической активности выделенных клеток проводили дифференцировку в 3 направлениях (остеогенном, хондрогенном, адипогенном) по методике, описанной ранее . Фиксировали результаты дифференциации с помощью инвертированного микроскопа AxioObserver Z1 (Carl Zeiss, Германия).
2.5. Воспроизведение модели остеоартроза
ОА воспроизводили на крысах самцах линии Вистар массой 300-350 г. ОА воспроизводили хирургическим путем. Хирургические манипуляции проводили под общей анестезией с использованием Золетила 100 (Virbac, Франция) и Ксилазина (Nitr-Pharm, Россия). Для обезболивания использовали Мелоксидин (Промветсервис, Беларусь). ОА вызывали путем рассечения медиальной коллатеральной связки. Для этого медиальный мениск захватывали кровоостанавливающим зажимом и отрезали проксимально по направлению к бедренной кости. Мениск рассекали скальпелем или маленькими хирургическими ножницами. Кожа ушивалась шелковыми нитками 4-0.
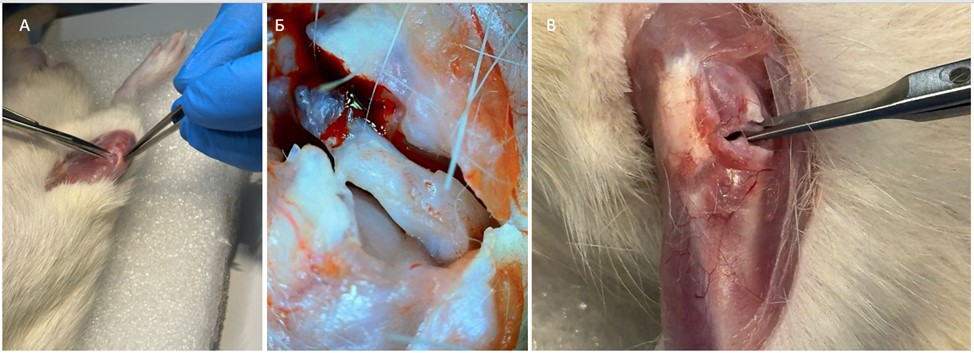
Рисунок 1 - Хирургическая индукция ОА:
А – рассечения мягких тканей для доступа к коленному суставу; Б – доступ к мениску после перерезки коллатеральной медиальной связки; В – перерезка медиального мениска
Для оценки терапевтического эффекта МВ вводились внутрисуставно через 10 суток после проведения операции. В качестве исследуемый дозы использовали МВ, полученную из 1 млн МСК.
Эффективность МВ оценивали при помощи гистологических методов. Для этого мениски извлекались из коленного сустава на 7, 14, 21, 42 сутки после введения МВ и окрашивали при помощи гематоксилин эозина и по Маллори.
2.6. Окраска менисков при помощи гематоксилин эозина
Для детальной оценки структуры хрящевой ткани мениска проводили окраску при помощи гематоксилин эозина. Для этого проводили забор ткани менисков оперированной конечностей и фиксировали в 10% нейтральном формалине на 0,2 М фосфатном буфере (рН=7,4) в течение 24 часов. После завершения процесса проводили заливку образцов в парафин с использованием автоматического гистологического процессора для заливки тканей STP 420 ES (Thermo Scientific). Парафиновые срезы толщиной 3–5 мкм получали на роторном микротоме microm HM 366S (Thermo Scientific). Затем препараты высушивали в течение 24 часов в термостате при 37°С, депарафинировали, регидратировали и окрашивали различными методами в соответствии с протоколом эксперимента. Для окрашивания использовали гематоксилин Майера и 1% водный раствор эозина. После депарафинизации и регидратации срезы инкубировали 60 секунд с раствором гематоксилина, затем дифференцировали окраску в водопроводной воде (5 минут). Далее на 30–60 секунд на срезы наносили раствор эозина, после чего промывали в дистиллированной воде и заключали в глицерин желатин.
2.7. Окраска менисков по Маллори
Для оценки влияния на соединительнотканные макромолекулы использовали набор по Маллори. Для этого после подготовки хрящевой ткани описанной выше проводили окраску при помощи набора по Маллори (Биовитрум, Россия). После депарафинизации срезы инкубировали 10 минут с раствором карболового фуксина с последующей промывкой в дистиллированной воде. Затем на 2 минуты наносили кислотный буфер и быстро промывали в проточной воде, после чего наносили раствор фосфорномолибденовой кислоты на 5 минут и после не промывая, наносили полихромный раствор по Маллори на 1 минуту. После промывки в дистиллированной воде срезы дегидратировали в спиртах восходящей концентрации с одноминутной задержкой в последнем, затем просветляли в ксилоле и заключали в полистирол (БликМедикал- Продакшн, Россия).
3. Основные результаты
Результаты исследований показали, что клетки, выделенные из жировой ткани лошади, имели характерные маркеры МСК, при этом маркеры гематопоэтических стволовых клеток отсутствовали (рис 2).
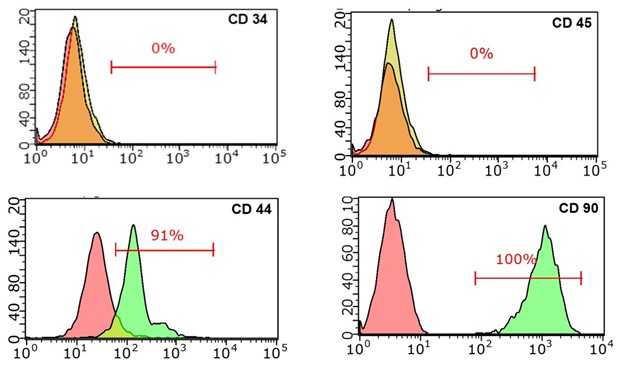
Рисунок 2 - Анализ, полученных мезенхимных стволовых клеток с помощью иммуноокрашивания и проточного цитофлуориметра
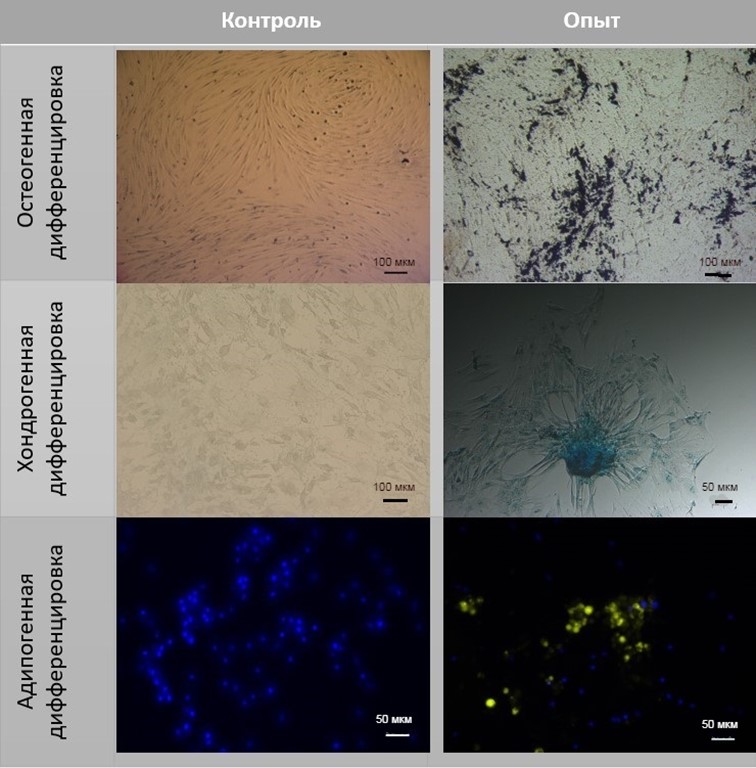
Рисунок 3 - Анализ способности к дифференцировки мезенхимных стволовых клеток
Примечание: окрашивание проводили с помощью красителей Nile Red (адипогенная дифференцировка), ализариновый красный (остеогенная дифференцировка), альциановый синий (хондрогенная дифференцировка)
Исследования показали, что в зоне повреждения отмечается дезорганизованный внеклеточный матрикс на всех экспериментальных сроках. При этом отмечается большое количество жировой ткани. После введения МВ на 7 и 14 день эксперимента также отмечается большое количество жировой ткани. На 21 сутки отмечается повышение клеточности, что говорит о начинающихся процессах регенерации. При окраске по Маллори видно, что на 21 сутки уплотняется внеклеточной матрикс. К 42 суткам в зоне повреждения сохраняется небольшая дезорганизация матрикса.
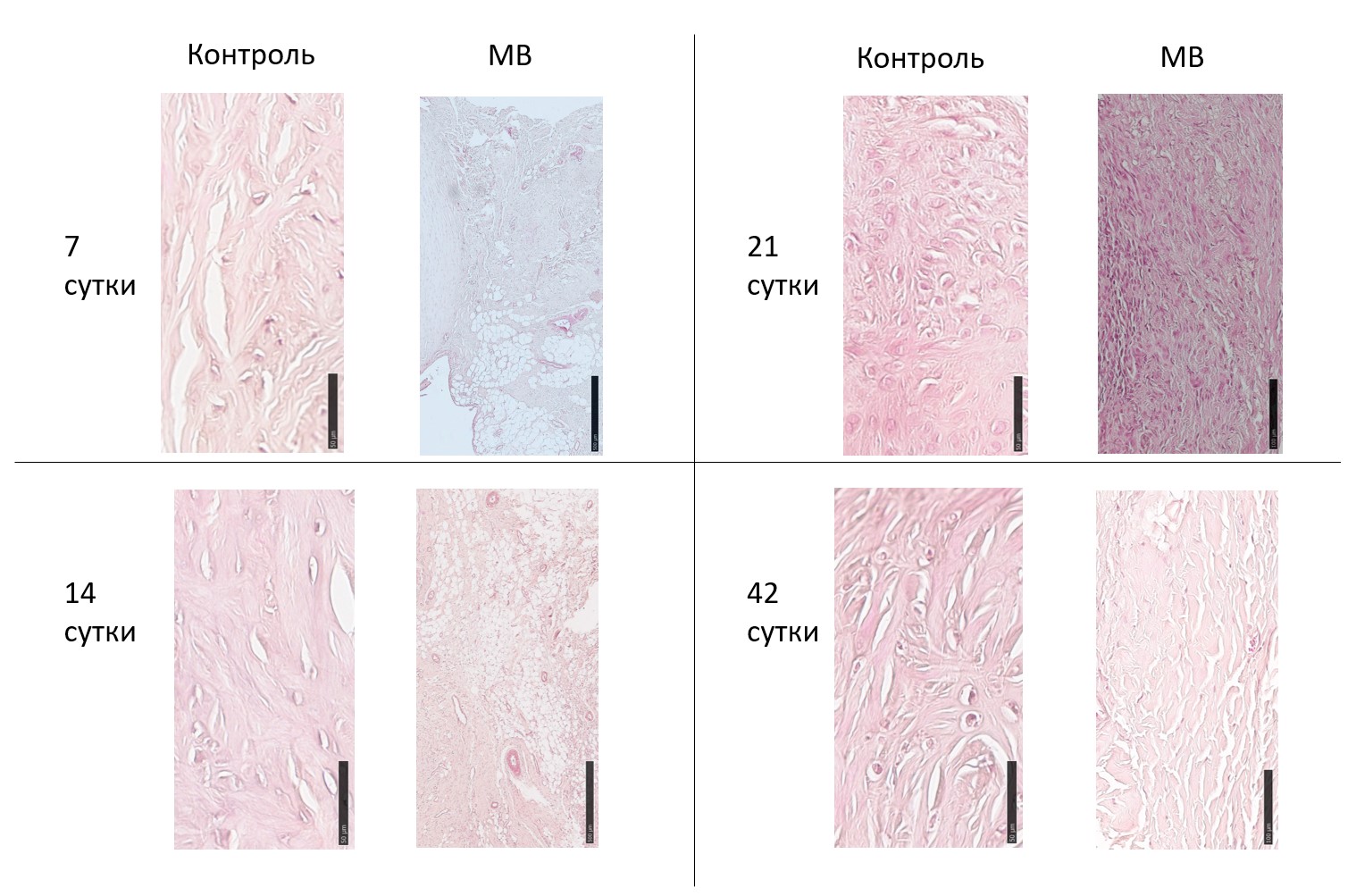
Рисунок 4 - Срез мениска в зоне повреждения
Примечание: увеличение х200, краситель гематоксилин эозин

Рисунок 5 - Срез мениска в зоне повреждения
Примечание: на рисунке показан срез мениска после индукции; увеличение х200, метод окрашивания по Маллори
4. Обсуждение
Применение МВ является инновационным методом терапии. Имеются сведения, что их эффективность является достаточно высокой . К тому же МВ, в отличие от МСК, не имеют недостатки и побочные действия присущие стволовым клеткам .
В этом исследовании используются в качестве нового терапевтического средства МВ из МСК лошадей, которые получены при помощи цитохалазина Б. Этот способ получения МВ является более простым. К тому же выход МВ из клетки при использовании этого метода является достаточно высоким .
В своем исследовании мы использовали МВ в качестве потенциального терапевтического средства для лечения ОА. В предыдущих исследованиях мы изучали влияние МВ на хондроциты в опытах in vitro и получили достаточно убедительные результаты. МВ из МСК жировой ткани лошади оказывали положительный эффект на функциональные свойства хондроцитов .
В настоящем исследовании мы изучали потенциальную терапевтическую эффективность на животной модели . Оценку проводили при помощи гистологических методов, которые являются эффективным инструментом для выявления ОА как у людей, так и у животных. Основным гистологическим окрашиванием для общей оценки морфологии и распределения клеток и тканей является окраска гематоксилином и эозином. Гематоксилин-эозин окрашивает ядра клеток в сине-фиолетовый цвет, а хрящевой матрикс — в розоватый цвет с голубоватым оттенком в областях с высоким содержанием протеогликанов . Для оценки коллагена был использован метод окрашивания по Маллори. Этот краситель обеспечивает стабильное окрашивание тканей разных видов. Хрящевую ткань и коллагеновые фибриллы этот краситель окрашивает в синий цвет .
Результаты исследований показали, что суставная ткань после индукции ОА была дезорганизована, наблюдалось нарушение в структуре волокон хрящевой ткани, наблюдалась низкая клеточность. У животных, которым вводили МВ наблюдалась лучшее состояние суставной хрящевой ткани, клеточность заметно выше, а структура лучше. Такое действие МВ на хрящевую ткань обусловлено переносом функциональных белков и генетического материала непосредственно в хондроциты и хондробласты, а также низкой иммуногенностью . Похожие результаты были получены у других исследователей. При помощи методов гистологии они показали, что ВВ защищают суставной хрящ, регулируя внеклеточный матрикс хряща и эффективно снижая его повреждение .
5. Заключение
Проведенные исследования показали, что МВ из МСК жировой ткани лошади на животной модели положительно влияют на моделировании ОА на лабораторных животных. Гистологические исследования показали значительное улучшение состояния хрящевой ткани поврежденного мениска. Таким образом, препарат на основе МВ из МСК обладает потенциальным терапевтическим действием. В дальнейшем МВ можно будет использовать для лечения ОА у лошадей.
