ОЦЕНКА БИО- И ФИТОТОКСИЧНОСТИ ЗООГУМУСА КУЛЬТИВИРОВАНИЯ ЛИЧИНОК ЧЕРНОЙ ЛЬВИНКИ (HERMETIA ILLUCENS L.)
ОЦЕНКА БИО- И ФИТОТОКСИЧНОСТИ ЗООГУМУСА КУЛЬТИВИРОВАНИЯ ЛИЧИНОК ЧЕРНОЙ ЛЬВИНКИ (HERMETIA ILLUCENS L.)
Аннотация
Работа посвящена определению класса опасности зоогумуса – отхода культивирования личинок Hermetia illucens с помощью различных методик биотестирования с использованием инфузорий Paramecium Caudatum и дафний Daphnia magna. Зоогумус оказывал негативное воздействие на инфузории в водных вытяжках всех кратностей разведения, но при этом острого токсического действия не выявлялось, в то же время на дафниях вредное воздействие обнаруживалось при разведении 1:100, а острое токсическое воздействие – при 1:10 и без разведения. Результаты показали, что зоогумус относится к 4 классу опасности. Фитотоксичность зоогумуса в опыте с рулонной культурой проявилась только при концентрации 3% на энергии прорастания семян овса.
1. Введение
В настоящее время ни у кого не вызывает сомнения необходимость использования отходов как вторичного сырья для переработки, это важная экологическая и экономическая задача. Ежегодно в России образуется более 17 млн. т пищевых отходов в агрофирмах, домашних хозяйствах, на предприятиях общественного питания, розничной и оптовой торговли. Около 94% их отправляют на полигоны, где они могут являться рассадником инфекций, переносимых насекомыми, птицами и грызунами. На полигонах в результате циклических химических реакций органика превращается в токсины, отравляющие окружающую среду, происходит выделение парниковых газов , . С 2018 г. в нашей стране запрещается захоронение отходов, которые могут перерабатываться действующими предприятиями. В этот перечень отходов вошли 182 вида, однако запрета на захоронение пищевых отходов нет .
Существующие меры обращения с пищевыми отходами включают в себя:
- раздельный сбор и накопление с дальнейшим вывозом на специальные площадки для анаэробного или аэробного компостирования;
- промышленное производство в биогаз путем анаэробной переработки;
- сжигание с целью максимальной утилизации и снижению массы;
- извлечение биоактивных соединений;
- карбонизация и получение активированных углей и др. , .
Ранее нами предлагался способ переработки отходов хлебобулочных изделий, образующихся в розничной сети г. Санкт-Петербурга в весьма востребованный в народном хозяйстве продукт — биоэтанол .
Выбор того или иного способа утилизации органических отходов определяется экономической эффективностью, экологической целесообразностью, техническими возможностями и др. В последние годы во многих странах уделяют большое внимание биоконверсии органических отходов производства и потребления с использованием живых организмов, таких как дождевые черви, личинки комнатной мухи или черной львинки , , .
Установлен ряд преимуществ использования личинок черной львинки (Hermetia illucens (L.)) для переработки пищевых отходов:
1) скорость утилизации отходов выше, чем при технологии вермикомпостирования дождевыми червями;
2) неприхотлива в питании, способна поедать все виды пищевых и сельскохозяйственных отходов;
3) биологическая, санитарная и ветеринарная безопасность насекомых;
4) неинвазивный вид;
5) биомасса личинок — ценное сырье и кормовой продукт.
Исследованиями установлено, что использование личинок черной львинки для переработки органических отходов, в том числе просроченной продукции из торговых точек, экономически и экологически выгоднее, чем сжигание и анаэробное сбраживание и сопоставимо с затратами на компостирование .
Один из способов культивирования Hermetia Illucens, представленный М. А. Петровичевым заключается в следующем: пищевые и органические отходы измельчают и превращают в однородную массу, которую затем подвергают автоклавированию при температуре 120о не менее 30 мин. На приготовленный субстрат заселяют личинки мухи Hermetia Illucens возрастом 3-5 дней с момента вылупления, с расчетом 7-10 особей на 1 см2 субстрата .
Переработанные личинками мухи отходы представляют собой зоогумус, состоящий из разнообразных органических соединений, богатый мако- и микроэлементами. Однако поскольку пищевые отходы отличаются широким ассортиментом входящих в них компонентов и, следовательно, непостоянством состава, возникают трудности со сравнением результатов исследований различных авторов по использованию зоогумуса. Его состав может отличаться в зависимости от поедаемого личинками мухи субстрата, поэтому необходимо уточнять токсическую реакцию. В данном случае использование расчетных методов для определения класса опасности подобного вида отходов затруднительно. Биотестирование позволяет дать интегральную оценку потенциальной токсичности отхода.
Цель работы состояла в определении класса опасности зоогумуса – отхода культивирования личинок Hermetia illucens с помощью методов биотестирования и оценка его фитотоксичности.
2. Методы и принципы исследования
В опытах использовали зоогумус, предоставленный ООО «Зероникс», (г. Москва), который представлял собой темно-коричневую сыпучую массу с размером частиц 1-3 мм со слабым запахом аммиака .
Экспериментальную работу проводили методом биотестирования на тест-организмах: низших рачках Daphnia magna (по ФР 1.39.2007.03222) , инфузориях Paramecium caudatum (в соответствии с ГОСТ Р 57166-2016 и ФР 1.39.2006.02506 и по хемотаксический реакции с помощью Биотестера-2М). Поскольку в дальнейшем предполагается использовать зоогумус при выращивании растений, то оценивали его фитотоксичность методом рулонной культуры при проращивании семян растений овса (Avena sativa L.), сорта Боррус. Схема опыта включала намачивание семян в течение 24 час. в водных вытяжках зоогумуса в концентрациях 0,1%, 0,5%, 1,0%, 1,5%, 3,0%. Определяли показатели: всхожесть семян, энергия прорастания, длина корней и стебля. Оценку всхожести проводили по ГОСТ 12038-84 «Семена сельскохозяйственных культур» , длину корней и стебля – путем прямого измерения. Опыт проводили в трехкратной повторности, по 50 семян каждая. Статистическую обработку данных проводили c применением программ Excel 2016. Достоверность различий между вариантами оценивали методами параметрической статистики (t-критерий Стьюдента). Различия между вариантами считали достоверными при p ≤ 0,05.
Отличие методик биотестирования по ГОСТ Р 57166-2016 и ФР 1.39.2006.02506 заключается в объемах контрольной и анализируемой проб, а также во времени тест-реакции.
По ГОСТ Р 57166-2016 оценивается острая токсичность (продолжительность реакции 6 часов) при объеме анализируемой и контрольной проб – 10 мл:
А=(X ср.к.-X ср.ан./X ср.к.)*100%, где, X ср.к.и X ср.ан.– среднеарифметическое значение количества выживших инфузорий в контрольной пробе и анализируемой пробе соответственно.
По ФР 1.39.2006.02506
объем контрольной и анализируемой проб составляет 0,6 мл, а длительность реакции 24 часа, после чего определяют острое токсическое действие по проценту погибших инфузорий (А, %) по формуле:А= (Хt/Xi)*100%, где Хt – количество погибших особей в тестируемой воде через 24 часа, Xi - количество исходных особей.
Метод по хемотаксической реакции инфузорий основан на способности реагировать на присутствие в водной среде веществ, представляющих опасность для их жизнедеятельности, и направленно перемещаться по градиенту концентраций этих веществ.
По данному методу оценивается острое токсическое действие. Оценку токсичности пробы производят по относительной разнице количества клеток в верхних зонах кювет в контрольной и анализируемой пробе. Индекс токсичности определяется по формуле:
Т=I ср.контроль -I ср.опыт/I ср.контроль, где I ср.контроль, I ср.опыт – средние показания прибора для контрольных и анализируемых проб соответственно.
Оценку токсичности по ФР 1.39.2007.03222
с помощью дафний (Daphnia мagna) проводили в течение 96 часов и определяли острое токсическое действие.Предварительно перед экспериментом из пробы зоогумуса была подготовлена водная вытяжка. Для этого к 200 г пробы зоогумуса прилили 800 мл дистиллированной воды, после чего перемешивали два часа и затем 30 минут отстаивали. Полученный раствор профильтровали.
Для оценки токсического действия из водной вытяжки сделали серии разведений по три повторности: 1:1,1:10,1:100,1:1000, 1:10000 в соответствии с Приказом Министерства ПРиЭ РФ
для определения класса опасности зоогумуса.3. Основные результаты
Результаты экспериментов на низших рачках Daphnia magna и инфузориях Paramecium caudatum представлены в таблицах 1-4.
Оценка выживаемости тест-организмов в зависимости от разведения водной вытяжки зоогумуса показала, что острая токсичность (гибель более 50 % организмов) была обнаружена по обеим методикам на инфузориях (ГОСТ Р 57166-2016, ФР 1.39.2006.02506) при разведении 1:10 и без разведения. При остальных больших разведениях наблюдалось вредное воздействие, но токсический эффект не проявлялся (табл.1-2, рис.1-2).
Таблица 1 - Оценка токсичности пробы морфофизиологическим методом на инфузориях Paramecium Caudatum по ГОСТ Р 57166-2016
Разведение | Острая токсичность, % | Степень токсичности |
10000 | 25 | Не обладает острой токсичностью (слаботоксичная) |
1000 | 30 | Не обладает острой токсичностью (слаботоксичная) |
100 | 40 | Не обладает острой токсичностью (среднетоксичная) |
10 | 60 | Обладает острой токсичностью (высокотоксичная) |
без разведения | 90 | Обладает острой токсичностью (высокотоксичная) |
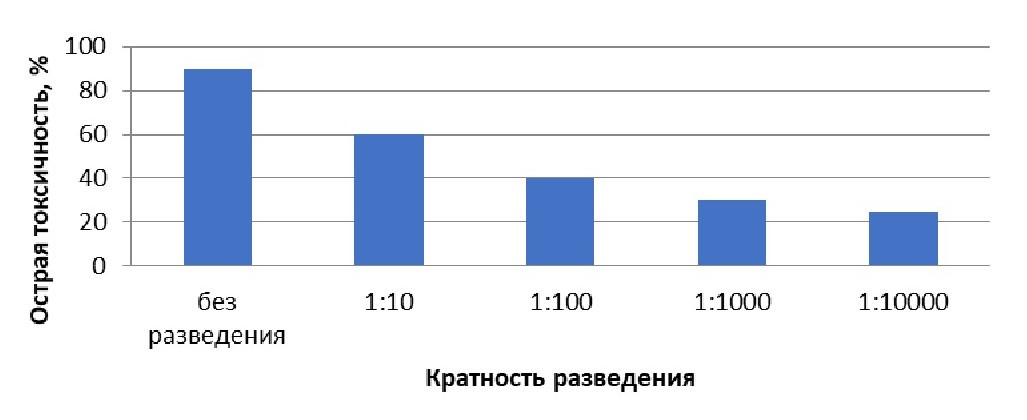
Рисунок 1 - Зависимость острой токсичности инфузории Paramecium Caudatum от кратности разведения водной вытяжки зоогумуса
Примечание: по ГОСТ Р 57166-2016
Таблица 2 - Оценка токсичности пробы морфофизиологическим методом на инфузориях Paramecium Caudatum по ФР 1.39.2006.02506
Разведение | A, % | Токсическое воздействие |
10000 | 16,67 | Не оказывает (обнаружено вредное воздействие) |
1000 | 33,33 | Не оказывает (обнаружено вредное воздействие) |
100 | 30 | Не оказывает (обнаружено вредное воздействие) |
10 | 76,67 | Оказывает (обнаружено вредное воздействие) |
без разведения | 53,33 | Оказывает (обнаружено вредное воздействие) |
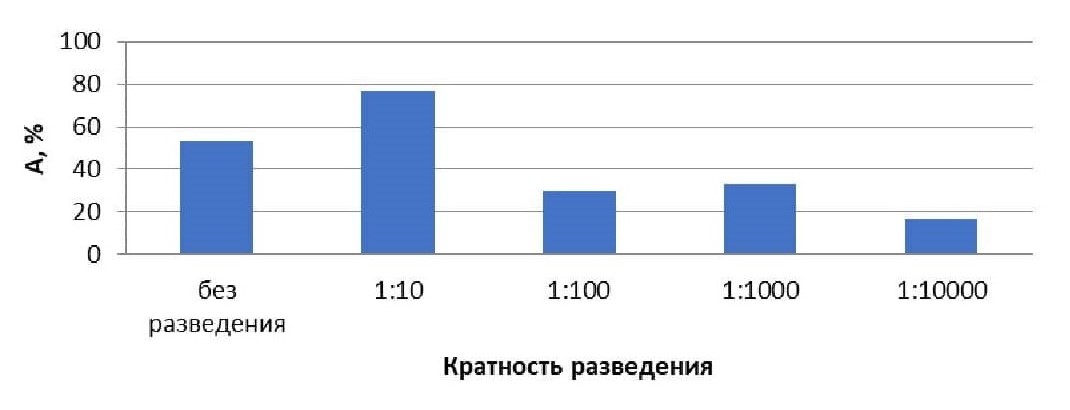
Рисунок 2 - Зависимость острой токсичности инфузории Paramecium Caudatum от кратности разведения водной вытяжки зоогумуса
Примечание: по ФР 1.39.2006.02506
При анализе влияния растворов вытяжки зоогумуса с различными разведения на выживаемость дафний Daphnia magna выявлено (табл.3, рис. 3), что острого токсического воздействия не оказывают вытяжки при разведениях 1:10000, 1:1000, 1:100, при этом вредное воздействие не обнаруживается при разведениях 1:10000 и 1:1000.
Таблица 3 - Оценка токсичности пробы морфофизиологическим методом на дафниях Daphnia magna
Разведение | Процент погибших в тестируемой воде дафний (А), % | Острое токсическое воздействие |
10000 | 0 | Не оказывает (не обнаружено вредное воздействие) |
1000 | 0 | Не оказывает (не обнаружено вредное воздействие) |
100 | 25 | Не оказывает (обнаружено вредное воздействие) |
10 | 100 | Оказывает (обнаружено вредное воздействие) |
без разведения | 100 | Оказывает (обнаружено вредное воздействие) |
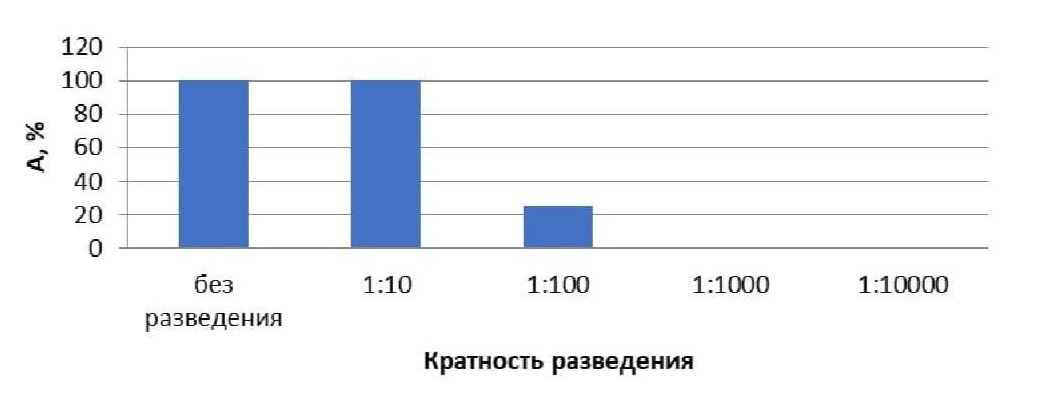
Рисунок 3 - Зависимость смертности дафний Daphnia magna от кратности разведения водной вытяжки зоогумуса
Результаты оценки острой токсичности с помощью хемотаксического метода на Биотестере-2М при разведении 1:1000 выявили высокую степень токсичности, в вытяжке с разведением 1:10000 не оказывается токсического действия (допустимая степень токсичности) (табл.4.).
Таблица 4 - Оценка токсичности пробы хемотаксическим методом на инфузориях Paramecium Caudatum с помощью прибора Биостестер-2М
Разведение | Т,% | Степень токсичности |
10000 | -0,60 | I Доступная |
1000 | 0,97 | III Высокая |
100 | - | - |
10 | - | - |
без разведения | - | - |
По результатам биотестирования по обоим тест-организмам можно сделать вывод, что зоогумус относится к 4 классу опасности в соответствии с .
Вероятно, класс опасности зависит от перерабатываемого личинками субстрата. Так, в опытах Г.В. Ильиной и Д.Ю. Ильина биотестирование дафниями и бактериями зоогумуса, полученного из птичьего помета, позволило отнести его к 3 классу опасности. Авторы объясняют это повышенным содержанием аммиака в зоогумусе . По данным других авторов, проводивших биотестирование зоогумуса на дафниях и водоросли хлорелле, этот отход имеет 4 класс опасности .
В опыте по определению фитотоксичности, намачивание семян овса в вытяжках зоогумуса стимулировало незначительное увеличение энергии прорастания (на 3-й день эксперимента) только в вариантах с концентрацией 1,0% и 1,5%, а концентрация 3,0% оказывала угнетающее действие на этот показатель (табл. 5).
Таблица 5 - Влияние вытяжек из зоогумуса на ростовые показатели семян овса
Вариант опыта | Концентрация зоогумуса | Всхожесть | Энергия прорастания | Длина | |||||
корень | росток | ||||||||
% | % к контролю | % | % к контролю | мм | % от контроля | мм | % от контроля | ||
1. | 0% (контроль) | 42,0±5,7 | 100 | 34,0 ± 17,6 | 100 | 50,2±31,6 | 100 | 62,6±27,4 | 100 |
2. | 0,1% | 40,0±6,5 | 95 | 32,0 ± 15,7 | 94 | 58,9±33,1 | 117 | 64,1±31,8 | 102 |
3. | 0,5% | 51,0±8,9 | 121 | 33,0 ± 15,7 | 97 | 48,2±34,4 | 96 | 66,3±34,6 | 105 |
4. | 1,0% | 54,0±8,2 | 128 | 36,0 ± 9,8 | 110 | 54,8±37,5 | 109 | 71,9±28,9 | 115 |
5. | 1,5% | 57,0±4,9 | 135 | 38,5 ± 13,9 | 113 | 56,6±34,5 | 112 | 58,1± 31,2 | 93 |
6. | 3,0% | 47,0±13,7 | 112 | 25,0 ± 21,7 | 74 | 51,2±29,8 | 102 | 58,5± 33,5 | 93 |
Всхожесть семян (на 7-й день эксперимента) существенно увеличивалась на 12-35% к контролю (вода) в вариантах со всеми концентрациями, кроме 0,1%. Длина корней (на 10 день эксперимента) в вариантах 0,1%, 1,0-3,0% достоверно или в виде тенденции была больше контроля. Длина ростка в вариантах с концентрацией 0,1-0,5% незначительно превышала контроль, а в варианте 1,0% -на 15% выше контроля. Таким образом, существенной фитотоксичности влияния возрастающих концентраций зоогумуса на изучаемые показатели не отмечено, кроме влияния концентрации 3,0% на энергию прорастания семян овса.
4. Заключение
Переработка органических и пищевых отходов с образованием зоогумуса личинками мухи черная львинка является перспективным направлением биоремедиации.
Обобщение результатов битестирования показало, что зоогумус оказывал негативное (вредное) воздействие на инфузории Paramecium Caudatum в водных вытяжках всех кратностей разведения, которые использовались в эксперименте, но при этом острого токсического действия не выявлялось, в то же время на дафниях Daphnia magna вредное воздействие обнаруживалось при разведении 1:100, а острое токсическое воздействие – при 1:10 и без разведения.
По результатам биотестирования по обоим тест-организмам можно сделать вывод, что зоогумус относится к 4 классу опасности в соответствии с . Фитотоксическое действие водных вытяжек из зоогумуса при намачивании семян овса проявлялось только на показателе «энергия прорастания» в варианте с 3% раствором. Намачивание семян в растворах зоогумуса стимулировало всхожесть семян, которая существенно увеличивалась на 12-35% к контролю (вода) в вариантах со всеми концентрациями, кроме 0,1%.
