ACTIVITY OF KEY GENES AND ENZYMES OF THE ANTIOXIDANT DEFENCE SYSTEM IN PSEUDOMONAS CHLORORAPHIS SUBSP. AURANTIACA
ACTIVITY OF KEY GENES AND ENZYMES OF THE ANTIOXIDANT DEFENCE SYSTEM IN PSEUDOMONAS CHLORORAPHIS SUBSP. AURANTIACA
Abstract
Hydrogen peroxide-degrading enzymes represent one of the first lines of defence against reactive oxygen species in most pro- and eukaryotic organisms. In this work, wild-type P. chlororaphis subsp. aurantiaca strains and mutant strains resistant to hydrogen peroxide and capable of overproduction of redox-active compounds of the phenazine series were used as research objects. The aim of the study was to identify genes of different types of hydrogen peroxide-degrading enzymes in the genome of P. chlororaphis subsp. aurantiaca bacteria, with subsequent evaluation of their expression levels and analysis of the total activity of their protein products. The data obtained will allow a better understanding of the mechanisms of resistance of the strains-producers to their own phenazine compounds, as well as optimize the methodology of obtaining producers of these compounds.
The studies were carried out using microbiological, molecular genetic and biochemical methods.
It was established that the genome of P. chlororaphis subsp. aurantiaca contains several genes whose products are capable of hydrogen peroxide degradation. These are catalase genes (katE and katG), peroxidase gene (per) and glutathione peroxidase gene (gluper). Analysis of the specific activity of superoxide dismutase (SOD) enzyme and the total specific activity of hydrogen peroxide-degrading enzymes allowed to establish that different strains activate different defence mechanisms against oxidative stress occurring at high concentrations of intrinsic phenazines. It was shown that SOD and peroxidases (peroxidase and glutathione-peroxidase) play the main protective role at low levels of phenazine production.
1. Введение
Антиоксидантные ферменты, наряду с системами репарации молекул ДНК, являются основными элементами защиты клеток от активных форм кислорода . Активные формы кислорода образуются в высоких концентрациях при росте бактериальных клеток в аэробных условиях. Первой линией защиты в таких условиях выступают пероксидазы (включая каталазы) и супероксиддисмутазы. Эти же ферменты входят в состав многих бактериальных систем защиты от веществ с антибиотическим действием . Феназиновые соединения обладают выраженной антибиотической активностью, в основе которой лежит их способность вступать в окислительно-восстановительные реакции и генерировать образование пероксида водорода и некоторых других активных форм кислорода. Именно пероксид водорода и развивающийся в присутствии его высоких концентраций окислительный стресс вызывают гибель чувствительных микроорганизмов, обеспечивая конкурентное преимущество продуцентам феназинов .
Сами продуценты обладают механизмами, позволяющими блокировать токсические эффекты высоких концентраций феназинов. Одним из ключевых механизмов защиты является высокий уровень активности ферментов, разрушающих пероксид водорода . Такое увеличение уровня активности может быть обусловлено как непосредственной активацией самих ферментов, так и возрастанием уровня экспрессии кодирующих их генов. Кроме того, в геномах бактерий присутствуют гены, ответственные за образование разных типов ферментов, демонстрирующих пероксидазную активность. К таковым, например, относятся каталаза, пероксидазы и глутатионпероксидазы. Потенциально, все эти ферменты могут быть вовлечены в защиту клеток продуцентов феназиновых соединений от окислительного стресса. Знание того, какой конкретно механизм используется тем или иным продуцентом, позволяет не только лучше понимать причины формирования сверхпродуктивности, но и оптимизировать стратегии создание таких штаммов. Кроме того, такая информация крайне полезна при прогнозировании возможных путей развития устойчивости к феназиновым соединениям у чувствительных патогенных микроорганизмов, в отношении которых феназины используются либо планируются к использованию как антибиотические препараты.
Целью данного исследования была идентификация генов различных типов ферментов, разрушающих пероксид водорода, в геноме бактерий P. chlororaphis subsp. aurantiaca с последующей оценкой уровней их экспрессии и анализом суммарной активности их белковых продуктов.
2. Материалы и методы исследования
Объектами исследования являлись штаммы бактерий P. chlororaphis subsp. aurantiaca, представленных в таблице 1, полученный ранее в работе .
Бактерии культивировались в стандартных агаризованных либо жидких средах на основе питательного бульона (ПБ) (SIGMA-ALDRICH, Германия) при температуре 28 °С. Для проведения экспериментов по определению выживаемости бактерий дикого типа и штаммов-продуцентов ночную культуру, объемом 100 мкл (в концентрации 106 КОЕ/мл) засевали в 1 мл питательного бульона и добавляли различные концентрации пероксида водорода. Культивирование проводили при 28 °С без аэрации в течение 2 сут.
Для проведения экспериментов по анализу изменения экспрессии генов ферментов антиоксидантного комплекса 500 мкл ночной культуры (в концентрации 106 КОЕ/мл) засевали в 5 мл питательного бульона, добавляли фиксированные концентрации пероксида водорода. Культивирование проводили при 28 °С без аэрации в течение 2 сут.
Таблица 1 - Штаммы, использованные в работе
Штаммы P. chlororaphis subsp. aurantiaca | Характеристика штамма | Уровень продукции феназинов на среде ПСА*, мг/л | Уровень продукции феназинов на ПБ*, мг/л | Источник |
B-162 | Дикий тип | 75±15 | 8,48±1,35 | коллекция кафедры генетики БГУ |
B-162/255 | Мутант, устойчивый к токсическим аналогам ароматических аминокислот | 420±29 | 6,47±1,17 | коллекция кафедры генетики БГУ |
B-162/2 | Мутант, устойчивый к пероксиду водорода | 2850±67 | 4,61±2,66 | коллекция кафедры генетики БГУ |
B-162/255/15 | Мутант, устойчивый к пероксиду водорода | 2100±81 | 2,95±1,72 | коллекция кафедры генетики БГУ |
Примечание: * – значения уровней продукции приведены при выделении антибиотиков по методу хлороформной экстракции, ПСА – продукционная среда для антибиотиков, ПБ – питательный рыбный бульон
Для проведения экспериментов по анализу удельной активности ферментов бактериальные культуры, выращенные на ПБ при 28 °С без аэрации, концентрировали путем центрифугирования (13000 об/мин, 1 мин, при 20 °С) до 2 мл бактериальных клеток, удаляя жидкую питательную среду. 2 мл клеток каждой бактериальной культуры далее использовали для дезинтеграции.
Оптическаую плотность бактериальной культуры в жидкой питательной среде измерялась с помощью спектрофотометра Aligent Cary 60 UV-Vis (Aligent Technologies, Австралия) при длине волны 600 нм.
Геномную ДНК бактерий P. chlororaphis subsp. aurantiaca выделяли с помощью набора GeneJET Genomic DNA Purification Kit К0881 (Thermo Scientific). Поиск генов в геноме P. chlororaphis subsp. aurantiaca проводился в программе SnapGene Viewer.
Разработка праймеров проводилась на основе ранее секвенированного генома P. chlororaphis subsp. aurantiaca В-162 .
Для определения температуры отжига праймеров, а также анализа возможности образования вторичных структур, была использована программа Олигокалькулятор, размещенная на сайте биологического факультета БГУ, и программа DinaMelt. Последовательность праймеров для анализируемых генов даны в таблице 2.
Таблица 2 - Праймеры, использованные в работе
Ген | Последовательность прямого праймера | Последовательность обратного праймера | Размеры амлифицируемых фрагментов (п.о.) |
katE | CACCTCCAGCTTCGTCAAGTTCC | CAGCGGGTCATTGGAGAAGTCG | 370 |
per | CTTGGCGCTTTTGATCCATTGC | CGTACCGGGATGAACAGCATG | 180 |
katG | TCTTGAGGTAGTTGCGAAAGCCGTC | CGGCGCAAGAAAATCTCCTGGC | 480 |
gluper | GTCTGACACCACAATACGCGG | CAGACGGTACAACTGATGGCG | 218 |
Полимеразную цепную реакцию (ПЦР) проводили с использованием программируемого амплификатора С1000 Touch Thermal Cycler Bio-Rad (США).
Параметры циклов амплификации для фрамента гена katE были следующими: первичная денатурация – 3 мин при 94 ºС; затем 30 циклов: денатурация – 94 ºС, 1 мин; отжиг – 63 ºС, 30 с; элонгация – 72 ºС, 2 мин 30 с; заключительная достройка – 72 ºС, 5 мин.
Параметры циклов амплификации для фрамента гена katG были следующими: первичная денатурация – 3 мин при 94 ºС; затем 30 циклов: денатурация – 94 ºС, 1 мин; отжиг – 59 ºС, 30 с; элонгация – 72 ºС, 2 мин 30 с; заключительная достройка – 72 ºС, 5 мин.
Параметры циклов амплификации для фрамента гена per были следующими: первичная денатурация – 3 мин при 94 ºС; затем 30 циклов: денатурация – 94 ºС, 1 мин; отжиг – 61 ºС, 30 с; элонгация – 72 ºС, 2 мин 30 с; заключительная достройка – 72 ºС, 5 мин.
Параметры циклов амплификации для фрамента гена gluper были следующими: первичная денатурация – 3 мин при 94 ºС; затем 30 циклов: денатурация – 94 ºС, 1 мин; отжиг – 56 ºС, 30 с; элонгация – 72 ºС, 2 мин 30 с; заключительная достройка – 72 ºС, 5 мин.
Электрофоретический анализ ДНК осуществляли согласно руководству .
Для остановки биосинтетических процессов перед выделением РНК к бактериальной суспензии добавляли 400 мкл смеси фенол:этанол (1:20), после чего производили инкубацию на льду в течение 30 мин. Клетки осаждали 2 мин при 10 000 об/мин и к полученному осадку добавляли ExtractRNA Reagent (Евроген, Россия). Далее выделение РНК проводили по методике, описанной производителем реагента.
Для удаления остатков тотальной ДНК использовали DNAseI (New England BioLabs, Великобритания). Концентрацию РНК определяли по формуле (1):
где А – оптическая плотность раствора при соответствующей длине волны, К –коэффициент пересчета для разных видов нуклеиновых кислот. Для одноцепочечной РНК К=40.
Для оценки чистоты РНК использовали формулу (2):
Обратную транскрипцию проводили с помощью обратной транскриптазы ProtoScript II (New England BioLabs, Великобритания). Для реакции использовался 1 мкг РНК. Полученную кДНК в концентрации 10 нг на 20 мкл реакционной смеси использовали для проведения количественной ПЦР в реальном времени. Количественную ПЦР проводили на амплификаторе Bio-Rad CFX96 (Bio-Rad, США) с модулем детекции CFX96TM (Bio-Rad, США) с помощью реагента ArtMixColor (АртБиоТех, Беларусь). Параметры реакции ПЦР в реальном времени (ПЦР-РВ) приведены в таблице 3.
Таблица 3 - Параметры реакции ПЦР-РВ
Этап | Температура, ˚С | Время, с | Количество циклов |
Начальная денатурация | 95 | 120 | 1 |
Денатурация | 95 | 10 | 40 |
Отжиг праймеров/элонгация/считывание сигнала | 61 67 | 15 20 | |
Кривая плавления | 65 | 30 | 1 |
Результаты количественной ПЦР визуализировали с помощью программы Bio-Rad CFX Manager 3.1. Выбор референсных генов для определения экспрессии феназинового оперона производили с помощью программы geNorm.
Анализ результатов ПЦР-РВ Изменение уровней экспрессии рассчитывалось по методу Livak/Schmittgen, согласно формулам (3 – 5).
В качестве референсных генов были выбраны гены «домашнего хозяйства» 16S рРНК и rpoD.
Для получения дезинтегратов бактериальных культур для последующего анализа удельной активности ферментов, клетки из культуральной жидкости осаждали путем центрифугирования (15000 об/мин, 1 мин), отмывали натрий-фосфатным буфером (50 мМ, pH 7,0), концентрировали в соответствующем буфере до 1010-1011кл/мл. Приготовленные концентраты подвергали дезинтегрированию с помощью прибора Bandelin UW 3100 (Германия) (частота 20 кГц, режим: 1,5 сек экспозиция, далее 1,5 сек перерыв, циклично в течение 45 сек), после чего клеточные обломки удаляли центрифугированием в течение 4 мин при 15 000 об/мин. Все процедуры производили на холоде (-4°С – 0°С).
Активность ферментов, разрушающих пероксид водорода, определяли спектрофотометрически по степени разрушения пероксида водорода за единицу времени .
Активность супероксиддисмутазы (СОД) определяли с использованием непрямого спектрофотометрического метода, предложенного в работе .
Определение белка осуществляли по методу Брэдфорд, предложенному в работе .
Погрешность измерения рассчитывалась по формуле 6.
где m – стандартная ошибка среднего, n – число измерений, S – среднее квадратическое отклонение, вычисляется по формуле 7.
где – результаты измерений, M – среднее арифметическое измерений, n – число измерений.
3. Результаты и обсуждение
3.1. Определение ингибирующих концентраций пероксида водорода для различных штаммов P. chlororaphis subsp. aurantiaca
Основной задачей начального этапа исследования было обнаружение такой концентрации пероксида водорода для каждого из штаммов, при которой начинается подавление роста бактериальной культуры. Обнаруженную концентрацию планировалось использовать в дальнейших экспериментах по анализу изменения уровней экспрессии генов систем антиоксидантной защиты в клетках продуцентов, что позволило бы определить пределы устойчивости данных систем у бактерий P. chlororaphis subsp. aurantiaca.
Штаммы, устойчивые к различным концентрациям пероксида водорода ранее были получены на кафедре генетики с помощью химического мутагенеза и последующей селекции на устойчивость к пероксиду водорода. Штамм В-162/2 способен расти на полноценных агаризованных питательных средах в присутствии пероксида водорода в концентрации 3,75 мМ, тогда как для штамма В-162/255/15 аналогичный параметр составляет 7,5 мМ. Пероксид водорода был выбран в качестве селектирующего агента, так как он и антибиотики феназинового ряда имеют сходные механизмы антибактериального действия, основанного на индукции окислительного стресса. Известно, что устойчивость мутантных штаммов к тому или иному селективному агенту на агаризованных средах может существенно отличаться от таковой в жидких питательных средах. Поэтому на первом этапе работы были проведены эксперименты по определению выживаемости бактерий дикого типа и штаммов-продуцентов, устойчивых к пероксиду водорода, в присутствии данного селектирующего агента в жидкой питательной среде (см. Материалы и методы). Полученные данные приведены в таблице 4.
Таблица 4 - Рост штаммов P. chlororaphis subsp. aurantiaca в присутствии различных концентраций пероксида водорода в жидких питательных средах
Штамм B-162 (дикий тип) | ||||||
Концентрация H2O2 мМ | контроль | 3,75 | 7,5 | 11,25 | 12,75 | 15 |
Наличие роста культуры | + | +/- | - | - | - | - |
Штамм B-162/255 | ||||||
Концентрация H2O2 мМ | контроль | 3,75 | 7,5 | 11,25 | 12,75 | 15 |
Наличие роста культуры | + | + | + | + | + | +/- |
Штамм B-162/2 | ||||||
Концентрация H2O2 мМ | контроль | 3,75 | 7,5 | 11,25 | 12,75 | 15 |
Наличие роста культуры | + | + | + | + | + | +/- |
Штамм B-162/255/15 | ||||||
Концентрация H2O2 мМ | контроль | 3,75 | 7,5 | 11,25 | 12,75 | 15 |
Наличие роста культуры | + | + | + | + | + | + |
Примечание: «+» – наличие роста, «-» – отсутствие роста культуры,«+/-» – начало ингибирования роста культуры
Из данных в таблице видно, что штаммы-продуценты отличаются гораздо более высоким уровнем устойчивости к пероксиду водорода, по сравнению с бактериями дикого типа. Ингибирование роста бактериальной культуры штамма дикого типа начинается уже при концентрации пероксида водорода 3,75 мМ, тогда как продуценты способны выдерживать концентрации данного вещества, почти в 3 раза превышающие таковые для штамма дикого типа. Для штамма В-162/255/15 проанализированные концентрации вообще не являлись ингибирующими. Таким образом, видно, что высокий уровень устойчивости к пероксиду водорода коррелирует с повышением продукции феназинов. Для дальнейших экспериментов по анализу изменения уровней экспрессии генов систем антиоксидантной защиты для штамма дикого типа была выбрана концентрация пероксида водорода 3,5 мМ, для штаммов В-162/2 и В-162/255 – 15 мМ, для штамма В-162/255/15 – 20 мМ.
3.2. Определение удельных активностей супероксиддисмутазы и каталазы
Ранее было показано, что штаммы-продуценты феназиновых соединений, полученные в результате химического мутагенеза и последующей селекции на устойчивость к токсическим аналогам ароматических аминокислот, обладают повышенными уровнями удельной активности ферментов, разрушающих пероксид водорода .
В связи с этим интересным представлялось изучить, сохраняется ли подобная тенденция, у штаммов, отобранных по устойчивости к пероксиду водорода. В данном эксперименте культивирование штаммов осуществляли на ПБ, где уровень продукции феназинов относительно невысок (таблица 1), а не на специальной среде ПСА для индукции феназинов. Это позволяло оценить исходный уровень удельной активности ферментов, присущий каждому штамму независимо от наличия в среде феназинов. Полученные данные представлены на рисунке 1.
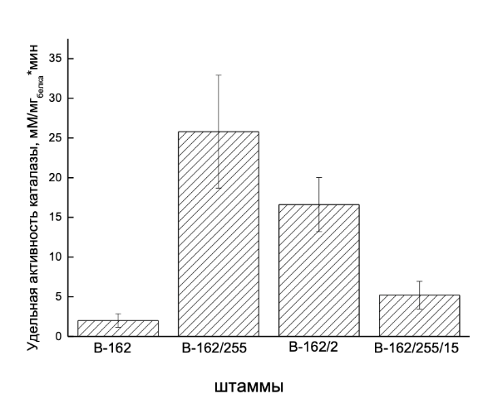
Рисунок 1 - Удельная активность ферментов, разрушающих пероксид водорода
Примечание: культивирование бактерий осуществляли на питательном бульоне
На следующем этапе была проведена оценка удельной активности супероксидидисмутазы (СОД) у бактерий дикого типа и мутантных штаммов. Полученные результаты представлены на рисунке 2.

Рисунок 2 - Удельная активность СОД
Примечание: культивирование бактерий осуществляли на питательном рыбном бульоне
Однако данные, полученные на этом этапе исследования, не позволяли сделать вывод о том, по какой причине происходит изменение удельной активности ферментов, обладающих пероксидазной активностью. Одним из возможных путей увеличения удельной активности является активация самого фермента, второй путь подразумевает увеличение экспрессии гена, кодирующего тот или иной фермент. Для выяснения этого вопроса необходимо было проанализировать экспрессию генов, кодирующих пероксид-деградирующие ферменты у изучаемых штаммов.
3.3. Идентификация генов ферментов деградации пероксида водорода в геноме P. chlororaphis subsp. aurantiaca
Известно, что ферменты, разрушающие пероксид водорода, могут быть представлены в геноме бактерий несколькими вариантами: собственно каталазами различных типов, пероксидазами, глутатионпероксидазами. Все эти ферменты часто объединяются под общим термином «каталазы».
На данном этапе работы были сконструированы праймеры к ключевым генам, продукты которых принимают участие в защите клеток от пероксида водорода. Согласно данным секвенирования в геноме P. chlororaphis subsp. aurantiaca присутствует несколько генов каталаз, в частности гены katE, katG, а также несколько генов пероксидаз и глутатионпероксидаз. Нами был сконструированы праймеры к 4 генам, анализ уровней экспрессии которых поможет оценить, какие именно ферменты деградации пероксида водорода играют ключевую роль в его разрушении, а, следовательно, защите от повышенных концентраций феназинов, у изучаемых штаммов. Названия генов и последовательности праймеров представлены в таблице 2. На следующем этапе была проведена ПЦР-амплификация с использованием разработанных праймеров, с целью подтверждения присутствия данных генов в геноме P. chlororaphis subsp. aurantiaca. В результате были идентифицированы гены каталазы G (katG), и каталазы Е (katE), пероксидазы (per) и глутатионпероксидазы (gluper). Электрофореграммы, демонстрирующие отдельные результаты ПЦР-скрининга, представлены на рисунке 4.
3.4. Анализ изменения уровней экспрессии генов, кодирующих ферменты деградации пероксида водорода у штаммов P. chlororaphis subsp. aurantiaca
На следующем этапе работы было проведено исследование уровней экспрессии, обнаруженных в геноме P. chlororaphis subsp. aurantiaca генов, кодирующих ферменты деградации пероксида водорода. Для этого первоначально из культур была выделена тотальная РНК, препарат которой впоследствии был обработан ДНКазой для удаления остатков ДНК. Далее такая очищенная РНК была использована для постановки реакций ОТ-ПЦР и ПЦР в реальном времени. Культуры штаммов (В-162, В-162/2, В-162/255 и В-162/255), из которых выделялась РНК, выращивали в условиях отсутствия пероксида водорода в среде (контроль) и при наличии его субингибирующих концентраций (опыт).
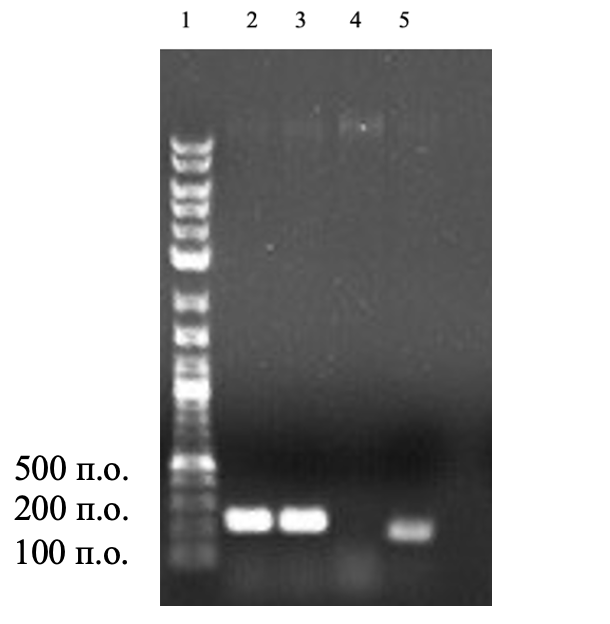
Рисунок 3 - Электрофореграмма продуктов амплификации гена пероксидазы (per) и глутатионпероксидазы (gluper) P. chlororaphis subsp. aurantiaca
Примечание: 1 – маркер молекулярных масс фрагментов ДНК Long Range 10kb DNA, 2 и 3 – ген пероксидазы, 4 и 5 – ген глутатионпероксидазы
В качестве референсных генов использовали гены «домашнего хозяйства» rpoD и 16S рРНК. Целью исследования было определить, вызывает ли добавление пероксида водорода в среду культивирования бактериальных штаммов P. chlororaphis subsp. aurantiaca индукцию экспрессии анализируемых генов. Данные, полученные при анализе и обсчете результатов ПРЦ-РВ, представлены в таблице 6. На рисунке 5 дополнительно проиллюстрированы полученные результаты на примере штамма В-162/255 для анализируемого гена katE и генов «домашнего хозяйства» rpoD и 16S рРНК.
Таблица 5 - Изменения уровней экспрессии целевых генов в присутствии пероксида водорода
Штамм | katE | katG | per | gluper |
В-162 | Увеличение экспрессии в 1,41раза
| Увеличение экспрессии в 1,4раза | Увеличение экспрессии в13,45 раз | Увеличение экспрессии в 4,4раза
|
В-162/255 | Увеличение экспрессии в 1,12раза | Отсутствие увеличения экспрессии | Увеличение экспрессии в 1,12раз | Увеличение экспрессии в 3 раза |
В-162/2 | Увеличение экспрессии в 1,1раз | Отсутствие экспрессии | Отсутствие увеличения экспрессии | Увеличение экспрессии в 22раза |
В-162/255/15 | Увеличение экспрессии в 5 раз | Отсутствие экспрессии | Отсутствие экспрессии | Отсутствие увеличения экспрессии |
Из данных, представленных в таблице видно, что у штамма В-162 регистрируется увеличение экспрессии всех четырех проанализированных генов. Однако наибольшее увеличение экспрессии демонстрирует ген, кодирующий фермент пероксидазу (увеличение в 13,45 раз). Судя по всему, именно этот фермент является основным ферментом защиты у штамма дикого типа.
Иная картина была зарегистрирована для мутантных штаммов. Так, у штамма В-162/255 при культивировании в питательном рыбном бульоне (ПБ) регистрируется увеличение экспрессии трех генов – katE, per, gluper, причем наибольший рост (в 3 раза) зафиксирован именно для последнего. Видимо, такого уровня экспрессии в сочетании с достаточно высокой исходной удельной активностью СОД на данной питательной среде достаточно для защиты от той концентрации феназинов, которая образуется в этих условиях культивирования. Следует подчеркнуть, что продуктивность этого штамма на ПБ ниже продуктивности штамма дикого типа на этой же среде (см. таблицу 1).
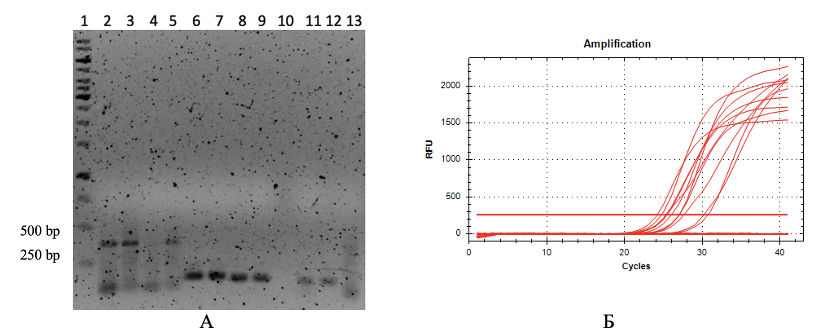
Рисунок 4 - ПЦР-РВ для гена katE штамма B-162/255
А – Электрофореграмма результатов ПЦР в реальном времени;
Б – Регистрация уровня флуоресценции относительно цикла амплификации
Примечание: 1 – маркер молекулярных масс фрагментов ДНК GeneRuler 1 kb DNA, 2-3 – экспрессия гена katE в присутствии пероксида водорода, 4-5 – экспрессия гена katE в отсутствии пероксида водорода, 6 – экспрессия гена 16SRNA в присутствии пероксида водорода, 7 – экспрессия гена 16SRNA в отсутствии пероксида водорода, 8 – экспрессия гена rpoD в присутствии пероксида водорода, 9 – экспрессия гена rpoD в отсутствии пероксида водорода, 10 – отрицательный контроль с праймерами к гену 16SRNA без матрицы, 11-12 – отрицательный контроль с праймерами к гену katE без матрицы, 13 – отрицательный контроль с праймерами к гену rpoD без матрицы
4. Заключение
Таким образом, можно сделать заключение, что при невысоких уровнях продукции феназинов основную защитную роль играют именно СОД и пероксидазы (пероксидаза и глутатионпероксидаза). Причем разные штаммы, по-видимому, активируют разные механизмы защиты. То, что у мутантных штаммов, в отличие от штамма дикого типа, одновременно задействованы не все возможные защитные системы, указывает на то, что эти штаммы испытывают меньший уровень стресса, что может быть обусловлено другими протекторными системами, которые более активны у данных штаммов (уровень глутатиона, глутаредоксина, шаперонов и т.д.).
