СРАВНИТЕЛЬНАЯ ОЦЕНКА НЕКОТОРЫХ ГРИБНЫХ ПРОТЕАЗ
СРАВНИТЕЛЬНАЯ ОЦЕНКА НЕКОТОРЫХ ГРИБНЫХ ПРОТЕАЗ
Научная статья
Лукин А.А.1, *, Данилов М.Б.2
1 ORCID: 0000-0003-4753-3210;
1 Южно-Уральский государственный университет, Челябинск, Россия;
2 Восточно-Сибирский государственный университет технологий и управления, Улан-Удэ, Россия
* Корреспондирующий автор (lukin3415[at]gmail.com)
АннотацияФерменты применяются во многих отраслях — пищевая, кормовая, сельскохозяйственная, бумажная, кожевенная и текстильная промышленность. Большинство, почти 75 % промышленных ферментов, используемых в настоящее время, обладают гидролитическим действием и используются для разложения различных природных веществ. В данной статье рассмотрено два ферментных препарата грибного происхождения. Протозим С – препарат щелочной грибной протеазы, продуцируемой Acremonium chrysogenum. Флаворзим 1000 Л (Flavourzyme 1000 L) – это комплекс эндо- и экзопротеаз, полученный из гриба Aspergillus oryzae. В представленной статье были определены физико-химические и органолептические показатели ферментных препаратов. Также было исследовано влияния pH и температуры на активность ферментных препаратов. Сделано выводы по целесообразности применения грибных протеаз.
Ключевые слова: грибные протеазы, Протозим С, Флаворзим 1000 Л, pH, температура, активность.
COMPARATIVE EVALUATION OF SOME FUNGAL PROTEASES
Research article
Lukin A.A.1, *, Danilov M.B.2
1 ORCID: 0000-0003-4753-3210;
1 South Ural State University, Chelyabinsk, Russia;
2 East Siberia State University of Technology and Management, Ulan-Ude, Russia
* Corresponding author (lukin3415[at]gmail.com)
AbstractEnzymes are used in food, feed, agricultural, pulp and paper, leather, textile and many other industries. Almost 75% of the currently utilized industrial enzymes have a hydrolytic effect and are used for the decomposition of various natural substances. The article discusses two enzyme preparations of fungal origin. Protozym C (Протозим С) is a preparation of an alkaline fungal protease produced by Acremonium chrysogenum. Flavourzyme 1000 L is a complex of endo- and exoproteases derived from the fungus Aspergillus oryzae. The study determines the physicochemical and organoleptic parameters of enzyme preparations, and examines the effect of pH and temperature on the activity of enzyme preparations. Conclusions are drawn on the feasibility of using fungal proteases.
Keywords: fungal proteases, Protozyme C, Flavourzyme 1000 L, pH, temperature, activity.
ВведениеМикроорганизмы являются основными источниками ферментов, эффективных и специфических биокатализаторов, которые применяются в различных отраслях промышленности, таких как продукты питания, корма для животных, средства личной гигиены, моющие средства, текстиль и бумага, биотопливо. Высокая специфичность, быстрое действие и способность к биологическому разложению - позволяют проводить эффективную биоконверсию сырья с низкими энергозатратами и высокими экологическими стандартами [1], [2], [3].
За последние несколько десятилетий были проведены значительные исследования ферментов, продуцируемых широким спектром микроорганизмов. Ферменты были получены из нескольких грибов, дрожжей, бактерий и актиномицетов [4], [5].
Нитчатые грибы могут эффективно секретировать различные гидролитические ферменты, и одной из основных групп секретируемых ферментов в грибах является протеаза. Известно, что грибы продуцируют кислотные, нейтральные, щелочные и металлопротеазы. Один организм может продуцировать более одного типа протеазы. Грибковые протеазы активны в широком диапазоне рН (рН от 4 до 11) и проявляют широкую субстратную специфичность [6]. Имеется несколько исследований о производстве протеаз грибами, принадлежащими к роду Aspergillus; Penicillium; Rhizopus; Humicola; Mucor; Thermomyces; Acremonium и др [7].
Ферментативный гидролиз – эффективный способ получения чистого белка. Эффективность зависит от таких факторов, как тип фермента, субстрат и условия гидролиза, включая pH, температуру, время инкубации и концентрация фермента.
Ферментативный гидролиз сырья грибными протеазами происходит в более мягких условиях обработки при pH 6-8 и температуре 40-60 °C, что минимизирует побочные реакции. Использование селективных протеаз при ферментативном гидролизе делает реакции намного более специфичные, чем при щелочном или кислотном гидролизе или термическом процессе. В частности, в пищевой и фармацевтической промышленности предпочтительным является метод ферментативного гидролиза из-за отсутствия остаточных органических растворителей или токсичных реагентов в продуктах, а конечный гидролизат содержит меньше соли.
Белковые гидролизаты широко используются в пищевой промышленности для различных целей, например, заменители мясного и молочного сырья, протеиновые добавки, усилители вкуса и т.д. [8].
Методы и принципы исследования
Объектами исследования были выбраны два ферментных препарата – Протозим С (производства компании «Энзим», г. Ладыжин) и Флаворзим 1000 Л (Flavourzyme 1000 L) (производства компании «Novozymes», Дания). Оба ферментных препарата являются ферментами грибного происхождения.
Продуцентом Протозим С является гриб - Acremonium chrysogenum, а Флаворзим 1000 Л - Aspergillus oryzae.
Определение внешнего вида и цвета ферментных препаратов проводили следующим образом: 3,00 г исследуемого препарата помещали на гладкую чистую поверхность листа белой бумаги и визуально определяли внешний вид и цвет, перемешивая при естественном свете; 5 мл исследуемого препарата наливали в пробирку и визуально определяли внешний вид и цвет.
Протеолитическую активность ферментных препаратов проводили согласно рекомендациям - ГОСТ 34430-2018. Ферментные препараты для пищевой промышленности. Метод определения протеолитической активности [9].
Определение pH-профиля протеолитической активности ферментов проводили при 30-70 ℃ в диапазоне значений pH от 3,0 до 11,0. Для рН-профиля активности Протозим С измерения проводили при 55 ℃ в диапазоне значений pH от 4,0 до 11,0. Для рН-профиля активности Флаворзим 1000 Л измерения проводили при 50 ℃ в диапазоне значений pH от 4,0 до 9,0. Для создания растворов с заданным значением pH использовали 0,1 М универсальный буфер. Определение температурного профиля активности Протозим С проводили при рН 9 в диапазоне температур от 30 до 70℃; температурного профиля активности Флаворзим 1000 Л – при рН 7-7,5 в диапазоне температур от 40 до 60 ℃.
В кислой зоне рН от 3,0 до 6,0 протеолитическую активность определяли по отношению к гемоглобину, а в щелочной зоне рН от 7,0 до 12,0 – по отношению к казеинату натрия, используя 0,1М универсальный буфер. Определение оптимумов температуры (30–90 °С) проводили, используя 0,1М карбонатно-бикарбонатный буфер, при pH 10,0, измеряя активность протеазы по отношению к казеинату натрия. Оптимальными считали рН и температуру, при которых протеаза проявляла не менее 80 % активности от максимальной [10], [11].
Основные результаты
На первом этапе исследований были изучены основные физико-химические и органолептические показатели ферментных препаратов (таблица 1 и 2).
Таблица 1 – Физико-химические и органолептические показатели Протозим С
| Показатель | Норма | Значение |
| Физико-химические и органолептические показатели | ||
| Внешний вид | Порошок | Порошок |
| Цвет | От белого до коричневого | Коричневый |
| Запах | Типовой для ферментов | Соответствует, легкий запах брожения |
| Активность протеолитическая (ФОЛП), ед/г не менее | 5000,0 | 50381,3 |
Таблица 2 – Физико-химические и органолептические показатели Флаворзим 1000 Л
| Показатель | Норма | Значение |
| Физико-химические и органолептические показатели | ||
| Внешний вид | Жидкость или порошок | Жидкость |
| Цвет | Темно коричневый | Темно коричневый |
| Запах | Типовой для ферментов | Соответствует |
| Активность протеолитическая, г/мл не менее | 800 | 1200 |
По физико-химическим и органолептическим показателям ферментные препараты соответствуют требованиям, предъявляемым в нормативных документах.
На рисунках 1 и 2 представлены зависимости активности Протозим С и Флаворзим 1000 Л от pH.
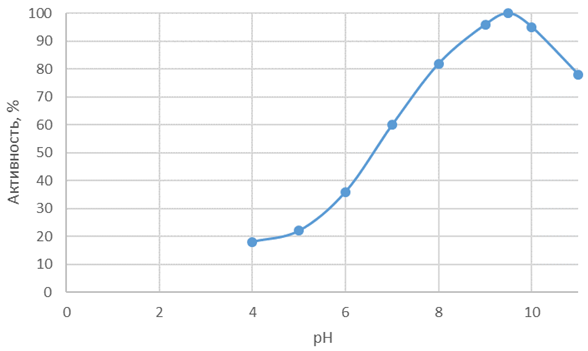
Рис. 1 – Зависимость активности Протозим С от pH
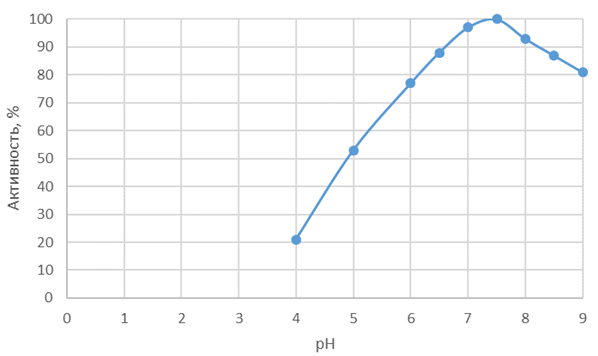
Рис. 2 – Зависимость активности Флаворзим 1000 Л от pH
Оптимум pH среды составляет для Протозим С – 8-10,5, для Флаворзим 1000 Л – 6,5-7,5. Для протеолиза ферментным препаратом Протозим С следуют подбирать слабо щелочные и щелочные среды, что в дальнейшей усложнить технологические операции по биотрансформации сырья. Поэтому по pH профилю наиболее привлекательным в технологическом плане следует считать Флаворзим 1000 Л [12].
На рисунках 3 и 4 представлены зависимости активности Протозим С и Флаворзим 1000 Л от температуры.
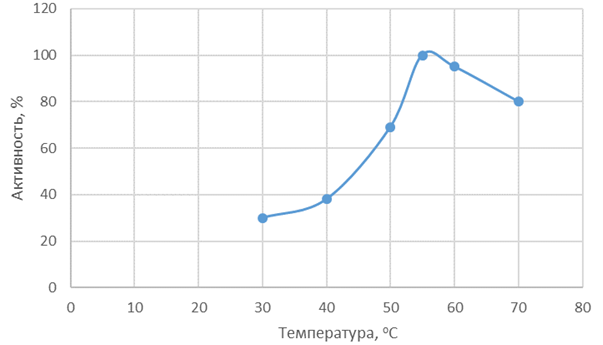
Рис. 3 – Зависимость активности Протозим С от температуры
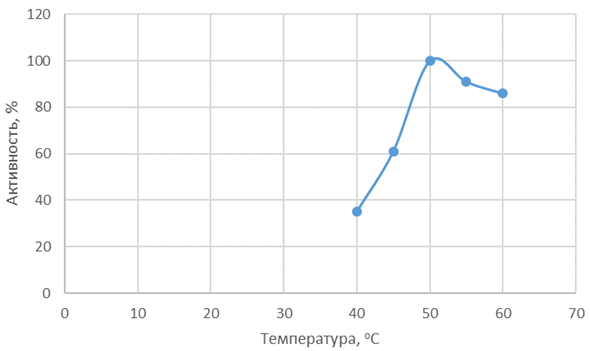
Рис. 4 – Зависимость активности Флаворзим 1000 Л от температуры
Протозим С наиболее активен в диапазоне температур 50-65 °С, максимальная активность Флаворзим 1000 Л проявляется при температуре 50 °С. Флаворзим 1000 Л по оптимуму температурного действия также является более перспективным ферментным препаратом, за счет того, что протеолиз сырья можно проводить при более «мягких» режимах.
ЗаключениеОба ферментных препарата обладают высокой протеолитической активностью. Протозим С можно рекомендовать как ферментный препарат для переработки вторичного сырья, в частности для производства гидролизатов, так как pH (8-10,5) и температурный оптимум действия (50-65 °С) подходит для гидролиза коллагенсодержащего сырья. Флаворзим 1000 Л работает в нейтральной среде (pH=6,5-7,5) и проявляют свою активность при температуре 50 °С, поэтому его можно рекомендовать как препарат широко действия для биотрансформации животного сырья.
| Финансирование Статья выполнена при поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011. | Funding The work was supported by Act 211 of the Government of the Russian Federation, contract № 02.A03.21.0011. |
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Кислухина, О.В. Ферменты в производстве пищи и кормов / О.В. Кислухина. – М.: ДеЛи принт, 2002. – 336 с.
- Mienda B.S. An overview of microbial proteases for industrial applications / Mienda B.S., Yahya A., Galadima I.A., Shamsir M.S. // Research Journal of Pharmaceutical, Biological and Chemical Sciences. – 2014. – v. 5(1). – P. 388–396.
- Meyer V. Genetic engineering of filamentous fungi – progress, obstacles and future trends / Meyer V. // Biotechnology Advances. – 2008. – v. 26. – P. 177–185.
- Bamforth C.W. Current perspectives on the role of enzymes in brewing / Bamforth C.W. // Journal of Cereal Science. – 2009. – v. 50. – P. 353–357.
- Adrio J.l. Microbial enzymes: tools for biotechnological processes / Adrio J.l., Demain A.l. // Biomolecules. – 2014. – v. 4. – P. 117–139.
- Kumar N.S. A review on microbial proteases / Kumar N.S., P.S. Sreeja Devi, Nair A.S. // International Journal of Advanced Research. – 2016. – v. 4(7). – P. 2048–2053.
- Souza P.M. A biotechnology perspective of fungal proteases / Souza P.M., Bittencourt M.L., Caprara C.C., Freitas M., et al. // Brazilian Journal of Microbiology. – 2015. – v. 46(2). – P. 337–346.
- Соколова, Т.В. Применение ферментных препаратов в народном хозяйстве / Т.В. Соколова // Пищевая промышленность. – 2001. – № 6. – С. 37–38.
- ГОСТ 34430-2018. Ферментные препараты для пищевой промышленности. Метод определения протеолитической активности. – М.: Стандартинформ. – 2018. – 16 c.
- Антипова Л.В. Методы исследования мяса и мясных продуктов / Л.В. Антипова, И.А. Глотова, И.А. Рогов. - М.: Колос, 2001. - 376 с.
- Ovissipour, M. The effect of enzymatic hydrolysis time and temperature on the properties of protein hydrolysates from the Persian sturgeon (Acipenser persicus) viscera / M. Ovissipour, A. M. Abedian, A. Motamedzadegan, B. Rasco, R. Safari, H. Shahiri // Food Chemistry. – 2009. – v. 115. – P. 238–242.
- Márquez U.M.L. Caracterização de hidrolisados enzimáticos de pescado / U.M.L. Márquez, N.V.M. Mira, R.A.M. Neves // Ciência e Tecnologia de Alimentos. – 2004. – v. 24. – P. 101–108.
Список литературы на английском языке / References in English
- Kislukhina, O. V. Fermenty v proizvodstve pishhi i kormov [Enzymes in Food and Feed Production] / O. V. Kislukhina , M.: DeLi print, 2002, 336 p. [in Russian]
- Mienda B.S. An overview of microbial proteases for industrial applications / Mienda B.S., Yahya A., Galadima I.A., Shamsir M.S. // Research Journal of Pharmaceutical, Biological and Chemical Sciences. — 2014 — Vol. 5(1) — pp. 388–396.
- Meyer V. Genetic engineering of filamentous fungi – progress, obstacles and future trends / Meyer V. // Biotechnology Advances. – 2008. – Vol. 26. – pp. 177–185.
- Bamforth C.W. Current perspectives on the role of enzymes in brewing / Bamforth C.W. // Journal of Cereal Science. – 2009. – Vol. 50. – pp. 353–357.
- Adrio J.L. Microbial enzymes: tools for biotechnological processes / Adrio J.L., Demain A.L. // Biomolecules. – 2014. – v. 4. – pp. 117–139.
- Kumar N. S. A review on microbial proteases / Kumar N. S., P. S. Sreeja Devi, Nair A. S. // International Journal of Advanced Research. – 2016. – Vol. 4(7). – pp. 2048–2053.
- Souza P. M. A Biotechnology Perspective of Fungal Proteases / Souza P.M., Bittencourt M.L., Caprara C.C., Freitas M., et al. // Brazilian Journal of Microbiology. – 2015. – Vol. 46(2). – pp. 337–346.
- Sokolova T. V. Primenenie fermentnyh preparatov v narodnom hozyajstve [The Use of Enzyme Preparations in the National Economy] / T. V. Sokolova // Food Industry, 2001, no. 6, pp. 37-38. [in Russian]
- GOST 34430-2018. Fermentnye preparaty dlja pishhevoj promyshlennosti [Enzyme Preparations for the Food Industry Method for Determining Proteolytic Activity] - M.: Standartinform. - 2018. - 16 p. [in Russian]
- Antipova L. V. Metody issledovanija mjasa i mjasnyh produktov [Methods of Research of Meat and Meat products] / Antipova L. V., Glotova I. A., Rogov I. A. – M.: Kolos, 2001. – 376 p. [in Russian]
- Ovissipour, M. The effect of enzymatic hydrolysis time and temperature on the properties of protein hydrolysates from the Persian sturgeon (Acipenser persicus) viscera / M. A. M. Ovissipour A. M. Abedian, A. Motamedzadegan, B. Rasco, R. Safari, H. Shahiri // Food Chemistry. – 2009. – Vol. 115. – pp. 238–242.
- Márquez U.M.L. Caracterização de hidrolisados enzimáticos de pescado / U.M.L. Márquez, N.V.M. Mira, R.A.M. Neves // Ciência e Tecnologia de Alimentos. – 2004. – v. 24. – pp. 101–108.
