БИОАКТИВНЫЙ КЕРАТИН КАК ФУНКЦИОНАЛЬНАЯ СЕРОСОДЕРЖАЩАЯ КОРМОВАЯ ДОБАВКА
БИОАКТИВНЫЙ КЕРАТИН КАК ФУНКЦИОНАЛЬНАЯ СЕРОСОДЕРЖАЩАЯ КОРМОВАЯ ДОБАВКА
Научная статья
Сапожникова А.И.1, *, Есепенок К.В.2
1 ORCID: 0000-0001-5040-6998;
2 ORCID: 0000-0002-3085-6577;
1, 2 Московской государственной академии ветеринарной медицины и биотехнологии – МВА имени К.И. Скрябина, Москва, Россия
* Корреспондирующий автор (fibrilla[at]mail.ru)
АннотацияВ статье представлены результаты исследований аминокислотного состава препарата Биоактивный кератин и проведена оценка возможностей его использования как функциональной серосодержащей кормовой добавки, влияющей на состояние волосяного покрова шкурок серебристо-черной лисицы. Показано, что аминокислотный профиль Биоактивного кератина представлен 16 аминокислотами. При этом содержание незаменимых аминокислот составляет 28,4%, соотношение незаменимых аминокислот к заменимым - 1:2,53. Уровень содержания серосодержащих аминокислот близок к референсным значениям. Установлено, что использование функциональной серосодержащей кормовой добавки Биоактивный кератин в концентрации 0,2 % от суточной нормы белка в основном рационе способствует повышению массы убойного молодняка лисиц породы серебристо-черной на 11,0 % по сравнению с контролем. Кормовая добавка Биоактивный кератин (0,2%) оказывает достоверно выраженное влияние на массу и площадь шкурок лисицы серебристо-черной - 7,4% и 6,5%, соответственно, а также способствует увеличению густоты волосяного покрова шкурок лисицы серебристо-черной на 10,5% по сравнению с контролем.
Ключевые слова: кормовая добавка, аминокислотный состав, качество шкурок, серебристо-черная лисица, гидролизат, белок, кормление.
BIOACTIVE KERATIN AS A FUNCTIONAL SULFUR-CONTAINING FEED ADDITIVE
Research article
Sapozhnikova A.I.1, *, Esepenok K.V.2
1 ORCID: 0000-0001-5040-6998;
2 ORCID: 0000-0002-3085-6577;
1, 2 Skryabin Moscow State Academy of Veterinary Medicine and Biotechnology, Moscow, Russia
* Corresponding author (fibrilla[at]mail.ru)
AbstractThe paper describes the results of studies of the amino acid composition of bioactive keratin and assesses the possibilities of its use as a functional sulfur-containing feed additive that affects the condition of the pelage of a silver fox. The research demonstrates that the amino acid profile of bioactive keratin is represented by 16 amino acids. The content of essential amino acids is 28.4%, the ratio of essential amino acids to non-essential ones is 1:2.53. The level of sulfur-containing amino acids is close to the reference values. It was concluded that the use of the functional sulfur-containing bioactive keratin feed additive at a concentration of 0.2 % of the daily value of protein in the diet mainly contributes to the increase in the weight of young silver foxes for slaughter by 11.0% compared to control measurements. The bioactive keratin feed additive (0.2%) has a significantly pronounced effect on the weight and area of silver fox skins - 7.4% and 6.5%, respectively, and also contributes to an increase in the hair density of silver fox skins by 10.5% compared to the control measurements.
Keywords: feed additive, amino acid composition, skin quality, silver fox, hydrolysate, protein, feeding.
ВведениеПри переработке сырья животного происхождения на шерстеперерабатывающих, кожевенных и меховых предприятиях в процессе получения основной товарной продукции на отдельных этапах технологических процессов образуется достаточно большое количество отходов и побочных продуктов в виде шерстяного и мехового очеса, скотоволоса, щетины. Подобная ситуация чревата возникновением серьезных экологических проблем, решением которых может стать только практика их эффективной утилизации в виде вторичной переработки с максимальным извлечением наиболее ценных компонентов и их дальнейшим использованием по целевому назначению [4].
Основным структурным компонентом перечисленных выше отходов является фибриллярный белок кератин. Как известно, природный биополимер кератин, точнее сказать, кератины, являются основой производных эпидермиса кожи, состоят из параллельных полипептидных цепей, имеющих конформацию α-спирали или β-структур (структур складчатого листа). Альфа -кератины относятся к большому классу механически прочных гомологичных белковых веществ, они формируют наружные защитные покровы позвоночных. Кератинсодержащие ткани представляют собой сложные многокомпонентные биологические образования, состоящие из отдельных клеток, формирующих их различные гистоструктурные элементы [5]. Кератин обладает уникальным комплексом свойств благодаря высокому содержанию в первичной структуре молекулы серосодержащих аминокислот и множества дисульфидных связей [6], [14]. Для первичной структуры альфа-кератинов характерно большое содержание цистеина, который образуется из незаменимой аминокислоты метионин. Кератин примерно на четверть состоит из цистеина. Цистеин насыщает органической серой клетки волос, что улучшает их структуру и прочность [19]. При объединении двух молекул цистеина образуется аминокислота цистин, представляющая собой продукт окислительной димеризации цистеина, в ходе которой две тиольные группы цистеина образуют дисульфидную связь цистина. Цистин играет важную роль в синтезе белка. Именно он определяет тип свертывания спиральных структур кератина и, соответственно, форму белка [15].
В свете имеющихся научных данных считается, что аминокислотный состав кератиновых белков позволяет положительно оценить перспективы использования этих малоценных вторичных продуктов в звероводстве [3], [9]. У растущих зверей наиболее высока потребность в аминокислотах, содержащих серу. Эти аминокислоты необходимы для роста волоса, протеины которого содержат около 15% цистина [8]. Посредством повышения доступности ключевых аминокислот, содержащихся в кератине, можно стимулировать рост новых волос [7], [11].
Что касается способов получения гидролизатов из кератинсодержащего сырья, то вследствие его высокой механической прочности, обусловленной наличием дисульфидных, ионных, солевых и водородных связей, и устойчивости к действию физических, химических и биологических агентов, ни щелочной, ни кислотный, ни ферментный гидролиз с использованием классических протеаз не могут сохранить максимально полный, в качественном и количественном отношении, набор аминокислот, и особенно серосодержащих [18]. Для восполнения дефицита незаменимых аминокислот в кормах отечественного производства на практике приходится использовать синтетические формы лизина и метионина, что существенно увеличивает стоимость продукции [9].
В связи с вышеизложенным, добавление к типовым рационам пушных зверей кормовой добавки в виде дополнительного источника серосодержащих аминокислот может оказать определенное положительное влияние на качество шкурковой продукции.
Для того, чтобы не нарушать баланс рациона кормления, мы сочли целесообразным включить добавку в корм постадийно, используя Биоактивный кератин с концентрацией 0,2% шестикратно, пятидневными курсами с 10-ти дневными перерывами.
Альтернативой техническим решениям получения продуктов полного гидролиза кератинсодержащих отходов, на наш взгляд, может стать неполное, ступенчатое гидролитическое расщепление фибриллярного кератина, не затрагивающее третичную структуру белка, позволяющее получить биологически активную субстанцию молекулярно-диспергированного кератина с полностью сохраненным набором аминокислот, включая и серосодержащие [17].
Для того, чтобы кератин, как, впрочем, и другие белковые компоненты основного рациона, в такой форме при попадании в организм усвоился, необходимо, чтобы вначале произошло разрушение всех различных видов химических связей, формирующих полипептидные цепочки в макромолекулах кератина, и только потом после высвобождения аминокислот начался процесс их усвоения. Такой алгоритм активизируется работой ферментных систем желудочно-кишечного тракта и будет способствовать интенсификации обменных процессов в организме молодняка, причем более длительное усвоение позволит насытить мышцы зверей большим количеством аминокислот и будет положительно влиять на массу тела и другие показатели, характеризующие физиологический статус, в частности, повысит энергетические затраты на динамическую активность и функционирование сердечно-сосудистой системы [12].
Цель данного исследования – изучение аминокислотного состава препарата Биоактивный кератин и оценка возможностей его использования как специфической серосодержащей кормовой добавки, влияющей на состояние волосяного покрова шкурок серебристо-черной лисицы.
Объект и методы исследованияОбъектом исследования служил Биоактивный кератин, полученный из шерстяного очеса овец по запатентованной нами методике [2].
Исследование аминокислотного состава Биоактивного кератина было проведено в лаборатории физико-химических исследований ВНИИПП на ВЭЖХ-анализаторе аминокислот с пост-колоночной дератизацией нингидрином (AAA-Hydr, KNAUER, Германия). Массовую долю аминокислот определяли методом распределительной хроматографии после гидролиза белков.
Проверка влияния Биоактивного кератина на рост и развитие молодняка лисиц породы серебристо-черной выполнена на базе АО «Племенной зверосовхоз «Салтыковский» на 20 самцах в возрасте 2-х месяцев, которым кератин добавляли к основному рациону в количестве 0,2% от массы белковой составляющей корма. Контролем служили интактные звери. Звери были разделены на две группы (по 10 зверей в каждой) методом сбалансированных групп-аналогов.
В качестве тестовых показателей, указывающих на целесообразность применения Биоактивного кератина, использовали данные, характеризующие живую массу зверей, в ходе опыта взвешивали индивидуально с точностью до 0,01 кг [21], площадь полученных шкурок [1], густоту волосяного покрова методом прямого подсчёта и подсчётом количества волосяных фолликулов в поле зрения микроскопа на горизонтальных срезах [22].
Обработку полученных данных проводили, используя пакет программ MS Office 2010.
Результаты и их обсуждение
Итоговые результаты экспериментов по определению аминокислотного состава Биоактивного кератина представлены в таблице 1.
Таблица 1 – Аминокислотный состав Биоактивного кератина
| № п/п | Название аминокислоты | Содержание аминокислот, % (в пересчете на сухое вещество) | Референсные значения ** |
| 1 | Аспарагиновая кислота / Asp | 7,04 | 6,4-7,3 |
| 2 | Треонин / Thr* | 5,41 | 6,6-6,7 |
| 3 | Серин / Ser | 6,70 | 7,2-9,5 |
| 4 | Глутаминовая кислота / Gln | 12,90 | 13,1-16,0 |
| 5 | Пролин / Pro | 4,92 | 5,3-8,1 |
| 6 | Цистин / Cys | 10,67 | 11,0-13,7 |
| 7 | Цистеин / Cys | - | - |
| 8 | Глицин / Gly | 4,65 | 5,2-6,5 |
| 9 | Аланин / Ala | 2,91 | 3,4-4,4 |
| 10 | Валин / Val* | 4,94 | 5,0-5,9 |
| 11 | Метионин / Met* | 0,39 | 0,5-0,7 |
| 12 | Изолейцин / Ile* | 2,83 | 3,1-4,5 |
| 13 | Лейцин / Leu* | 6,85 | 7,6-8,1 |
| 14 | Тирозин / Tyr | - | 4,0-6,4 |
| 15 | Фенилаланин / Phe* | 2,74 | 3,4-4,0 |
| 16 | Гистидин / His* | 0,64 | 0,7-1,1 |
| 17 | Лизин / Lys | 2,39 | 2,8-3,3 |
| 18 | Аргигин / Arg | 8,03 | 9,2-10,6 |
| 19 | Оксипролин / Hyp | - | - |
| 20 | Оксилизин / Оxylis | - | - |
| Итого | 84,01 | 85,3-106,2 | |
Согласно нашим данным, аминокислотный профиль Биоактивного кератина представлен 16 аминокислотами из 20. Из них к незаменимым относятся гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин и валин, к заменимым - аланин, аргинин, аспарагиновая кислота, цистин, глютаминовая кислота, глицин, пролин, серин [10]. Отсутствуют оксипролин и оксилизин, которые являются основными аминокислотами в коллагене, не обнаружены тирозин и цистеин.
Важным фактором является наличие серосодержащих аминокислот, необходимых для синтеза кератина: незаменимой – метионина и заменимой аминокислоты - цистина, образующейся путем окисления цистеина. Отсутствие цистеина в Биоактивном кератине свидетельствует о том, что кератин находится в солюбилизированный форме, а также о наличии сохраненных дисульфидных связей, образуемых остатками цистина, входящими своими двумя половинками в две различные полипептидные цепочки. Дисульфидная связь, образуемая остатками цистина (диамино-дикарбоновой кислоты), считается основным типом ковалентной связи между полипептидными цепочками в макромолекуле кератинов [13], [16], [20]. Установленный факт также подтверждает наличие органической серы в солюбилизированным кератине.
Анализ полученных результатов свидетельствует о высоком содержании в молекулярно-диспергированном кератине таких аминокислот, как глутаминовая кислота (12,90%) и цистин (10,67%), среднем количественном уровне содержания аргинина (8,03%), серина (6,70%), лейцина (6,85%), треонина (5,41%), валина (4,94%), пролина (4,92%), глицина (4,65%) и низком – аланина (2,91%), изолейцина (2,83 %), фенилаланина (2.74%), метионина (0,39%), и гистидина (0,64%). Содержание незаменимых аминокислот в Биоактивном кератине составляет 28,4% Соотношение незаменимых аминокислот к заменимым - 1:2,53.
Наличие в составе Биоактивного кератина значительного количества остатков дикарбоновых аминокислот (аспарагиновой и глутаминовой), а также аминокислот основного характера (лизина, аргинина и гистидина) указывает на возможность ионного взаимодействия между отдельными фрагментами структуры белка как на внутримолекулярном, так и межмолекулярном уровнях, а также на вероятность химических реакций с реагентами основного и кислотного характера, что весьма важно для последующего расщепления этого белка в желудочно-кишечном тракте.
Как следует из данных таблицы, в Биоактивном кератине присутствуют глицин, аланин и серин - аминокислоты, имеющие небольшую молекулярную массу. Наличие в Биоактивном кератине таких гидроксилсодержащих аминокислот как серин и треонин говорит о его способности взаимодействовать с веществами, вступающими в реакцию по месту расположения гидроксильных групп, а также о наличии интенсивно развитой системы водородных связей, что в свою очередь, подтверждает биологическую активность данного продукта.
Анализ аминокислотного состава Биоактивного кератина позволил получить информацию об основных компонентах, из которых построены полипептидные цепи солюбилизированного до состояния макромолекул кератина, об активных группах, участвующих в образовании межмолекулярных связей и в значительной степени определяющих свойства этого уникального белка, а также спрогнозировать возможные изменения под влиянием различных реагентов основного и кислотного характера. Вышеизложенное дало основание для апробации Биоактивного кератина в качестве функциональной серосодержащей кормовой добавки и оценить его влияние на качество волосяного покрова шкурок, полученных от молодняка лисицы породы серебристо-черной.
Для подтверждения целесообразности применения функциональной серосодержащей кормовой добавки Биоактивный кератин в концентрации 0,2% от суточной нормы белка была проведена апробация на базе АО «Племенной зверосовхоз «Салтыковский».
В течение апробации за зверями вели наблюдение и проводили взвешивание в начале (июнь) и в конце (ноябрь) опыта. Данные измерения живой массы лисиц породы серебристо-черной представлены в таблице 2.
Таблица 2 – Динамика массы тела молодняка лисиц породы серебристо-черной (Vulpes vulpes L.)
| № п/п | Рацион | Кол-во зверей | Период взвешивания, кг | |
| июнь | ноябрь | |||
| I | Основной рацион (ОР) | 10 | 2,74 ± 0,10 | 5,26 ± 0,07 |
| II | Основной рацион + Биоактивный кератин (0,2% от суточной нормы белка) (ОР+БК) | 10 | 2,78 ± 0,04 | 6,12 ± 0,09 |
К концу исследований (ноябрь) масса убойного молодняка лисиц породы серебристо-черной (группа II), получавших функциональную серосодержащую кормовую добавку Биоактивный кератин в концентрации 0,2% от суточной нормы белка стала больше на 16,3%, чем в контрольной группе.
Данные, характеризующие площадь и массу шкурок лисицы серебристо-черной, полученных по окончании производственной апробации функциональной серосодержащей кормовой добавки Биоактивный кератин на базе АО «Племенной зверосовхоз «Салтыковский», обобщены в таблице 3.
Таблица 3 – Площадь и масса шкурок лисицы серебристо-черной (Vulpes vulpes L.)
| Группа | Кол-во шкурок | Площадь, см2 | Масса, г |
| I (ОР * - контроль) | 10 | 1972,0 ± 6,3 | 384,2 ± 3,5 |
| II (ОР + БК ** (0,2% - опыт) | 10 | 2217,4 ± 3,6 | 421,6 ± 1,9 |
Как следует из представленных в данной таблице данных, площадь и масса шкурок лисицы серебристо-черной, получавших функциональную серосодержащую кормовую добавку Биоактивный кератин в концентрации 0,2% от суточной нормы белка, увеличились по сравнению с аналогичными показателями для контрольной группы на 12,4% и 9,7%, соответственно.
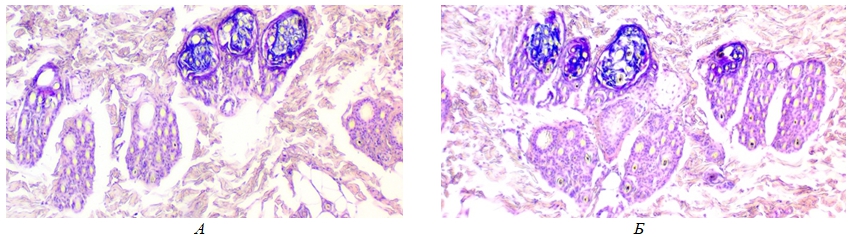
Данные, характеризующие густоту волосяного покрова шкурок, представлены в таблице 4 и на рисунке 1.
Таблица 4 – Густота волосяного покрова шкурок лисицы серебристо-черной (Vulpes vulpes L.)
| Наименование группы | Кол-во шкурок | Густота волосяного покрова, см2, сред. знач. | Количество волосяных фолликул в поле зрения микроскопа, M±m | |
| первичные | вторичные | |||
| I (ОР * (контроль) | 10 | 13241,4 | 6,3 ± 0,4 | 132,6 ± 8,1 |
| II (ОР + БК ** (0,2%) | 10 | 14625,7 | 7,2 ± 0,3 | 172,4 ± 2,1 |
Полученные результаты свидетельствуют о том, что применение функциональной серосодержащей кормовой добавки Биоактивный кератин в концентрации 0,2% от суточной нормы белка обеспечивает ускорение процессов созревания вторичных фолликулов, в результате чего увеличивается количество волос на единицу площади.
Рис. 1 – Горизонтальные гистосрезы кожевой ткани шкурок лисицы серебристо-черной (Vulpes vulpes L.): А – при использовании основного рациона, Б – при использовании основного рациона и функциональной серосодержащей кормовой добавки Биоактивный кератин
Примечание: увеличение 10х / 0.25Из рисунка 1 видно, что наибольшее количество волосяных фолликулов отмечено на срезе Б, что коррелирует с данными по густоте волос, полученными методом прямого подсчета.
Заключение
Обобщая полученные результаты, следует отметить, что использование функциональной серосодержащей кормовой добавки Биоактивный кератин в концентрации 0,2% от суточной нормы белка к основному рациону увеличивает набор массы зверей 1,2 раза, по сравнению с контрольной группой.
Установлено, что функциональная серосодержащая кормовая добавка Биоактивный кератин (0,2%) оказывает выраженное влияние на массу и площадь шкурок лисицы серебристо-черной из опытной группы по сравнению с контролем – 12,4% и 9,7%, соответственно.
Доказано, что функциональная серосодержащая кормовая добавка Биоактивный кератин в концентрации 0,2% от суточной нормы белка способствует увеличению густоты волосяного покрова шкурок лисицы серебристо-черной на 18,7% по сравнению с контролем.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- ГОСТ 2790-88. Шкурки лисицы клеточного разведения невыделанные. Технические условия: межгосударственный стандарт: издание официальное: утвержден и введен в действие Постановлением Государственного комитета СССР по стандартам от 28.06.88 №2435: дата введения 1991-10-01. – Москва : Изд-во стандартов. - 1992. – 13 с.
- Патент №2092072 С1 Российская Федерация, МКИ6 А23К 1/10 (2006.01). Способ получения кератина: №95117245-13: заявл. 06.10.95: опубл. 10.10.97 / Сапожникова А.И., Каспарьянц С.А., Месропова Н.В., Гордиенко Н.М. – 7 с.
- Бабич О.О. Переработка вторичного кератинсодержащего сырья и получение белковых гидролизатов на пищевые и кормовые цели / О.О. Бабич, И.С. Разумникова, А.Ю. Полетаев, А.И. Морозова // Техника и технология пищевых производств. - 2011.- №2 (21). - С. 7-11.
- Барабащиков, Д.М. Утилизация промышленных отходов / Д.М. Барабанщиков, А.Ф. Сердюкова // Молодой ученый. - 2017. – 25 (159). - С. 101-104.
- Бортников, С.В. Получение растворимой модификации кератина из белоксодержащих отходов животноводства / С.В. Бортников, Г.А. Горенкова // Успехи современного естествознания. – 2018. – № 4. – С. 17 – 22.
- Гавриляк, В.В. Характеристика структуры кератиновых волокон разных типов / В.В. Гавриляк // Вестник Одесского национального университета. Биология. - 2013. - Т. 18. - № 3 (32). - С. 9-15.
- Гребенева, Ю.С. Влияние кормовых добавок из продуктов рециклинга кератинсодержащих отходов на качество шкурок норки / Ю.С. Гребенева, А.И. Сапожникова // В сборнике: Товароведение, технология и экспертиза: инновационные решения и перспективы развития.Материалы национальной научно-практической конференции. - 2018. - с. 280-290.
- Перельдик, Н.Ш. Кормление пушных зверей / Н.Ш. Перельдик, Л.В. Милованов, А.Т. Ерин. - 2-е изд., перераб. и доп. – Москва : Колос. - 1981.
- Полетаев, А.Ю. Особенности переработки белкового сырья в полноценные корма для сельскохозяйственных животных / А.Ю. Полетаев, М.Г. Курбанова // Техника и технология пищевых производств. – 2010. - № 3 (18). - с. 29-34.
- Руденко А.О. Определение важнейших аминокислот в сложных объектах биологического происхождения методом обращённо-фазовой ВЭЖХ с получением фенилтиогидантоинов аминокислот / А.О. Руденко А.О., Л.А. Карцова, С.И. Снарский // Сорбционные и хроматографические процессы. - 2010. - Т. 10.- № - с. 223-230.
- Сапожникова, А.И. Физиологический статус и качество шкурок у молодняка серебристо-черной лисицы (vulpes vulpes l.) При применении противопаразитарного препарата ниацид-гранулы плюс с биоактивным кератином как кормовой добавкой / А.И. Сапожникова, К.В. Есепенок, Г.Ю. Косовский, Е.А. Тинаева, М.Н. Мирзаев, Е.Г. Квартникова, Б.В. Новиков, Т.М. Чекалова // Сельскохозяйственная биология. - 2019. - Т. 54.- № - с. 1154-1166.
- Слесаренко, Н.А. Биологическая оценка влияния белкового гидролизата на организм норок / Н.А. Слесаренко, П.Н. Абрамов // Российская сельскохозяйственная наука. - 2019.- № - с. 52-54.
- Chen V. M. Allosteric disulfide bonds in thrombosis and thrombolysis / V.M. Chen, P.J. Hogg // J. Thromb. and Haemost. - 2006. - V. 4. - P. 2533-2541.
- Gillespie, J.M. The structural Proteins of Hair: Isolation, characterization, and regulation of biosynthesis / J.M. Gillespie // In Physiology, biochemistry and molecular biology of skin: Oxford, 1991. - P. 625-658.
- Hesse, H. Molecular analysis and control of cysteine biosynthesis: integration of nitrogen and sulphur metabolism / H. Hesse, V. Nikiforova, B. Gakiere, R. Hoefgen // Journal of Experimental Botany. - 2004. - Vol. 55. - № 401. - P. 1283.
- Hogg P.J. Allosteric disulfide bonds / P.J. Hogg, J.W.H. Wong // Protein Reviews. - 2011. - Vol. 14. - P. 151-182.
- Nikolaev I.V. Enzymatic hydrolysis of keratin-containing stock for obtaining protein hydrolysates / I.V. Nikolaev, I.D. Keruchenko, E.V. Stepanova, A.D. Satrutdinov, V.P. Khotchenkov, V.G. Volik, O.V. Koroleva, N.L. Eremeev, A.P. Sinitsyn, S.V. Zinovev, D.Y. Ismailova, N.V. Tsurikova // Applied Biochemistry and Microbiology. - 2009. - Vol. 45.- № 6. - Р. 648-655 (DOI:1134/S0003683809060131)
- Prosekov, A. Drying parameters of hydrolysates of keratin-containing raw materials / A. Prosekov, A. Petrov, E. Ulrich, L. Dyshlyuk, V. Dolganuk // Research Journal of Pharmaceutical, Biological and Chemical Sciences. - 2016. - Vol. 7.- № 4. - PP. 1589-1593.
- Ramms, L. Keratins as the main component for the mechanical integrity of keratinocytes / L. Ramms, G. Fabris, R. Windoffer, N. Schwarz [et al.] // PNAS USA. - 2013. – 110 (46). - PP. 18513-18518 (doi: 10.1073/pnas.1313491110).
- Woycechowsky K. J. Native disulfide bond formation in proteins / K. J. Woycechowsky, R.T. Raines // Curr. Opin. Chem. Biol. - 2000. - V.4. - P. 533-539.
- Помытко В. Н. Пушное звероводство и кролиководство / В. Н. Помытко и др. – Москва: Колос, 1982. – 123 с.
- Беседин А.Н. Товароведение пушно-меховых товаров / А.Н. Беседин, Ш.К. Ганцов. -Москва: Экономика, 1985.- 126 с.
Список литературы на английском языке / References in English
- GOST 2790-88. Shkurki lisicy kletochnogo razvedeniya nevy`delanny`e. Texnicheskie usloviya [Undressed skins of fox of cage breeding. Specifications : interstate standard]: mezhgosudarstvenny`j standart: official edition: utverzhden i vveden v dejstvie Postanovleniem Gosudarstvennogo komiteta SSSR po standartam ot 28.06.88 №2435: data vvedeniya 1991-10-01. – Moskva : Publ. house standartov. - 1992. – 13 p. [in Russian]
- 2092072 Russian Federation, MKI6 A23K 1/10 (2006.01). Sposob polucheniya keratina [Method of keratin preparing]: No. 95117245-13: Appl. 06.10.95: publ. 10.10.97 / Sapozhnikova A.I., Kasparyancz S.A., Mesropova N.V., Gordienko N.M. – 7 p. [in Russian]
- Babich O.O. Pererabotka vtorichnogo keratinsoderzhashhego sy`r`ya i poluchenie belkovy`x gidrolizatov na pishhevy`e i kormovy`e celi [Keratin containing waste processing and manufacture of albuminous hydrolysates for food and fodder purposes] / O.O. Babich, I.S. Razumnikova, A.Yu. Poletaev, A.I. Morozova // Texnika i texnologiya pishhevy`x proizvodstv [Food processing: techniques and technology]. - 2011. - № 2 (21). - P. 7-11. [in Russian]
- Barabashhikov D.M. Utilizaciya promy`shlenny`x otxodov [Utilization of industrial waste] / D.M. Barabanshhikov, A.F. Serdyukova // Molodoj ucheny`j [Young Scientist]. - 2017. – 25 (159). - P. 101-104. [in Russian]
- Bortnikov S.V. Poluchenie rastvorimoj modifikacii keratina iz beloksoderzhashhix otxodov zhivotnovodstva [Production of soluble modification of keratin from protein-containing animal wastes] / S.V. Bortnikov, G.A. Gorenkova // Uspexi sovremennogo estestvoznaniya [Success of modern natural science]. – 2018. – № 4. – P. 17 – 22. [in Russian]
- Gavrilyak V.V. Xarakteristika struktury` keratinovy`x volokon razny`x tipov [Structural characteristics of different types of keratin fibres] / V.V. Gavrilyak // Vestnik Odesskogo nacional`nogo universiteta. Biologiya [Bulletin of the Odessa National University. Biology]. - 2013. – Vol . 18. - № 3 (32). - P. 9-15. [in Russian]
- Grebeneva, Yu.S. Vliyanie kormovy`x dobavok iz produktov reciklinga keratinsoderzhashhix otxodov na kachestvo shkurok norki [Effect of feed additives from keratin-containing waste recycling products on the quality of mink skins] / Yu.S. Grebeneva, A.I. Sapozhnikova // V sbornike: Tovarovedenie, texnologiya i e`kspertiza: innovacionny`e resheniya i perspektivy` razvitiya. Materialy` nacional`noj nauchno-prakticheskoj konferencii [In the collection: Commodity research, technology and expertise: innovative solutions and development prospects. Materials of the national scientific and practical conference], Moscow - 2018. - P. 280-290. [in Russian]
- Perel`dik, N.Sh. Kormlenie pushny`x zverej [Feeding fur animals] / N.Sh. Perel`dik, L.V. Milovanov, A.T. Erin. - 2nd ed., Rev. and add. – Moscow: Kolos. - 1981. [in Russian]
- Poletaev, A.Yu. Osobennosti pererabotki belkovogo sy`r`ya v polnocenny`e korma dlya sel`skoxozyajstvenny`x zhivotny`x [Peculiarities of keratin-containing raw material processing and complete farm animal feed production on its basis] / A.Yu. Poletaev, M.G. Kurbanova // Texnika i texnologiya pishhevy`x proizvodstv [Food processing: techniques and technology]. – 2010. - № 3 (18). - P. 29-34. [in Russian]
- Rudenko A.O. Opredelenie vazhnejshix aminokislot v slozhny`x ob``ektax biologicheskogo proisxozhdeniya metodom obrashhyonno-fazovoj VE`ZhX s polucheniem feniltiogidantoinov aminokislot [Validation of assay method for certain amino acids in dosage forms by hplc method] / A.O. Rudenko A.O., L.A. Karczova, S.I. Snarskij // Sorbcionny`e i xromatograficheskie processy` [Sorption and chromatography processes]. - 2010. - Vol. 10. - № 2. - P. 223-230. [in Russian]
- Sapozhnikova, A.I. Fiziologicheskij status i kachestvo shkurok u molodnyaka serebristo-chernoj lisicy (vulpes vulpes l.) Pri primenenii protivoparazitarnogo preparata niacid-granuly` plyus s bioaktivny`m keratinom kak kormovoj dobavkoj [Physiological status and fur quality of young silver foxes (Vulpes Vulpes L.) under use of antiparasitic drug Niacid-granules plus and Bioactive keratin as a feed additive] / A.I. Sapozhnikova, K.V. Esepenok, G.Yu. Kosovskij, E.A. Tinaeva, M.N. Mirzaev, E.G. Kvartnikova, B.V. Novikov, T.M. Chekalova // Sel`skoxozyajstvennaya biologiya [Agricultural biology]. - 2019. - Vol. 54. - № 6. - P. 1154-1166. [in Russian]
- Slesarenko, N.A. Biologicheskaya ocenka vliyaniya belkovogo gidrolizata na organizm norok [Biological evaluation of the influence of protein hydrolysate on the organism of the monks] / N.A. Slesarenko, P.N. Abramov // Rossijskaya sel`skoxozyajstvennaya nauka [Russian agricultural science]. - 2019. - № 1. - P. 52-54. [in Russian]
- Chen V. M. Allosteric disulfide bonds in thrombosis and thrombolysis / V.M. Chen, P.J. Hogg // J. Thromb. and Haemost. - 2006. - V. 4. - P. 2533-2541.
- Gillespie, J.M. The structural Proteins of Hair: Isolation, characterization, and regulation of biosynthesis / J.M. Gillespie // In Physiology, biochemistry and molecular biology of skin: Oxford, 1991. - P. 625-658.
- Hesse, H. Molecular analysis and control of cysteine biosynthesis: integration of nitrogen and sulphur metabolism / H. Hesse, V. Nikiforova, B. Gakiere, R. Hoefgen // Journal of Experimental Botany. - 2004. - Vol. 55. - № 401. - P. 1283.
- Hogg P.J. Allosteric disulfide bonds / P.J. Hogg, J.W.H. Wong // Protein Reviews. - 2011. - Vol. 14. - P. 151-182.
- Nikolaev I.V. Enzymatic hydrolysis of keratin-containing stock for obtaining protein hydrolysates / I.V. Nikolaev, I.D. Keruchenko, E.V. Stepanova, A.D. Satrutdinov, V.P. Khotchenkov, V.G. Volik, O.V. Koroleva, N.L. Eremeev, A.P. Sinitsyn, S.V. Zinovev, D.Y. Ismailova, N.V. Tsurikova // Applied Biochemistry and Microbiology. - 2009. - Vol. 45.- № 6. - Р. 648-655 (DOI:1134/S0003683809060131)
- Prosekov, A. Drying parameters of hydrolysates of keratin-containing raw materials / A. Prosekov, A. Petrov, E. Ulrich, L. Dyshlyuk, V. Dolganuk // Research Journal of Pharmaceutical, Biological and Chemical Sciences. - 2016. - Vol. 7.- № 4. - PP. 1589-1593.
- Ramms, L. Keratins as the main component for the mechanical integrity of keratinocytes / L. Ramms, G. Fabris, R. Windoffer, N. Schwarz [et al.] // PNAS USA. - 2013. – 110 (46). - PP. 18513-18518 (doi: 10.1073/pnas.1313491110).
- Woycechowsky K. J. Native disulfide bond formation in proteins / K. J. Woycechowsky, R.T. Raines // Curr. Opin. Chem. Biol. - 2000. - V.4. - P. 533-539.
- Pomytko V. N. Pushnoe zverovodstvo i krolikovodstvo [Fur farming and rabbit breeding] / V. N. Politco and others – Moscow: Kolos, 1982. - 123 p. [in Russian]
- Besedin A. N. Tovarovedenie pushno-mehovyh tovarov [Commodity Science fur-fur goods] / A. N. Besedin, Sh. K. Gantsov. - Moscow: Ekonomika, 1983. - 126 p. [in Russian]