THE ROLE OF ENDOCIOSIS IN THE PROTECTION OF POLYMORPHONOADERIC LEUKOCYTES WITH HEAT SHOCK PROTEIN HTS70 FROM ENDOTOXIN ACTIVATION
РОЛЬ ЭНДОЦИТОЗА В ЗАЩИТЕ ПОЛИМОРФНОЯДЕРНЫХ ЛЕЙКОЦИТОВ БЕЛКОМ ТЕПЛОВОГО ШОКА БТШ70 ОТ АКТИВАЦИИ ЭНДОТОКСИНАМИ
Научная статья
Юринская М.М.1, Сусликов А.В.2, Евгеньев М.Б.3, Винокуров М.Г.4, *
1 ORCID: 0000-0003-4704-0395;
2 ORCID: 0000-0002-6108-8718;
3 ORCID: 0000-0002-3973-8454;
4 ORCID: 0000-0001-5743-2718,
1, 3 ,4 Институт биофизики клетки Российской академии наук, Пущино, Россия;
2 Больница Пущинского научного центра Российской академии наук, Пущино, Россия
* Корреспондирующий автор (mg-vinokurov[at]mail.ru)
Аннотация
В различных заболеваниях млекопитающих большое значение имеют эндотоксины (ЭТ) грамотрицательных энтеробактерий, вызывающие увеличение генерации активных форм кислорода (ROS) полиморфноядерными лейкоцитами (ПМЯЛ). Индуцибельный белок теплового шока человека Бтш70 при внеклеточном применении снижает продукцию ROS полиморфноядерными лейкоцитами, индуцированную ЭТ. В работе установлено, что в механизме защиты ПМЯЛ белком Бтш70 от активации клеток ЭТ важная роль принадлежит клатринзависимому и рецепторзависимым путям эндоцитоза Бтш70.
Ключевые слова: полиморфноядерные лейкоциты, эндотоксины, ROS, эндоцитоз, ингибиторы эндоцитоза, Бтш70.
THE ROLE OF ENDOCIOSIS IN THE PROTECTION OF POLYMORPHONOADERIC LEUKOCYTES WITH HEAT SHOCK PROTEIN HTS70 FROM ENDOTOXIN ACTIVATION
Research article
Yurinskaya M.M.1, Suslikov A.V.2, Evgen'ev M.B.3, Vinokurov M.G.4, *
1 ORCID: 0000-0003-4704-0395;
2 ORCID: 0000-0002-6108-8718;
3 ORCID: 0000-0002-3973-8454;
4 ORCID: 0000-0001-5743-2718,
1, 3, 4 Institute of Cell Biophysics, Russian Academy of Sciences, Pushchino, Russia;
2 Pushchino Research Center Hospital of the Russian Academy of Sciences, Pushchino, Russia
*Corresponding author (mg-vinokurov[at]mail.ru)
Abstract
Endotoxins (ET) of bile-tolerant gram-negative bacteria are of great importance in various diseases of mammals; they increase the generation of active forms of oxygen (ROS) by polymorphonuclear leukocytes (PMN). The inducible protein of human heat shock HSP70, when applied extracellularly, reduces ROS production by polymorphonuclear leukocytes induced by ET. It was established that clathrin-dependent and receptor-dependent pathways of Btsch70 endocytosis play an important role in the mechanism of PMNL protection by protein HSP70 from the activation of ET cells.
Keywords: polymorphonuclear leukocytes, endotoxins, ROS, endocytosis, endocytosis inhibitors, HSP70.
ВведениеЭндотоксины (ЭТ) грамотрицательных энтеробактерий, поступая в кровяное русло, участвуют в патогенезе различных болезней, в числе которых сепсис (часто отягощенный эндотоксиновым шоком), атеросклероз, метаболический синдром, почечная недостаточность, ожирение, процессы нейродегенерации и другие [1, С. 687], [2, С. 233]. Эндотоксины вызывают сборку и активацию NOX2 в клеточной мембране ПМЯЛ. Основной механизм активации ПМЯЛ ЭТ включает перенос ЭТ из мицелл к рецептору CD14 и последующее образование гетеродимерного рецепторного комплекса с TLR4 и цитоплазматическими адаптерными белками. После этого активирующий сигнал передается по различным TLR4-зависимым внутриклеточным сигнальным путям в ядро клеток [3, С. 55]. Помимо TLR4-зависимого пути поступления, ЭТ проникает в клетки клатринзависимым эндоцитозом [4, С. 1].
Важную роль в различных патологиях в организме млекопитающих играет главный стрессовый высококонсервативный белок теплового шока Бтш70. Этот белок поддерживает (регулирует) клеточный гомеостаз, участвует в фолдинге, сборке и транслокации белков через мембраны [5, С. 379].
Мы установили, что индуцибельный Бтш70 при его внеклеточном применении эффективно защищает ПМЯЛ от активирующего действия эндотоксинов [6, С. 97], [7, С. 163]. Однако механизмы защиты ПМЯЛ белком Бтш70 были недостаточно исследованы. Ранее было выявлено, что конститутивный Hsc70 может взаимодействовать с клатрином- основным компонентом оболочки окаймлённых пузырьков, образующихся при рецепторном эндоцитозе, однако в опухолевых клетках Бтш70 поддерживает клатрин-независимый эндоцитоз [8, С. 2747]. Мы установили, что Бтш70, взаимодействуя с TLR4, может поступать в клетки (рецепторзависимый эндоцитоз) [9, С. 524].
Целью исследования было выяснение роли рецепторзависимого и клатринзависимого эндоцитоза в механизме защиты ПМЯЛ белком Бтш70 от активации ЭТ.
Материалы и методы
ПМЯЛ получали согласно [6, С. 96]. Чистота выделенных ПМЯЛ составляла 98-99% (определяли окрашиванием по Романовскому-Гимзе). Жизнеспособность ПМЯЛ определяли с использованием propidium iodide (Sigma-Aldrich) [9, С. 524]. Погибших клеток было не более 2-4%.
После выделения и определения жизнеспособности ПМЯЛ рассевали в 24-луночные планшеты (Sarstedt) с повышенной адгезией по 2,0∙106 клеток на лунку в 1 мл раствора Хенкса (HBSS) и оставляли на 2 часа в стандартных условиях культивирования (при 37° C и 5% CO2), затем заменяли HBSS на культуральную среду RPMI 1640 (Sigma-Aldrich) (CM), с 10%-ной термоинактивированной эмбриональной сывороткой телят, сертифицированной на содержание эндотоксина (HyClone, Logan, UT, USA), 2 мМ L-глутамина, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина, вносили ингибиторы эндоцитоза и культивировали ПМЯЛ в течение 30 мин в стандартных условиях культивирования. После чего добавляли 1 мкг/мл Бтш70 (полученного согласно [6, С. 95]), инкубировали 10 мин и затем добавляли 100 нг/мл ЭТ (Sigma-Aldrich) и культивировали ПМЯЛ 12 ч в стандартных условиях культивирования.
Образование активных форм кислорода (ROS) в ПМЯЛ определяли с использованием нитросинего тетразолия (НСТ) [10, С. 119]. Специфичность генерации ROS подтверждали с помощью Diphenyleneiodonium chloride (DPI). По окончании культивирования к клеткам на 2 ч в стандартных условиях культивирования добавляли 0,1% НСТ. Далее образование ROS определяли согласно [10, С. 121]. Оптическую плотность контрольных ПМЯЛ принимали за 100%.
Для оценки специфичности ответа ПМЯЛ на ЭТ использовали специфический ингибитор TLR4-зависимого сигнального пути активации клеток - TAK-242 [11, С. 40]. В работе были использованы ингибиторы эндоцитоза: динасор (ингибитор клатринзависимого эндоцитоза) и метил-β-циклодекстрин (ингибитор образования липидных микродоменов) [12, С. 203].
Статистический анализ
Данные по анализу продукции ROS ПМЯЛ представлены как средние значения ± стандартное отклонение как минимум шести независимых экспериментов в четырех повторностях. Различия между группами анализировали с использованием однофакторного дисперсионного анализа One Way ANOVA (тест Tukey’s), *p < 0.05; **p < 0.01; ***p < 0.005.
Результаты
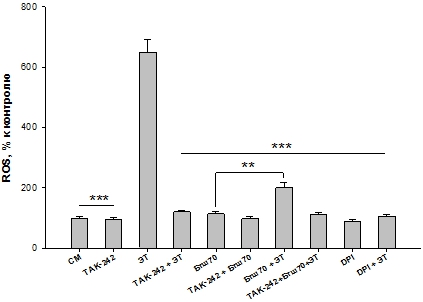
Ранее мы установили, что защита ПМЯЛ от ЭТ-индуцированной продукции ROS экзогенным белком Бтш70 реализуется в течение 5-10 мин [6, С. 97]. Поэтому в данной работе мы инкубировали клетки с Бтш70 до добавления ЭТ в течение 10 мин. Полученные результаты показали (Рис. 1), что ЭТ вызывал значительное увеличение продукции ROS ПМЯЛ (650%) по сравнению с контролем (СМ). Ингибиторы DPI и TAK-242 снижали ЭТ-индуцированную продукцию ROS клетками, что подтверждает специфичность увеличения ЭТ-активированной продукции ROS NOX2 ПМЯЛ. Внеклеточный Бтш70, добавляемый к клеткам, значительно снижал ЭТ-индуцированную продукцию ROS ПМЯЛ (Рис. 1, “Бтш70+ЭТ” по сравнению с “ЭТ”).
В отсутствии ЭТ Бтш70 несколько увеличивал продукцию ROS клетками, что характеризует некоторое провоспалительное действие этого белка [6, С. 95], что проявляется в неполной защите клеток белком от действия ЭТ. Т.к. соотношение ЭТ/контроль = 6,5, а ЭТ/(Бтш70+ЭТ) = 3,25
Ранее было показано, что в механизме взаимодействия ЭТ с клетками важная роль принадлежит клатринзависимому эндоцитозу. Конститутивный Бтш70 может поступать в клетки с помощью клатринзависимого эндоцитоза [13, С. 2763], [14, С. 42]. Поэтому мы предположили, что используемый нами индуцибельный Бтш70 также может поступать в клетки с помощью клатрина.
Рис. 1. – Влияние 1 мкг/мл Бтш70 на продукцию ROS ПМЯЛ, индуцированную 100 нг/мл ЭТ в присутствии и отсутствии 1 мкг/мл TAK-242, 10 мкМ DPI. СМ-контроль. Результаты представлены как M ± SD; n = 6 для каждой группы. Сравнивали ЭТ с каждой из остальных проб. ***p < 0,005; сравнивали пробы Бтш70 с Бтш70+ЭТ ** p <0,05
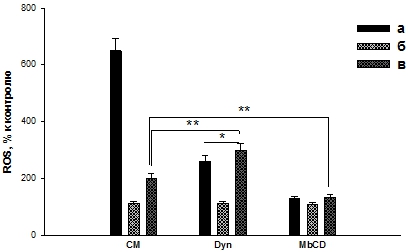
Наши результаты показали, что динасор снижал продукцию ROS клетками в присутствии ЭТ (рис. 2, Dyn, а), а в присутствии Бтш70 и ЭТ повышал продукцию ROS (сравнение рис. 2, Dyn, в с рис. 2, CM, в). Кроме того, соотношение ЭТ/(Бтш70+ЭТ) в присутствии динасора уменьшается до величины, равной ~ 0,87 (по сравнению с рис. 2, СМ, в). Это свидетельствует об участии клатринзависимого пути поступления Бтш70 в клетки, т.к. ингибирование этого пути приводит к снижению защитного действия Бтш70.
Исследование влияния метил-β-циклодекстрина показало, что данный ингибитор снижает продукцию ROS клетками в присутствии ЭТ (рис. 2, а) и практически не влияет на продукцию ROS в присутствии Бтш70 (рис. 2, б). Анализ результатов при предварительном добавлении к клеткам Бтш70, а затем ЭТ (рис. 2, в) показал, что в пробе с ингибитором клатринзависимого эндоцитоза (рис. 2, Dyn, в) продукция ROS увеличивается по сравнению с пробой (рис. 2, СМ, в), а в пробе с метил-β-циклодекстрином (ингибитор рецепторзависимого эндоцитоза) – уменьшается (рис. 2, MbCD, в).
Рис. 2 – Влияние ингибиторов эндоцитоза на продукцию ROS ПМЯЛ при действии ЭТ (100 нг/мл) и Бтш70 (1 мкг/мл). CM - культуральная среда; Dyn - 40 мкМ динасора; MbCD - 2,5 мМ метил-β-циклодекстрина. а – клетки + ЭТ, б - клетки + Бтш70, в – клетки + Бтш70 (10 мин) + ЭТ. Сравнивали все пробы с пробой ЭТ - ***p <0,005. Сравнивали пробы между собой - * p <0,05, ** p <0,01
Увеличение продукции ROS в пробе (рис. 2, Dyn, в) свидетельствует о том, что в присутствии ингибитора снижается защитное действие Бтш70. Кроме того, в пробе (рис. 2, Dyn, в) уменьшается соотношение величин ROS.
ОбсуждениеЗа последнее время было показано, что Бтш70 может выходить из клеток в кровь и специфически связываться Toll-подобными рецепторами TLR2 и TLR 4 на антигенпрезентативных клетках и оказывать иммуномодулирующее действие на другие клетки [1, С. 687], [15, С. 251]. Кроме TLR2 и TLR4, внеклеточный Бтш70 также может связываться с рецепторами TNFRSF5 суперсемейства TNFα-рецепторов [5, С. 379]. Ранее мы показали, что внеклеточный Бтш70 не оказывал существенного влияния на уровни мембранных TLR2 и TLR-4 клеток RAW264.7, а также уровни мРНК этих рецепторов [9, С. 524]. Как известно, TLR2, TLR4 и TNFRSF5 в клеточной мембране находятся в составе липидных микродоменов [13, С. 2763]. При разрушении липидных микродоменов функционирование таких рецепторов будет нарушено. Мы выявили, что метил-β-циклодекстрин значительно уменьшал образование ROS во всех трех пробах (рис. 2, а, б, в). При этом величина продукции ROS в пробах клеток с ЭТ (рис. 2, а) и Hsp+ЭТ (рис. 2, в) практически одинакова. Это может говорить о значительном ингибировании рецептор-зависимых сигнальных путей активации клеток под действием ЭТ и о снижении поступления Бтш70 в клетки. Кроме того, известно, что липидные микродомены нужны для сборки НАДФН-оксидазы [16, С. 1043] и действие метил-β-циклодекстрина значительно снижает работу этого фермента.
Заключение
Установлено, что индуцибельный рекомбинантный Бтш70 при внеклеточном применении уменьшает образование ROS полиморфноядерными лейкоцитами, вызываемыми эндотоксинами. В данном исследовании выявлено, что в механизме защиты ПМЯЛ Бтш70 от активации клеток ЭТ участвуют клатринзависимый и рецепторзависимым путям эндоцитоза Бтш70.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Munford S. Endotoxemia-menace, marker, or mistake? / R. S. Munford // J Leukoc Biol. – 2016. – Vol. 100. - № 4. – P. 687-698. doi: 10.1189/jlb.3RU0316-151R.
- Wang Y.W. Mild endoplasmic reticulum stress ameliorates lipopolysaccharide-induced neuroinflammation and cognitive impairment via regulation of microglial polarization. / Y. W. Wang, Q. Zhou, X. Zhang and others // Neuroinflammation. – 2017. – Vol. 14. - № 1. – P. 233-250. doi: 10.1186/s12974-017-1002-7.
- Kim S. J. Dynamic lipopolysaccharide transfer cascade to TLR4/MD2 complex via LBP and CD14. / S. J. Kim, H. M. Kim // BMB Rep. - 2017. – Vol. 50. - № 2. – P. 55-57. doi: 5483/BMBRep.2017.50.2.011
- Shim D. W. Anti-Inflammatory Action of an Antimicrobial Model Peptide That Suppresses the TRIF-DependentSignaling Pathway via Inhibition of Toll-Like Receptor 4 Endocytosis in Lipopolysaccharide-Stimulated Macrophages / D. W. Shim, K. H. Heo, Y. K. Kim and others // PLoS One. – 2015. - Vol. 10. - № 5. P. 1-13. doi: 1371/journal.pone.0126871.
- Radons J. The human БТШ70 family of chaperones: where do we stand? / J. Radons // Cell Stress – 2016. – Vol. 21. - № 3. P. 379–404. doi: 10.1007/s12192-016-0676-6.
- Rozhkova E. Exogenous mammalian extracellular БТШ70 reduces endotoxin manifestations at the cellular and organism levels / Rozhkova, M. Yurinskaya, O. Zatsepina and others // Ann N Y Acad Sci. – 2010. – Vol. 1197. – P. 94-107. doi: 10.1111/j.1749-6632.2009.05375.x.
- Yurinskaya M. M. Encapsulated Бтш70 decreases endotoxin-induced production of ROS and TNFα in humanphagocytes / M. Yurinskaya, O. Y. Kochetkova, L. I. Shabarchina and others // Cell Stress Chaperones. – 2017. – Vol. 22. - №1. – P.163-171. doi: 10.1007/s12192-016-0743-z. Epub 2016 Oct 26.
- Nimmervoll B. Cell surface localised Бтш70 is a cancer specific regulator of clathrin-independent endocytosis / Nimmervoll, L. A. Chtcheglova, K. Juhasz and others // FEBS Lett. – 2015. – Vol. 589. - № 19. – Pt. B. – P.2747-2753. doi: 10.1016/j.febslet.2015.07.037.
- Yurinskaya M. The Fate of Exogenous Human БТШ70 Introduced into Animal Cells by Different Means / M. Yurinskaya , O. G. Zatsepina, M. G. Vinokurov and others // Curr Drug Deliv. – 2015. – Vol. 12. - № 5. – P.524-32.
- Wang X. Gomisin A inhibits lipopolysaccharide-induced inflammatory responses in N9 microglia via blocking the NF-κB/MAPKs pathway / Wang, D. Hu, L. Zhang and others // Food Chem Toxicol. – 2014. – Vol. 63. –P.119–127. doi: 10.1016/j.fct.2013.10.048.
- Kawamoto T. TAK-242 selectively suppresses Toll-like receptor 4-signaling mediated by the intracellular domain / T. Kawamoto, M. Ii, T. Kitazaki and others // Eur J Pharmacol. – 2008. – Vol. 584. - № 1 – P.40-48. doi: 10.1016/j.ejphar.2008.01.026.
- Dutta D. Search for inhibitors of endocytosis: Intended specificity and unintended consequences / D. Dutta, J.G. Donaldson // Cell Logist. – 2012. – Vol. 2. - № 4. – P. 203-208. doi: 4161/cl.23967.
- Cho H. J. Probing the effect of an inhibitor of an ATPase domain of Hsc70 on clathrin-mediated endocytosis / J. Cho, G. H. Kim, S. H. Park and others // Mol Biosyst. – 2015. – Vol. 11. - № 10. – P 2763-2769. doi: 10.1039/c4mb00695j.
- Józefowski S. Lipid raft-dependent endocytosis negatively regulates responsiveness of J774 macrophage-like cells to ЭТ by down regulating the cell surface expression of ЭТ receptors / S. Józefowski, M. Śróttek // Cell Immunol. – 2017. – Vol. 312. – P. 42-50. doi: 1016/j.cellimm.2016.11.008.
- Multhoff G. Distinguishing integral and receptor-bound heat shock protein 70 (Бтш70) on the cell surface by Бтш70-specific antibodies / G. Multhoff, L. E. Hightower // Cell Stress Chaperones. – 2011. – Vol. 16 - № 3. P. 251-255. doi: 10.1007/s12192-010-0247-1.
- Jin S. Lipid raft redox signaling: molecular mechanisms in health and disease. / S. Jin, F. Zhou, F. Katirai, P. L. Li // Antioxid Redox Signal. – 2011. – Vol. 15. - № 4. – P. 1043-1083. doi: 10.1089/ars.2010.3619.