ЭФФЕКТИВНОСТЬ ЭНДОДОНТИЧЕСКОЙ НАНОИМПРЕГНАЦИИ И КУПРАЛ-КЮРЕТАЖА В КОМПЛЕКСНОМ ЛЕЧЕНИИ ЭНДОДОНТО-ПАРОДОНТАЛЬНОГО СИНДРОМА
Румянцев В.А.1, Федотова Т.А.2, Юсупова Ю.И.3, Рябиков М.Д.4, Задорожный Д.В.5
1ORCID: 0000-0001-6045-3333, Доктор медицинских наук, 2Кандидат медицинских наук,
3,4,5Аспирант, ГБОУ ВПО Тверской государственный медицинский университет МЗ РФ
ЭФФЕКТИВНОСТЬ ЭНДОДОНТИЧЕСКОЙ НАНОИМПРЕГНАЦИИ И КУПРАЛ-КЮРЕТАЖА В КОМПЛЕКСНОМ ЛЕЧЕНИИ ЭНДОДОНТО-ПАРОДОНТАЛЬНОГО СИНДРОМА
Аннотация
Проведено слепое контролируемое исследование с участием 36 добровольцев в возрасте от 35 до 44 лет – больных с эндодонто-пародонтальным синдромом. В основной группе (22 чел.) проводили комплексное лечение с применением гальванофоретической эндодонтической наноимпрегнации препаратом гидроксида меди-кальция и купрал-кюретажа. В группе сравнения (14 чел.) – традиционное эндодонтическое лечение и хирургическое лечение пародонтита. При оценке клинических, рентгенологических и биохимических показателей (неоптерин) на протяжении 4 лет наблюдения выявлено существенное превосходство по эффективности новой методики комплексного лечения с применением нанотехнологии и купрал-кюретажа.
Ключевые слова: эндодонтия, пародонтология, нанотехнологии, эффективность лечения.
Rumiantsev V.A.1, Fedotova T.A.2, Yusupova Yu.I.3, Riabikov M.D.4, Zadoroznyi D.V.5
1ORCID: 0000-0001-6045-3333, MD, 2MD, 3,4,5Postgraduate Student,
State Medical University of Tver State Medical University of the Ministry of Health of the Russian Federation
EFFICIENCY OF ENDODONTIC NANO-IMPREGNATION AND CURRETAGE WITH CUPRAL IN COMPLEX TREATMENT OF ENDODONTIC AND PERIODONTAL SYNDROME
Abstract
We conducted a non-perforating controlled study with the participation of 36 volunteers aged 35-44 years old – patients with endodontic and periodontal syndrome. We performed complex treatment in the main group (22 people) using galvanophoretic endodontic nano-impregnation with a copper-calcium hydroxide preparation and curettage with cupral. We carried out traditional endodontic treatment and surgical treatment of periodontitis in the comparison group (14 people). We revealed a significant superiority in the effectiveness of a new method of complex treatment with nanotechnology and curettage with cupral when evaluating clinical, radiologic and biochemical indices (neopterin) during 4 years of observation.
Keywords: endodontic treatment, periodontology, nanotechnology, treatment effectiveness.
Эндодонто-пародонтальный синдром (ЭПС) – сочетанное воспалительное поражение пульпы зуба и окружающих его тканей пародонта. Причиной заболевания является патогенная микрофлора, которая может первично проникать, как в полость зуба через кариозную полость, так и через пародонтальный карман в случае наличия краевого пародонтита, вызывая вторичное воспаление пульпы [1, С. 75-76]. И в том, и в другом случае воспаление в тканях поддерживается инфекцией, персистирующей в дополнительных каналах (ДК) корня и его дентинных трубочках (ДТ). В результате пульпа зуба погибает и развивается апикальный периодонтит, а воспаление в области краевого пародонта прогрессирует. Лечение ЭПС должно быть комплексным и направленным, с одной стороны, на ликвидацию инфекции в области корня и периапикальных тканей (эндодонтическое), а с другой стороны – на ликвидацию пародонтальных карманов (пародонтологическое). Традиционное эндодонтическое лечение предполагает санацию системы корневых каналов зуба и их обтурацию пломбировочным материалом [2, С. 5–8], а пародонтологическое – оперативное устранение пародонтальных карманов. Однако эффективность такого традиционного лечения не превышает 30–40% из-за того, что инфекция остается активной в ДК и ДТ корня, пронизывающих весь дентин корня и сообщающихся как с магистральными каналами, так и с внешней поверхностью корня. При традиционном эндодонтическом и пародонтологическом лечении не удается провести достаточную деконтаминацию пространств корня зуба, поскольку используемые противомикробные препараты не способны глубоко проникать в ДК и ДТ как при эндодонтической ирригации, так и при обработке пародонтальных карманов [2, С. 3]. Требуется активная доставка таких препаратов в глубину ДК и ДТ, имеющих чрезвычайно малый просвет (диаметр ДТ в среднем составляет 800 нм) [3, С. 9], а также одновременное воздействие на микрофлору пародонтального кармана [4, С. 79].
Мы предположили, что лечение ЭПС может стать более эффективным при использовании метода наноимпрегнации пространств корня зуба комплексным ионным препаратом – гидроксидом меди-кальция (ГМК). Этот метод, являющийся развитием методики «депофореза», используемой в эндодонтии [5, С. 70–71], разрабатывается нами на протяжении нескольких лет и показал свою высокую эффективность [6, С. 19]. Его суть заключается в постепенном заполнении ДК и ДТ ионами ГМК под влиянием гальванического тока (гальванофорез). Заряженные наночастицы ГМК, проникая на всю глубину ДК и ДТ, не только полностью стерилизуют их, очищают за счет протеолиза от остатков пульпы, но и обтурируют, предотвращая какое-либо развитие инфекции в будущем. Тот же препарат, введенный в пародонтальный карман, способствует инактивации поддесневой микрофлоры, лизису зубодесневого соединения и ликвидации воспаления без использования хирургических методов.
Целью исследования явилось сравнение эффективности комплексного лечения ЭПС методом эндодонтической наноимпрегнации и купрал-кюретажа с традиционным методом по клиническим, рентгенологическим и биохимическим показателям.
Материал и методы. Провели слепое контролируемое исследование с участием двух групп пациентов. Обследование и лечение больных проводили на базе кафедры пародонтологии Тверского ГМУ. Все обследованные являлись добровольцами в возрасте от 35 до 44 лет (средняя возрастная группа ВОЗ), не имевшими в период лечения иммунодефицитных состояний, острых вирусных и онкологических, а также сопутствующих общих соматических заболеваний. У всех 36 добровольцев (из числа 53 в начале исследования), которых мы смогли пронаблюдать в течение 4-летнего периода, было диагностировано клинически и подтверждено рентгенологически наличие эндодонто-пародонтального синдрома в области 1–4 зубов. То есть у них был диагностирован хронический апикальный периодонтит на фоне хронического генерализованного пародонтита легкой и средней степени тяжести. Первоначально добровольцы были произвольно разделены на 2 равных по численности группы: основную и группу сравнения. В компьютерной базе данных добровольцев каждый из них имел свой уникальный код, не позволявший исследователям до конца обработки результатов определять, к какой группе относится тот или иной участник исследования (слепой метод). В основной группе лечение проводили с помощью гальванофоретической наноимпрегнации ГМК, а в группе сравнения – с помощью традиционных методов. В основной группе осуществляли эндодонтический доступ к корневым каналам зубов, проводили их традиционную инструментальную и антисептическую обработку. После этого корневые каналы заполняли на 2/3 пастой ГМК («Cupral», Humanchemie GmbH, Германия) и вводили в них гальванические штифты [6, С. 15], состоящие из внутрикорневой (медь) и внекорневой (цинк) частей (рис. 1). Для создания электрической цепи под временную пломбу помещали хлопчатобумажную нить, кончик которой выводили в полость рта. Она же служила дренажем для осмотически выделяющейся из корневых каналов жидкости с протеолизатом белковых остатков.

Рис. 1 – Гальванический штифт для проведения эндодонтической наноимпрегнации зубов
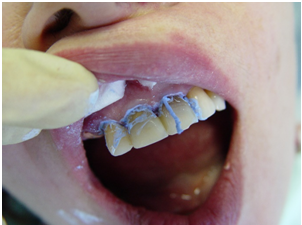
Рис. 2 – Процедура проведения купрал-кюретажа при лечении пародонтита
На границе двух разных металлов возникает потенциал около 0,2 – 0,4 в, за счет которого заряженные частицы ГМК постепенно перемещаются из просвета корневого канала зуба в ДК и ДТ. Величина гальванического тока составляет около 0,1 мА. ГМК представляет собой гетерогенную стабилизированную равновесную систему, состоящую из наночастиц гидроксида меди-II, анионов гидроксикупрата, сульфатгидрата кальция, высокодисперсного гидроксида кальция, метилцеллюлозы и дистиллированной воды, имеет рН=12. Основными активными субстанциями ГМК являются сильно заряженные отрицательные частицы гидроксида меди-II и анионы гидроксикупрата. Система стабилизирована специальным ингибитором самораспада. В глубине ДК или ДТ ионы ГМК, контактируя с дентинной или тканевой жидкостью образуют мельчайшие (около 30-100 нМ) частицы сульфида меди, обладающие выраженной бактерицидной активностью. Эти нанокластеры как «пробки» закупоривают ДТ и откладываются на стенках ДК. Гальванофорез ГМК мы проводили в течение 5–7 суток. Затем корневые каналы промывали и пломбировали традиционно с использованием силеров и гуттаперчевых штифтов. Всего таким методом было вылечено в основной группе 33 зуба.
Одновременно с эндодонтической наноимпрегнацией проводили купрал-кюретаж пародонтальных карманов. Для этого в них одномоментно с помощью специально разработанного нами укладчика вводили хлопчатобумажные нити толщиной 1–2 мм, пропитанные «Cupral». Концы нитей фиксировали в межзубных промежутках цианакрилатным клеем и оставляли на срок от 5 до 7 суток (рис. 2). С помощью купрал-кюретажа было обработано 29 секстантов челюстей. По окончании лечения нити удаляли. В дальнейшем больные обеих групп получали показанное в каждом случае традиционное консервативное пародонтологическое лечение, исключавшее инвазивные вмешательства. У больных группы сравнения по окончании традиционного эндодонтического лечения зубов проводили хирургические вмешательства с помощью традиционных методов (открытый кюретаж, лоскутные операции). Здесь были эндодонтически вылечены 21 зуб. В этой группе было обработано 19 секстантов челюстей. В конце исследования основная группа включала в себя 22, а группа сравнения – 14 человек.
Результаты комплексного лечения оценивали путем сравнения показателей до лечения, сразу после его окончания, а также спустя 1, 2 и 4 года. Оцениваемые показатели включали в себя клинические – с использованием компьютерной диагностической системы «Florida probe» (США), рентгенологические (конусно-лучевая компьютерная томография) и биохимические. Фиксировали появление случаев отрицательной динамики. Применительно к клиническим показателям это были: увеличение глубины пародонтальных карманов, обострение воспалительного процесса в тканях пародонта, появление или усиление подвижности зубов, появление положительной перкуссии. Из числа рентгенологических показателей: появление или увеличение очага деструкции костной ткани в апикальной области, расширение периодонтальной щели, появление или углубление костных пародонтальных карманов [7, С. 10–11]. Из числа биохимических показателей мы выбрали один из наиболее информативных, характеризующих выраженность воспалительной и аутоиммунной реакции в организме – показатель неоптерина в ротовой жидкости (РЖ) и плазме крови. Неоптерин является метаболитом нуклеиновых оснований, схожим по структуре с молекулой фолиевой кислоты. Он синтезируется преимущественно макрофагально-моноцитарными клетками под действием гамма-интерферона, поэтому отражает синтез этого важного цитокина иммунной системы [8, С. 938]. Высокие концентрации неоптерина отмечаются при цитотоксическом иммунном ответе, характерном для ряда аутоиммунных заболеваний, в том числе и для пародонтита [9, С. 355–360]. Вопрос о первичности этиологических факторов в прогрессировании воспалительных заболеваний пародонта при эндодонто-пародонтальном синдроме дискутируется [10, С. 499–500]. Поэтому нам показалось небезынтересным сравнить уровни неоптерина в РЖ и плазме крови больных ЭПС, что помогло бы дополнительно оценить эффективность лечения.
Определение уровня неоптерина в РЖ и сыворотке крови проводили методом твердофазного иммуноферментного анализа (ELISA) с набором реактивов «Neopterin ELISA» фирмы «IBL» (Германия) по методике, описанной в инструкции. Тест-набор предназначен для анализа методом конкурентного иммуноферментного анализа. Антиген, конъюгированный с пероксидазой, и неконъюгированный антиген конкурируют между собой за ограниченное число мест связывания при взаимодействии с антителами кролика к неоптерину человека. Комплекс «пероксидаза – конъюгированный антиген – антитело» связывается с поверхностью лунок на стрипе для микротитрования, покрытых антителами козы к антителам кролика. Несвязавшийся антиген удаляется из лунок на стадии промывания. После проведения ферментативной реакции со специфическим субстратом, в лунках измеряли поглощение при 450 нм. Количество комплексов, связавшихся с поверхностью микролунок, и оптическая плотность обратно пропорциональны концентрации неоптерина в исследуемом образце. Количественное определение проводили путем сравнения ферментативной активности в исследуемом образце с кривой, полученной при анализе стандартов с известными концентрациями.
Образцы РЖ забирали у обследуемых в утренние часы натощак. Одновременно забирали венозную кровь, которую незамедлительно центрифугировали со скоростью 3000 об./мин. Образцы плазмы крови и РЖ охлаждали в холодильнике при 2–8 С0 и в этот же день доставляли в лабораторию.
Для статистической обработки данных использовали программный пакет «Statistica 6.0». Для оценки вероятности различий между средними показателями в группах использовали критерии Стьюдента и Уилкоксона.
Результаты. Анализ динамики клинических показателей показал следующее (таблица 1). Если после оперативного пародонтологического лечения больные группы сравнения на протяжении более, чем 2 недель, ощущали дискомфорт в области вмешательства и ограничивали жевание на этих зубах, то в основной группе больные таких жалоб не предъявляли. Несколько больных из основной группы указывали лишь на небольшое ощущение жжения в области десны на протяжении 2–3 дней. Четверо пациентов из группы сравнения отметили выраженную рецессию десны с вестибулярной поверхности альвеолярных отростков в зонах оперативного вмешательства. Повторное обследование спустя год после лечения показало увеличение глубины пародонтальных карманов у 5 больных из группы сравнения, через 2 года таких оказалось 6 человек в группе сравнения и только один в основной группе. Через 4 года у двоих пациентов из группы сравнения зубы, которые подвергались традиционному эндодонтическому лечению, были удалены по поводу обострения хронического апикального периодонтита. Кроме того, у 7 пациентов выявлено увеличение глубины пародонтальных карманов в участках оперативного вмешательства. В основной группе спустя 4 года мы не наблюдали ни одного случая развития воспалительных явлений в периапикальной зоне вылеченных зубов. Тем не менее, у троих пациентов было отмечено увеличение глубины пародонтальных карманов.
Оценка рентгенологических показателей не выявила каких-либо существенных изменений в состоянии костной ткани челюстей у обследованных основной группы ранее, чем через 4 года. И только у одного больного спустя этот срок мы наблюдали увеличение резорбции костной ткани межальвеолярных перегородок в участках, где проводилось лечение. Отрицательная рентгенологическая динамика была отмечена в группе сравнения: у 3 больных спустя 1 год, у 7 больных через 2 года и у 9 человек через 4 года после лечения. Эти изменения носили характер деструкции костной ткани как в периапикальной области вылеченных зубов, так и в области костной ткани краевого пародонта.
Таким образом, нам удалось определить, что спустя 4 года после проведенного комплексного лечения ЭПС методика эндодонтической наноимпрегнации в сочетании с купрал-кюретажем в среднем в 2,3 раза превосходит традиционную методику по клиническим показателям и в 9 раз по рентгенологическим.
Таблица 1 – Число случаев отрицательной динамики по клиническим и рентгенологическим показателям у обследованных пациентов основной (О) и группы сравнения (С) (абс.)
| Показатели | Сроки обследования и группы больных | |||||||
| Сразу после лечения | Через 1 год | Через 2 года | Через 4 года | |||||
| О | С | О | С | О | С | О | С | |
| Клинические | 0 | 4 | 0 | 5 | 1 | 6 | 3 | 7 |
| Рентгенологические | 0 | 0 | 0 | 3 | 0 | 7 | 1 | 9 |
Приведенные в таблице 2 результаты определения уровня неоптерина в РЖ и плазме крови показали, что под влиянием комплексного лечения ЭПС концентрация неоптерина у больных обеих групп в среднем уменьшилась к первому году после проведенного лечения.
Таблица 2 – Уровень неоптерина в ротовой жидкости и плазме крови обследованных пациентов основной (О) и группы сравнения (С) (нмоль/л, М±m, p)
| Исследованная биологическая жидкость | Сроки обследования и группы больных | |||||||
| До лечения | Через 1 год | Через 2 года | Через 4 года | |||||
| О | С | О | С | О | С | О | С | |
| Ротовая жидкость | 10,3 ±1,29 | 11,7 ±1,42 | 7,3* ±0,88 | 11,2* ±1,39 | 6,7* ±0,72 | 10,8* ±1,43 | 6,8* ±0,93 | 11,3* ±1,45 |
| Плазма венозной крови | 15,5 ±1,03 | 17,1 ±1,77 | 9,2* ±0,91 | 15,4* ±1,55 | 7,9* ±0,84 | 12,8* ±1,67 | 8,2* ±0,87 | 13,4* ±1,76 |
Примечание: * – вероятность различий между группами р<0,05.
Однако в основной группе это уменьшение составило 29,1%, а в группе сравнения только 4,3% (р<0,05). Через 2 года в основной группе – 35,0%, а в группе сравнения – 7,7% (р<0,05). Спустя 4 года после лечения мы наблюдали небольшое увеличение показателей, которое связываем с медленным прогрессированием хронического пародонтита. Однако, различия по показателям содержания неоптерина в РЖ и плазме крови между основной группой и группой сравнения сохранялись на статистически достоверном уровне. Через 2 года уменьшение уровня неоптерина как в РЖ, так и в плазме крови оказалось статистически достоверным в сравнении с его уровнем до начала лечения в обеих группах (р<0,05).
Таким образом, установлено, что проведенное комплексное лечение ЭПС статистически достоверно снижает уровень неоптерина в РЖ и плазме крови у больных. Однако в основной группе такое изменение спустя 2 года наблюдения в среднем в 5 раз более выражено, чем в группе сравнения. Это опосредованно говорит о том, что биохимические и иммунологические изменения, сопровождающие воспалительный процесс в тканях пародонта при ЭПС, гораздо быстрее купируются при использовании для лечения метода эндодонтической наноимпрегнации ГМК и купрал-кюретажа, чем методы традиционного лечения.
Вывод. Предложенный новый метод комплексного лечения больных с использованием эндодонтической гальванофоретической наноимпрегнации гидроксидом меди-кальция с одновременным проведением купрал-кюретажа более эффективен, чем традиционные методы эндодонтического и оперативного пародонтологического лечения, поскольку в несколько раз превосходит их по динамике изученных клинических, рентгенологических и биохимических показателей. Этот метод основан на новой концепции, представляющей зуб, как единую систему с тканями пародонта и дентином корня, имеющем пористое строение за счет дополнительных каналов и трубочек, являющихся резервуаром патогенной микрофлоры.
Список литературы / References
- Силин А. В., Абрамова Н. Е., Леонова Е. В. и др. Диагностика и планирование лечения эндо-пародонтальных поражений / А. В. Силин, Н. Е. Абрамова, Е. В. Леонова и др. // Пародонтология.– 2015.– №3.– С. 74–76.
- Plotino G., Cortese T., Grande N. M. et al. New technologies to improve root canal disinfection / G. Plotino, T. Cortese, N. M. Grande // Braz.– Dent J.– 2016.– Vol. 27.– №1.– Р. 3–8.
- Румянцев В. А. Наностоматология // М.– МИА.– 2010.– 192 с.
- Jose K. A., Ambooken M., Mathew J. J., et al. Management of chronic periodontitis using chlorhexidine chip and diode laser - a clinical study / K. A. Jose, M. Ambooken, J. J. Mathew, A. V. Issac, A. P. Kunju, R. A. Paramesh-waran // J. Clin. Diagn. Res.– 2016.– Vol. 10.– № 4.–, Р. 76–80.
- Дерябина Л. В., Смирнова А. В., Дерябин П. М. и др. Особенности применения депофореза гидроокиси меди-кальция при различных формах хронического периодонтита / Л. В. Дерябина, А. В. Смирнова, П. М. Дерябин, Б. Т. Мороз // Эндодонтия today.– 2014.– № 3.– С. 68–71.
- Румянцев В. А., Бордина Г. Е., Ольховская А. В. и др. Клинико-лабораторная оценка и обоснование способа гальванофореза гидроксида меди-кальция при эндодонтическом лечении апикального периодонтита / В. А. Румянцев, Г. Е. Бордина, А. В. Ольховская, В. В. Опешко // Стоматология.– 2015.– Том 94.– №1.– С. 14–19.
- Макеева И. М., Бякова С. Ф., Аджиева Э. К. и др. Диагностика вертикальных трещин корней зубов с помощью конусно-лучевой компьютерной томографии / И. М. Макеева, С. Ф. Бякова, Э. К. Аджиева, Г. И. Голубева, В. И. Грачев, И. В. Касаткина // Стоматология.– 2016.– Том 95.– №6, С. 9–11.
- Дудина К. Р. и др. Неоптерин – потенциальный диагностический и прогностический маркер при инфекционных заболеваниях / К. Р. Дудина // Казан. мед. ж., 2014.– Том 95.– №6, С. 938–943.
- Свиридов Е. А., Телегина Т. А. Неоптерин и его восстановленные формы: биологическая роль и участие в клеточном иммунитете / Е. А. Свиридов, Т. А. Телегина // Успехи биологической химии.– 2005.– Том 45.– С. 355–390.
- Ушаков Р. В., Царев В. Н. Микрофлора и иммунные процессы при одонтогенной инфекции / Р. В. Ушаков, В. Н. Царев // Микробиология, вирусология и иммунология полости рта (под ред. проф. В.Н. Царева).– М.– ГЭОТАР-Медиа.– 2013. – С. 455–500.
Список литературы на английском языке / References in English
- Silin А. V., Abramova N. Е., Leonova Е. V. i dr. Diagnostika i planirovanie lechenia endo-parodontalnich porajeniy [Diagnosis and planning of treatment of endo-periodontal lesions] / А. V. Silin, N. Е. Abramova, Е. V. Leonova and others // Parodontologiya [Periodontology]. – 2015.– № 3.– Р. 74–76. [in Russian]
- Plotino G., Cortese T., Grande N. M. et al. New technologies to improve root canal disinfection / G. Plotino, T. Cortese, N. M. Grande et al. // Braz. Dent J.– 2016.– Vol. 27.– №1.– Р. 3–8.
- Rumyancev V. А. Nanostomatologia [Nanostomatology] / V. А. Rumyancev // М.:– МIА, 2010.– 192 р. [in Russian]
- Jose K. A., Ambooken M., Mathew J. J., et al. Management of chronic periodontitis using chlorhexidine chip and diode laser - a clinical study / K. A. Jose, M. Ambooken, J. J. Mathew, A. V. Issac, A. P. Kunju, R. A. Paramesh-waran // J. Clin. Diagn. Res.– 2016.– Vol. 10.– № 4.– Р. 76–80.
- Deriabina L. V., Smirnova А. V., Deriabin P. М. i dr. Osobennosty primeneniya depophoreza hydrookisy medy-kalcia pri razlichnich formach kchronicheskogo periodontita [Specific features of the use of copper-calcium hydroxide depophoresis for various forms of chronic periodontitis] / L. V. Deriabina, А. V. Smirnova, P. М. Deriabin, B. Т. Moroz // Endodontiya today [Endodontics today].– 2014.– № 3.– Р. 68–71. [in Russian]
- Rumyancev V. А., Bordina G. Е., Olchovskaya А. V. i dr. Kliniko-laboratornaya ozenka i obosnovanie sposoba galvanophoreza hydroxida medi-kalcia pri endodonticheskom lechenii apikalnogo periodontita [Clinical and laboratory evaluation and justification of the method of galvanophoresis of copper-calcium hydroxide in endodontic treatment of apical periodontitis] / V. А. Rumyancev, G. Е. Bordina, А. V. Olchovskaya, V. V. Opeshko// Stomatologia [Stomatology] (Moscow). – 2015.– Vol. 94.– №1.– P. 14–19. [in Russian]
- Makeeva I. М., Byakova S. Ph., Adjieva E. К. i dr. Diagnostika vertikalnich treshin korney zubov s pomoshiu konusno-luchevoy komputernoy tomographii [Diagnosis of vertical cracks in the roots of teeth using cone-beam computed tomography] / I. М. Makeeva, S. Ph. Byakova, E. К. Adjieva, G. I. Golubeva, V. I. Grachev, I. V. Kasatkina // Stomatologia [Stomatology] (Moscow).– 2016.– Vol. 95.– №6, P. 9–11. [in Russian]
- Dudina К. R. i dr. Neopterin – potenzialniy diagnosticheskiy i prognosticheskiy marker pri infekzchionnich zabolevaniyach [Neopterin is a potential diagnostic and prognostic marker for infectious diseases] / К. R. Dudina and others // Kazan. Med. J., 2014. – Vol. 95.– №6, P. 938–943. [in Russian]
- Sviridov Е. А., Telegina Т. А. Neopterin i ego vosstanovlennie phormy: biologicheskaya rol i uchastie v kletochnom immunitete [Neopterin and its reduced forms: a biological role and participation in cellular immunity] / Е. А. Sviridov, Т. А. Telegina // Uspechi biologicheskoy himii [Advances in Biochemistry].– 2005.– Vol. 45.– P. 355–390. [in Russian]
- Ushakov R. V., Tsarev V. N. Mikroflora i immunnie prozchessy pri odontogennoy infekzchii [Microflora and immune processes with odontogenic infection] / Ushakov R. V., Tsarev V. N. // Mikrobiologiya, virusologiya i immunologiya polosty rta (pod red. prof. V.N. Tsareva) [Microbiology, virology and immunology of the oral cavity (edited by Prof. VN Tsarev)].– M.:– GEOTAR-Мedia, 2013. – P. 455–500. [in Russian]
