СРАВНЕНИЕ ЭКСПРЕССИИ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ХИМОЗИНА И ПРОХИМОЗИНА ТЕЛЕНКА В E. COLI BL21 И ОЦЕНКА МОЛОКОСВЕРТЫВАЮЩЕЙ АКТИВНОСТИ ПОЛУЧЕННЫХ РЕКОМБИНАНТНЫХ БЕЛКОВ
Рудометов А.П.1, Беленькая С.В.1, Колосова Е.А.2, Ельчанинов В.В.1, Кригер А.В.3, Балабова Д.В.2, Щербаков Д.Н.1
1ФБУН Государственный научный центр вирусологии и биотехнологии «Вектор» (Кольцово, Россия); 2Алтайский государственный университет (Барнаул, Россия); 3Сибирский научно-исследовательский институт сыроделия (Барнаул, Россия)
Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований номер 16-34-00569 и гранта Фонда содействия инновациям по программе «УМНИК» номер 0019167
СРАВНЕНИЕ ЭКСПРЕССИИ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ХИМОЗИНА И ПРОХИМОЗИНА ТЕЛЕНКА В E. COLI BL21 И ОЦЕНКА МОЛОКОСВЕРТЫВАЮЩЕЙ АКТИВНОСТИ ПОЛУЧЕННЫХ РЕКОМБИНАНТНЫХ БЕЛКОВ
Аннотация
Рекомбинантные ферменты на сегодняшний день применяются практически во всех сферах деятельности человека. При этом постоянно ведутся работы по усовершенствованию (модификации) существующих ферментов и поиску новых. Рекомбинантный химозин активно используется в пищевой промышленности для производства сыров. В ходе данного исследования гены химозина и прохимозина В теленка, были клонированы в составе экспрессионного вектор pET21a. Было показано, что рекомбинантный химозин накапливается в бактериальной массе гораздо интенсивней, чем прохимозин. При этом препарат прохимозин обладает высокой ферментативной активностью, в то время как химозин не проявляет такой активности.
Ключевые слова: Рекомбинантные ферменты, рекомбинантный химозин, производство сыра, молокосвертывающая активность.
Rudometov A.P.1, Belenkaya S.V.1, Kolosova E.A2, Elchaninov V.V.1, Krieger A.V.3, Balabova D.V.2 Shcherbakov D.N.1
1State Research Center of Virology and Biotechnology «Vector» (Koltsovo, Russia); 2Altai State University (Barnaul, Russia); 3 Siberian Research Institute of Cheesemaking (Barnaul, Russia).
COMPARISON OF EXPRESSION AND SEQUENCE CHYMOSIN CALF PROCHYMOSIN E. COLI BL21 AND EVALUATION MILK-CLOTTING ACTIVITY OF THE RESULTING RECOMBINANT ENZYMES
Abstract
The recombinant enzymes are used today in almost all spheres of human activity. At the same time constantly works on improving the (modification) of existing and search for new enzymes. Recombinant chymosin widely used in the food industry for the production of cheese. In this study chymosin and prochymosin genes in bovine, have been cloned as part of an expression vector pET21a. It has been shown that recombinant chymosin accumulates in the bacterial mass is much more intense than the prochymosin. When prochymosin this drug has a high enzymatic activity, while chymosin shows no such activity.
Keywords: Recombinant enzymes, recombinant chymosin, cheese, milk-clotting activity.
Введение
Двадцать первый век ознаменовался бурным внедрением биотехнологических продуктов в повседневную жизнь общества. На сегодняшний день достижения в этой области науки применяются в таких отраслях как, медицина и фармацевтика, сельское хозяйство, экология, промышленность. Один из основных продуктов промышленной биотехнологии – это ферменты, произведенные с применением технологии рекомбинантной ДНК. Полученные таким образом ферменты, применяют в различных отраслях промышленности и сельского хозяйства. Основными этапами получения рекомбинантных ферментов являются: получение штамма продуцента, оптимизация схемы ферментации культуры продуцента, разработка алгоритма очистки целевого продукта. Однако, самым важным этапом, от которого порой зависят все характеристики продукта, для рекомбинантных белков, является этап проектирования генетической конструкции. Эта конструкция включает не только последовательность фермента, но дополнительные нуклеотидные последовательности обеспечивающий высокий уровень синтеза белка. В представленной статье важность первого этапа показана на примере разработки рекомбинантного химозина, фермента необходимого для получения сыров.
При изготовлении сыра ключевым этапом является образование молочного сгустка и его созревание. Именно на этом этапе производства сычужных сыров необходимы молокосвертывающие ферменты, в частности, химозин. Под действием химозина происходит первичная протеолитическая реакция, вызывающая коагуляцию казеина молока, заключительной стадией является превращение всех компонентов молочного сгустка во вкусовые и ароматические соединения [1]. При этом от качества препарата зависят главные характеристики сыров и выход продукта.
Химозин синтезируется в организме животных в форме препрохимозина. Препрохимозин – это белок, состоящий из 365 аминокислотных остатков, 16 из которых являются гидрофобной лидерной последовательностью, которая играет важную роль в секреции химозина через клеточную мембрану [2], для экспрессии в прокариотической системе она не требуется. Препрохимозин секретируется в пространство желудка в виде неактивного зимогена называемого прохимозин [3]. Прохимозин имеет молекулярную массу 41 кДа, в кислой среде он подвергается автокаталитической активации до химозина (молекулярный масса 35 кДа, 323 аминокислоты, каталитическая активность при рН около 5,0) или псевдохимозина (337 аминокислот, каталитическая активность при рН около 2 [4]. Существуют две альтернативные формы химозина – химозин А и В. Эти формы отличаются друг от друга одним аминокислотным остатком, аспартатом или глицином в положении 244 соответственно [5], при этом химозин В встречается чаще и имеет более стабильную структуру (Рис. 1).

Рис. 1 – Аминокислотная последовательность препрохимозина теленка B (Bos taurus).
В данном исследовании проведен дизайн гена химозина и прохимозина теленка для экспрессии в прокариотической системе. Показано, что химозин и прохимозин нарабатываются в E. coli штамм BL21. Так же проведено сравнение ферментативной активности полученных рекомбинантных белков.
Материалы и методы
Для синтеза искусственного гена была выбрана последовательность бычьего химозина B (Swiss-ProtID:P00794). Последовательность прохимозина получали при помощи ПЦР, прямой праймер содержал последовательность кодирующую пропептид. Искусственная последовательность химозина и праймеры были синтезированы на автоматическом синтезаторе ABI 3400 DNA/RNA Synthesizer («ДНК синтез», г. Москва).
В работе использовались E. coli штаммы TOP-10 и BL21. Плазмиды pGH и pET21a.
Ген бычьего химозина B амплифицировали с плазмиды pGH с использованием пары праймеров pET21a+CYM-(S) и pET21a+CYM-(B), содержащих сайты гидролиза рестриктаз FauNDI и Sfr274-I (таблица 1).
Для получения гена бычьего прохимозина проводили ПЦР с использованием пары праймеров pET21a+proCYM-(S) (содержит сайт рестрикции FauNDI) и pET21a+CYM(B) (содержит сайт рестрикции Sfr274-I) с помощью высокоточной ДНК-полимеразы AmpliTaq Gold фирмы Thermo Fisher Scientific (США).
Реакции проводили с использованием ПЦР-амплификатора «БИС» фирмы ООО БИС-Н (Россия), при следующих параметрах реакции: для химозина начальная денатурация 2 мин при 94°C, последующие 25 циклов 15 с – 94°C, 30 с – 55°C, 90 с – 68°C; для прохимозина 50 с – 960С, 30 с – 600С, 1 мин – 720С (всего 30 циклов). Затем ПЦР-продукты и плазмиду pET21a(+) обрабатывали эндонуклеазами рестрикции FauNDI и Sfr274I («CибЭнзим», г. Новосибирск). Реакцию гидролиза проводили в условиях рекомендованных производителем. С целью очистки рестрицированного вектора плазмидную ДНК наносили на 1%-й агарозный гель и выделяли из геля с использованием набора «Gel Extraction Kit» фирмы Qiagen (Германия). Реакцию лигирования проводили с использованием ДНК-лигазы бактериофага Т4 («СибЭнзим», г. Новосибирск). Реакция проводилась при +4°С в течение ночи. Полученной смесью трансформировали компетентные клетки E. coli штамм ТОР10.
Таблица 1 - Праймеры, использованные в работе
| Название | Последовательность |
| pET21a+CYM(s) | 5’-aaaaaacatatgggcgaagtggcaagcgtcccg -3’ |
| pET21a+CYM(b) | 5’-ttttttctcgagtcattactagtgatggtgatg -3’ |
| pET21a+proCYM(s) | 5’-aaaaaacatаtggcggaaattacccgcattccgctgtataaaggcaaa agcctgcgcaaagcgctgaaagaacatggcctgctggaagattttctgcaga aacagcagtatggcattagcagcaaatatagcggctttggcgaagtggcaag cgtcccgtta-3’ |
Для анализа наличия вставки в рекомбинантной плазмиде использовали ПЦР со специфичными праймерами (таблица 1, праймеры 1 и 2), подходящие как для химозина так и для прохимозина, оба гена содержат участки гибридизации этих праймеров. Разделение продуктов амплификации проводили в 1%-м агарозном геле с последующим окрашиванием бромистым этидием (0,5 мкг/мл). Положительные колонии, вносили в 5 мл среды LB с ампициллином (50 мкг/мл) и растили в течение ночи при 37°С при 170 об/мин. Затем плазмидную ДНК выделяли из бактериальных клеток с помощью коммерческих наборов DNI mini kit фирмы «Qiagen» согласно рекомендациям производителя. Полученную плазмидную ДНК секвенировали. Секвенирование проводили по методу Сэнгера в ЦКП "Геномика" СО РАН (г. Новосибирск).
Плазмидами pET21a(+) cо встроенными генами химозина и прохимозина трансформировали компетентные клетки E .coli BL21. Полученные клоны после трансформации наращивали в 5 мл среды LB в течение ночи. Полученную ночную культуру добавляли по 1,5 мл в колбы со средой YT×2 и растили до плотности ОД=0,8, после этого добавляли индуктор – 1М ИПТГ в соотношении 1:1000 и растили 5 часов при 37°С 170 об/мин. Биомассу бактериальных клеток осаждали центрифугированием (7000 об/мин), затем суспендировали в лизирующем буфере с использованием ультразвукового гомогенизатора Soniprep 150 Plus. Дебрис отделяли центрифугированием при 16000 rpm в течение 15 мин, 4 °С.
После разрушения биомассы клеток E. сoli, растворимую фракцию и дебрис анализировали на наличие рекомбинантного белка с помощью электрофореза в 12% ПААГ по стандартной методике, описанной Лэммли [6].
Было установлено, что оба белка находятся в нерастворимой фракции, поэтому их выделяли и очищали из дебриса. Тельца включения клеток E. сoli, содержащие белки, предварительно растворяли в буфере с 8 М мочевиной.
В нуклеотидную последовательность рекомбинантных белков на С-конце был заложен фрагмент 6×His, очистку рекомбинантного белка проводили с помощью металл-хелатной хроматографии на Ni-NTA агарозе.
Предварительно, колонку, содержащую Ni-NTA агарозу, уравновешивали базовым буфером с 8М мочевиной. Дебрис после дезинтеграции растворяли в базовом буфере с 8 М мочевиной. Наслаивали на колонку. Промывали колонку 10 объемами промывочного буфера с 8 М мочевиной. Добавляли по очереди буферы элюции с 8 М мочевиной в порядке возрастания концентрации имидазола.
Диализ фракций элюата, содержащего рекомбинантный белок, проводили однократно против раствора, содержащего 50 мМ Трис, 300 мМ NaCl, рН+10.25. Затем четырехкратно против раствора, содержащего 50 мм Трис, рН=7,5. Чистоту белка контролировали с помощью электрофореза в 12%-м полиакриламидном геле.
Молокосвертывающую активность определяли по ГОСТ ISO 11815—2015.
Результаты и обсуждение
В качестве продуцента для разработанной генетической конструкции была выбрана бактерия E. coli штамма BL21 и вектор экспрессии pET21(+). Данный выбор объясняется такими преимуществами системы как: 1) высокая скорость роста культуры; 2) большая плотность жизнеспособных бактерий в культуре; 3) хорошо охарактеризованная система 4) легкость проведения трансформации экзогенной ДНК.
Нуклеотидные последовательности, кодирующие химозин, получены при помощи ПЦР с плазмиды pGH, используя пару праймеров рET21a+CYM(s), рET21a+CYM(b), а прохимозин пару праймеров pET21a+proCYM(s) и рET21a+CYM(b).
Отбор положительных клонов, проведенный при помощи ПЦР, показал наличие клонов, содержащих последовательность химозина и прохимозина (рис. 2).
Секвенирование плазмидной ДНК из положительных клонов в районе встройки гена химозина и прохимозина показало отсутствие дефектов встраиваемых генов (вставки, делеции, замены). Полученными плазмидами были трансформированы компетентные клетки E. coli штамма BL21 для наработки белка.
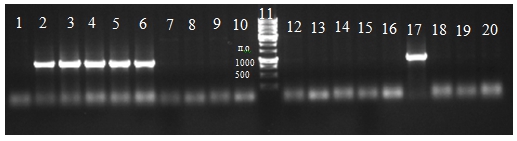
Рис. 2 – Результат разделения продуктов ПЦР полученных с отдельных колоний; 1-10 дорожки - клоны после трансформации плазмидами содержащими ген химозина, 11 – маркер молекулярной массы, 12-20 - клоны после трансформации плазмидами содержащими ген прохимозина.
Экспрессию генов химозина и прохимозина в векторе pET21a, оценивали с помощью электрофоретического разделения лизата клеток E.coli BL21 в 12% ПААГ. Анализ электрофореграммы показал наличие интенсивной полосы, по подвижности соответствующей теоретически рассчитанной молекулярной массе белков химоизина и прохимозина. Для анализа биологической активности рекомбинантные белки необходимо было очистить от бактериальных белков.
Очистку рекомбинантных белков проводили с помощью металл-хелатной хроматографии (рис. 3). Было установлено, что рекомбинантный химозин элюируется при концентрации имидазола 250 мМ, а рекомбинантный прохимозин при 200 мМ. Количественный анализ показал, что на 1 литр культуральной среды нарабатывается 1,3 мг химозина и 150 мкг прохимозина, т.е. выход белка химозина в данной системе на порядок выше, чем прохимозина. Перед определением молокосвертывающей активности был проведен рефолдинг белка.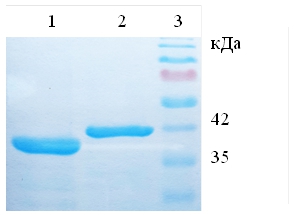
Рис. 3 – Результат разделения очищенных рекомбинантных образцов химозина (дорожка 1) и прохимозина (дорожка 2), 3 маркер молекулярной массы
Сравнительная ферментативная активность показала, что рекомбинатный химозин после рефолдинга не обладает ферментативной активностью. В то время прохимозин проявлял высокую молокосвертывающую активность (83 IMCU/мл, с концентрацией препарата 0,08 мг/мл).
Таким образом, в ходе работы было показано, что рекомбинантный химозин в системе E.coli BL21, накапливается в гораздо большем количестве, чем прохимозин. Однако препарат рекомбинантного химозина не обладает специфической молоксвертывающей активность, в то время как препарат рекомбинантного прохимозина имеет высокую специфическую активность. Возможную разницу в накоплении рекомбинатных химозина и прохимозина можно объяснить разницей в их протеолитической активности. Отсутствие пропептида не обеспечивает корректный фолдинг активного фермента в случае химозина. В случае прохимоизна этот процесс может спонтанно протекать в бактериальных клетках, с образованием фермента, оказывающего негативное влияние на рост культуры и накопление белка.
Список литературы / References
- Fox P.F. Rennets and their action in cheese manufacture and ripening // Biotechnology and Applied Biochemistry.1998. 10. P. 522–535.
- Rao S. Extraction and purification of chymosin from buffalo calves. PhD thesis, Natl. Dairy Res. Inst., Karnal, India, 1984.
- Foltman B. A review on prorennin and rennin // Compt Rend Trav Lab Carlsberg. 1966. 35. P. 143–231.
- Pedersen V.B., Christensen K.A., Foltman B. Investigations on the activation of bovine prochymosin // Eur JBiochem. 1979. 94. P. 573–80.
- Pitts J.E., Dhanraj V., Dealwis C.G., Mountafounis D., Nugent P., Orphrayoon P. Multidisciplinary cycles for protein engineering: Site directed mutagenesis and X-ray structural studies of aspartic proteinases // Scand JClin Lab Invest. 1992. 52(suppl. 210). P. 39–50.
- Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 // 1970. 15. 227(5259). P. 680-5.
