ВЛИЯНИЕ TH1/TH2-БАЛАНСА НА РАЗВИТИЕ ОСТРОЙ РЕАКЦИИ «ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА»
Колесникова О.П.1, Перминова О.М.2, Гаврилова Е.Д.3, Гойман Е.В.4, Ляшенко А.М.5, Вольский Н.Н.6, Козлов В.А.7
1Доктор медицинских наук, 2,4,6кандидат медицинских наук, 3кандидат биологических наук, 5студент, 7доктор медицинских наук, профессор, академик РАМН, 1,2,3,4,6,7ФГБУ «НИИ Клинической иммунологии» СО РАМН, Новосибирск, Россия; 5Новосибирский государственный медицинский университет, Россия
ВЛИЯНИЕ TH1/TH2-БАЛАНСА НА РАЗВИТИЕ ОСТРОЙ РЕАКЦИИ «ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА»
Аннотация
Изучено влияние фармакологических агентов, способных изменять Th1/Th2-соотношение, на тяжесть развития оРТПХ. В качестве лабораторной модели острой РТПХ использовалась полуаллогенная система C57Bl/6 ®(C57Bl/6 x DBA/2)F1. В экспериментальных группах мышам вводили полоксамер 407 или 5-азацитидин – препараты с оппозитным эффектом на Th1/Th2-баланс. Показано, что полоксамер 407 (сдвигающий Th1/Th2-соотношение в сторону Th1) увеличивал смертность животных и интенсивность развития острой РТПХ. Наблюдаемые эффекты 5-азацитидина на динамику острой РТПХ, по-видимому, не связаны с его влиянием на Th1/Th2-соотношение. Таким образом, проведенные эксперименты свидетельствуют в пользу важной роли Th1/Th2-баланса в развитии оРТПХ.
Ключевые слова: Th1/Th2-баланс, острая РТПХ, полоксамер 407, 5-азацитидин.
Kolesnikova O.P.1, Perminova O.M.2, Gavrilova E.D.3, Goiman E.V.4, Liashenko A.M.5, Volsky N.N.6, Kozlov V.A.7
1Doctor of medical sciences, 2,4,6PhD in medical sciences, 3PhD in biology, 5Medical student, 7Full Member of the Russian Academy of Medical Sciences, doctor of medical sciences, professor; 1,2,3,4,6,7Scientific Research Institute of Clinical Immunology SB RAMS, Novosibirsk, Russia; 5Novosibirsk State Medical University, Russia
THE INFLUENCE OF TH1/TH2-BALANCE ON THE DEVELOPMENT OF ACUTE GRAFT-VERSUS-HOST DISEASE
Abstract
The influence of drugs affecting Th1/Th2-balance on the severity of acute graft-versus-host disease (GvHD) has been evaluated. As laboratory model of acute GvHD the semiallogeneic system C57Bl/6 ®(C57Bl/6 x DBA/2)F1 it was used. In experimental groups mice were injected with poloxamer 407 or 5-azacytidine – drugs with opposite effects on the Th1/Th2-balance. It was established that poloxamer 407 (shifting Th1/Th2-ratio toward Th1) increases mortality of animals and intensity of acute GvHD. Observed effects 5-azacytidine on acute GvHD are not connected probably with its influence on Th1/Th2-balance. Thus, the performed experiments confirm an important role of Th1/Th2-balance in development of acute GvHD.
Keywords: Th1/Th2-balance, acute GvHD, poloxamer 407, 5-azacytidine.
Введение
Проблеме патогенеза и особенностей течения острой реакции «транстплантат против хозяина» (оРТПХ) посвящено большое количество экспериментальных и клинических исследований, и их число не уменьшается со временем. Интерес к этой проблеме обусловлен не только ее значением для теоретической иммунологии, но и тем, что оРТПХ является одним из грозных и достаточно частых осложнений при пересадке костного мозга. Поэтому любые факты, проливающие свет на механизмы развития оРТПХ, могут иметь и важное практическое значение.
На сегодняшний день установлено, что одним из ведущих факторов, обусловливающих развитие оРТПХ, как у пациентов с аллогенной трансплантацией костного мозга, так и в различных лабораторных моделях, является активность Т-хелперов первого типа [2, 8]. Показано, что различные экспериментальные воздействия, нарушающие размножение, дифференцировку и функционирование Th1-клеток донора, подавляют возникновение оРТПХ и уменьшают интенсивность ее проявлений [10]. Однако, в целом, вопрос о роли Th1/Th2-баланса в патогенезе оРТПХ выяснен еще недостаточно и требует дальнейшего изучения.
Исходя из выше изложенного, целью настоящей работы было изучение динамики оРТПХ при воздействии на нее двух фармакологических агентов с разнонаправленными эффектами на Th1/Th2-баланс. В качестве первого из таких веществ был выбран полоксамер 407 (Р407), сдвигающий, по нашим данным [1, 4], Th1/Th2-соотношение в сторону Th1. Другим использованным в работе препаратом был 5-азацитидин (5-AZA) – ингибитор метилирования ДНК, способный, как это следует из литературных данных [6], сдвигать указанное соотношение в сторону преобладания Th2.
Материалы и методы
Эксперименты выполнены на 280 мышах-самках линии C57BL/6 и гибридах F1(DBA x C57BL/6). Животных получали из вивария СО РАМН в возрасте 2,5 – 3 месяца и в период проведения экспериментов содержали на стандартной диете и в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных (Страссбург, 1986).
Полоксамер 407 (Pluronic F-127; Sigma) вводили внутрибрюшинно в дозе 7,5 мг/мышь в 0,5 мл среды RPMI-1640 через сутки в течение двух недель, как это было описано ранее [1]. Контрольным животным в те же сроки вводили 0,5 мл растворителя. Острую РТПХ индуцировали внутривенным введением мышам-гибридам BDF спленоцитов, полученных от родительской линии C57BL, в дозе 100 х 106 клеток/мышь, однократно, на следующий день после последнего введения Р407. Другая схема была использована в экспериментах с 5-азацитидином. Препарат (5-azacytidine, Sigma) вводили подкожно в дозе 50 мкг/мышь ежедневно в течение 7 дней, начиная со следующего дня после индукции оРТПХ. Контрольным животным в этих опытах вводили 0,2 мл физиологического раствора. Активность трансаминаз в сыворотке крови мышей определяли с помощью наборов «Трансаминаза-АЛТ-Ново» и «Трансаминаза-АСТ-Ново» («Вектор-Бест», Россия).
Полученные данные приводятся в виде средних величин параметров, измеренных в нескольких независимых экспериментах. Статистическую значимость различий между исследуемыми показателями оценивали с помощью непараметрического критерия Вилкоксона-Манна-Уитни.
Результаты и обсуждение
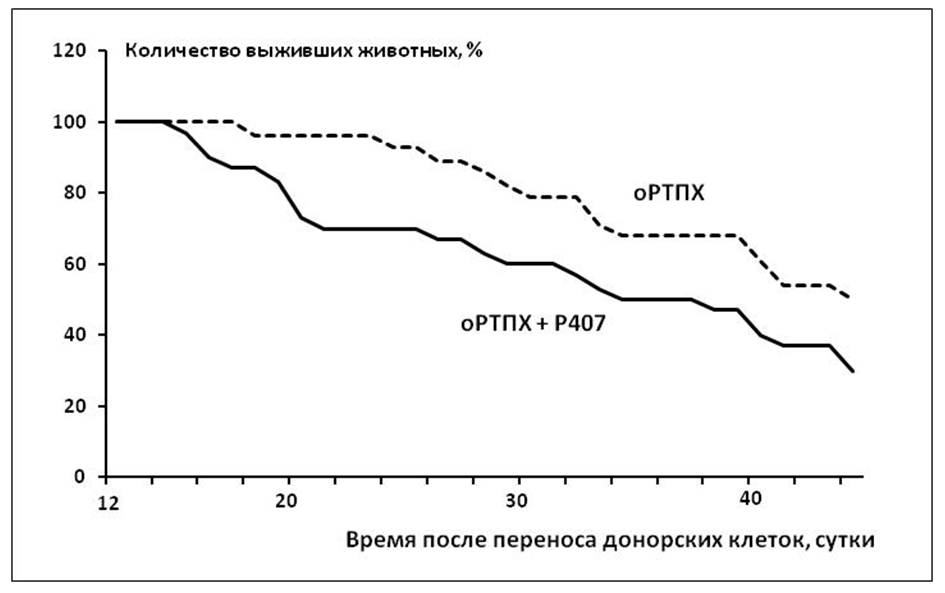
Результаты проведенных экспериментов, в целом, подтверждают наше исходное предположение о важности Th1/Th2-соотношения в патогенезе оРТПХ. Так, из данных, представленных на Рис. 1, видно, что сдвиг баланса хелперов в сторону Th1 заметно интенсифицирует течение оРТПХ: падеж животных в группе с предварительным воздействием Р407 начинается раньше и происходит более интенсивно, чем в контрольной группе мышей с оРТПХ. Этот вывод подтверждается и стимулирующим действием Р407 на степень деструкции тимуса при оРТПХ.
Рис. 1 - Влияние полоксамера 407 на динамику смертности животных при острой РТПХ
Из данных Таблицы видно, что во все исследованные сроки после индукции оРТПХ вес тимуса и содержание в нем клеток у мышей, подвергшихся воздействию Р407, оказываются существенно ниже, чем соответствующие показатели в контрольной группе. Этот параметр является характерным свидетельством активности донорских киллерных клеток при оРТПХ [3], и его статистически достоверные изменения на фоне сдвига Th1/Th2-баланса могут служить надежной оценкой для интенсивности развития оРТПХ.
Представленные в Таблице данные говорят также о наличии спленомегалии у мышей с оРТПХ (контрольная группа) в ранние сроки ее развития. Этот признак также характерен для оРТПХ [7] и отражает В-клеточную пролиферацию, происходящую на ранней стадии развития оРТПХ и находящуюся под контролем Th2-клеток. На поздних стадиях заболевания спленомегалия исчезает за счет общей деструкции лимфоидной ткани под воздействием цитотоксических клеток донора. Видно, что у мышей с предварительным введением Р407 спленомегалия менее выражена, чем в контроле, и она быстрее сменяется деструктивными изменениями в ткани селезенки. Этот обнаруженный нами факт хорошо согласуется с предполагаемым сдвигом Th1/Th2-баланса в сторону Th1 под воздействием Р407.
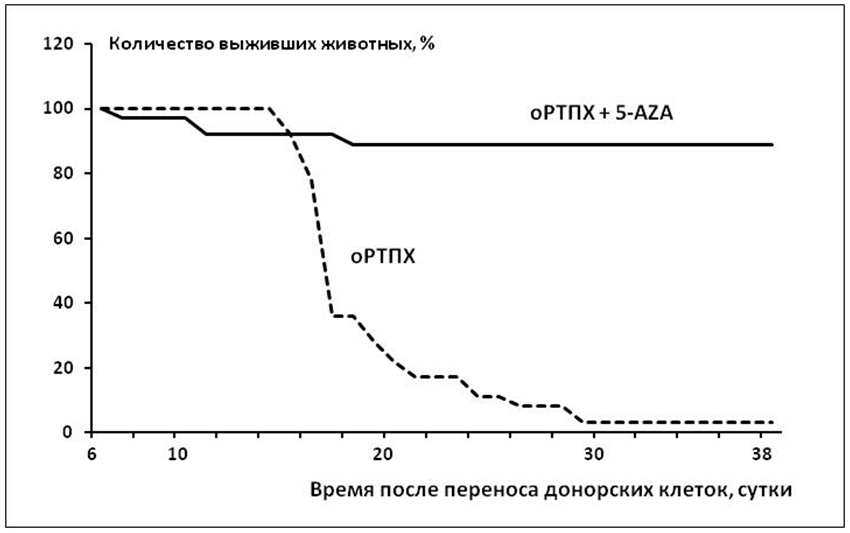
Данные, представленные на Рис. 2, свидетельствуют, что введение мышам 5-AZA на ранней стадии развития оРТПХ почти полностью блокирует гибель животных в результате этого патологического процесса (ранняя гибель нескольких мышей в этой группе вряд ли может быть приписана непосредственному эффекту оРТПХ и, вероятно, обусловлена токсическим действием самого препарата). Такой эффект 5-AZA можно было бы объяснить его стимулирующим воздействием на развитие Th2-лимфоцитов, и вытекающим из этого снижением степени тяжести оРТПХ. Помимо влияния 5-AZA на выживание мышей с оРТПХ в пользу подавления интенсивности патологического процесса под воздействием этого препарата говорят также полученные нами данные о его ингибирующем влиянии на развитие гепатомегалии. Печень является одним из органов-мишеней при деструкции тканей реципиента цитотоксическими клетками донора и, согласно полученным нами результатам, достоверно увеличивается в размерах, по сравнению с интактными животными, за счет воспалительных изменений в этом органе.
Таблица 1 - Изменения содержания лейкоцитов в крови и состояния лимфоидных органов в динамике острой РТПХ на фоне воздействия препаратов, сдвигающих Th1/Th2-баланс
| Исследуемые параметры | Интактные мыши | Срок после индукции оРТПХ | ||
| 5 суток | 12 суток | 20 суток | ||
|
Вес тимуса, мг оРТПХ (контроль) оРТПХ + Р407 оРТПХ + 5-AZA Количество клеток в тимусе, 106 клеток оРТПХ (контроль) оРТПХ + Р407 оРТПХ + 5-AZA Вес селезенки, мг оРТПХ (контроль) оРТПХ + Р407 оРТПХ + 5-AZA Количество клеток в селезенке, 106 клеток оРТПХ (контроль) оРТПХ + Р407 оРТПХ + 5-AZA Количество лейкоцитов в крови, 109 /литр оРТПХ (контроль) оРТПХ + Р407 оРТПХ + 5-AZA |
41,4 ± 2,2
104,4 ± 14,6
97,6 ± 5,1
148,1 ± 9,1
12,9 ± 2,2 |
45,5 ± 2,8 36,6 ± 3,3 13,9 ± 1,1#*
100,8 ± 11,1 94,5 ± 8,5 8,4 ± 0,7#*
174,9 ± 11,9# 172,6 ± 18,2# 85,6 ± 6,7
189,5 ± 10,5# 108,8 ± 16,0 108,9 ± 9,2
12,9 ± 1,5 13,5 ± 2,4 3,7 ± 0,3#* |
25,6 ± 1,6# 15,5 ± 2,3* 11,9 ± 0,8#*
35,8 ± 3,5# 14,2 ± 5,8 4,2 ± 0,7#*
202,2 ± 10,5# 157,3 ± 6,9# 142,4 ± 11,3
82,2 ± 8,5 43.5 ± 4,7 71,4 ± 9,9
8,8 ± 2,1 10,4 ± 1,8 9,9 ± 3,0 |
12,9 ± 1,5# 5,0 ± 1,0* 31,2 ± 3,5*
6,9 ± 1,2# 1,2 ± 0,6* 38,7 ± 10,0#*
153,1 ± 22,2# 85,0 ± 17,9 115,1 ± 9,6
109,5 ± 27,3 30,3 ± 11,8#* 128,2 ± 14,0
4,6 ± 0,7# 8,8 ± 1,3 13,1 ± 0,7* |
* достоверное отличие от соответствующего контроля (р < 0,05) # достоверное отличие от соответствующего параметра у интактных мышей (р < 0,05)
Было установлено, что введение 5-AZA существенно тормозит данный процесс (вес печени у интактных мышей - 841 ± 33 мг, у контрольных животных на 12-й день развития оРТПХ – 1318 ± 54 мг, а на тот же срок в группе мышей с введением 5-AZA - 1105 ± 36 мг; р < 0,05). Также было обнаружено аналогичное (тормозящее) влияние 5-AZA на увеличение активности трансаминаз (АЛТ и АСТ) в крови, зарегистрированное у мышей с оРТПХ.
Однако другие данные, представленные в Таблице, не позволяют сделать вывод о том, что механизмом, определяющим репрессивный эффект 5-AZA на развитие оРТПХ, является сдвиг баланса Т-хелперов.
Рис. 2 - Влияние 5-азацитидина на динамику смертности животных при острой РТПХ
Из Таблицы видно, что воздействие этого препарата на лимфоидную систему значительно отклоняется от обнаруживаемой в контрольной группе мышей динамики развития оРТПХ. На ранних этапах развития о РТПХ 5-AZA не только не сглаживает изменения веса и клеточности тимуса, вызванные иммунологическим конфликтом в организме реципиента, но и самостоятельно резко уменьшает эти показатели в те сроки, когда деструкция тимуса, обусловленная оРТПХ, еще не успевает себя проявить. В то же время, введение 5-AZA отменяет развитие спленомегалии, наблюдаемой в ранние сроки заболевания, и это нельзя объяснить его стимулирующим влиянием на Th2-лимфоциты. По-видимому, в исследованном нами случае на первый план выходит цитотоксическое действие 5-AZA по отношению к лимфоидным клеткам, которое было давно описано [5, 9] и которое приводит в использованной нами модели к подавлению как Th1-зависимых, так и Th2-зависимых иммунных реакций.
Таким образом, результаты проведенных экспериментов свидельствуют в пользу важной роли Th1/Th2-баланса в развитии оРТПХ и в регуляции степени ее интенсивности, но выяснение возможности регуляции этих процессов с помощью воздействий, сдвигающих соотношение хелперов в сторону Th2 (в том числе и ингибиторов метилирования ДНК, таких как 5-AZA), требует дальнейших исследований.
Список литературы
Перминова О.М., Вольский Н.Н., Кудаева О.Т и др. Дислипидемия и Th1/Th2-соотношение на разных этапах развития хронической реакции «трансплантат против хозяина» // Иммунология. – 2009. - № 6. – С. 341-345.
Allen R.D., Staley T.A., Sidman C.L. Differential cytokine expression in acute and chronic murine graft-versus-host-disease // Eur. J. Immunol. – 1993. Vol. 23, N 2. – P. 333-337.
Krenger W., Rossi S., Hollander G.A. Apoptosis of thymocytes during acute graft-versus-host disease is independent of glucocorticoids // Transplantation. – 2000. Vol. 69, N 10. – P. 2190-2193.
Kudaeva O.T., Kolesnikova O.P., Goiman E.V. et al. The experimental model of the autoimmune glomerulonephritis induced by the chronic graft versus host reaction // An update on glomerulopathies - Etiology and pathogenesis. Ed. by S.S.Prabhakar. Rijeka: In Tech, 2011. - P. 49-86.
Presant C.A., Vietti T., Valeriote F. Kinetics of both leukemic and normal cell population reduction following 5-azacytidine // Cancer Res. – 1975. Vol. 35, N 8. – P. 1926-1930.
Quddus J., Johnson K.J., Gavalchin J. et al. Treating activated CD4+ T cells with either of two distinct DNA methyltransferase inhibitors, 5-azacytidine or procainamide, is sufficient to cause a lupus-like disease in syngeneic mice // J. Clin. Invest. – 1993. Vol. 92, N 1. – P. 38-53.
Rus V., Svetic A., Nguyen P. et al. Kinetics of Thl and Th2 cytokine production during the early course of acute and chronic murine GvHD // J. Immunol. – 1995. Vol. 155, N 5. – P. 2396-2406.
Schroeder M.A., DiPersio J.F. Mouse models of graft-versus-host disease: advances and limitations // Dis. Model. Mech. – 2011. Vol. 4, N 3. – P. 318-333.
Vadlamudi S., Choudry J.N., Warawdekar V.S. et al. Effect of combination treatment with 5-azacytidine and cytidine on the life-span and spleen and bone marrow cells of leukemic (L1210) and nonleukemic mice // Cancer Res. – 1970. Vol. 30, N 2. – P. 362-369.
Williamson E., Garside P., Bradley J.A. et al. Neutralizing IL-12 during induction of murine acute graft-versus-host disease polarizes the cytokine profile toward a Th2-type alloimmune response and confers long term protection from disease // J. Immunol. – 1997. Vol. 159, N 3. P. 1208-1215.