REACTION OF 4-OXO-2-THIOXO-MERCAPTO-∆ 2 -1,3-THIAZOLIDINE WITH GASEOUS DIAZOMETHANE
Рутто М.В. 1, Буровик2 Д.А., Гинак3 А.И.
1Кандидат химических наук, доцент кафедры молекулярной биотехнологии, Санкт-Петербургский государственный технологический институт (технический университет);2 кандидат химических наук, соискатель кафедры молекулярной биотехнологии; 3 доктор химических наук, заведующий кафедрой молекулярной биотехнологии, Санкт-Петербургский государственный технологический институт (технический университет)
РЕАКЦИЯ 4-ОКСО-2-ТИОКСО-2-МЕРКАПТО -Δ2-1,3-ТИАЗОЛИНА С ГАЗООБРАЗНЫМ ДИАЗОМЕТАНОМ
Аннотация
В статье рассмотрено – влияние водородных связей на реакционную способность органических кристаллов амбидентных соединений, что позволяет найти им применение для производства различных биологически активных веществ, фармацевтических препаратов и в нанотехнологии.
Ключевые слова: 4-Оксо-2-тиоксо-1,3-тиазолидин, десмотропная формы, реакции органических кристаллов, амбидентные соединения, диазометан.
Rutto M.V., Burovik D.A., Ginak A.I.
1Candidate of science (chemistry), assistant Professor Department of Molecular Biotechnology; 2 - Candidate of science (chemistry), Postdoctorate position Department of Molecular Biotechnology; 3- Doctor of science (chemistry), Professor, Head of Department of Molecular Biotechnology, St.Petersburg State Technological Institute (technical university)
REACTION OF 4-OXO-2-THIOXO-MERCAPTO-∆2-1,3-THIAZOLIDINE WITH GASEOUS DIAZOMETHANE
Abstract
This article is about the influence of hydrogen bonds on the reactivity of organic crystals ambident compounds. It allows to find a use for them to produce various biologically active substances, pharmaceuticals and nanotechnology.
Keywords: 4-oxo-2-thioxo-1,3-thiazolidine, desmotropic forms, reactions of organic crystals, ambidentate compounds, diazomethane
Кристалл, с точки зрения, межмолекулярного взаимодействия является идеально организованной структурой, способной генерировать внешнюю энергию и не только передавать ее практически без потерь, но и накапливать, тем самым скачкообразно меняя свою структуру и приобретая высокую реакционную способность. Если сравнивать между собой неорганические и органические кристаллы, то последние, благодаря своей структуре, а именно наличию в кристаллической решетке более двух сортов атомов, имеют, на наш взгляд, преимущества, позволяющие им при малых размерах увеличивать количество функций выполняемых кристаллом в десятки, а то и сотни раз. Все это приводит к тому, что благодаря своему строению органические кристаллы открывают широкие перспективы перед наукой и техникой, и находят применение не только для производства биологически активных веществ, фармацевтических препаратов, но и, например, для хранения больших количеств водорода, а также для использования в нанотехнологии.
Продолжая исследование влияния водородных связей на реакционную способность органических кристаллов амбидентных соединений [1], нами было изучено взаимодействие кристаллов чистой десмотропной формы 4-оксо-2-тиоксо-меркапто-Δ2-1,3-тиазолина (1) с газообразным диазометаном.
4-Оксо-2-тиоксо-1,3-тиазолидин (2) и его 5-бензилиденпроизводные относятся к числу типичных триадно-таутомерных соединений. Известно, что в твердой фазе таутомерные соединения существуют либо в виде чистых десмотропных форм, либо в виде смеси этих форм в различных соотношениях, определяемых энергией кристаллизации каждой таутомерной формы [2]. Однако, в отличие от раствора, кристалл не может существовать в виде смеси таутомеров, которые находятся в динамическом равновесии. Это связано с тем, что подвижность атомов в кристалле ограничена, и молекулы каждой десмотропной формы образуют стабильную кристаллическую форму:
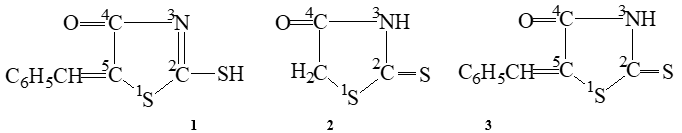
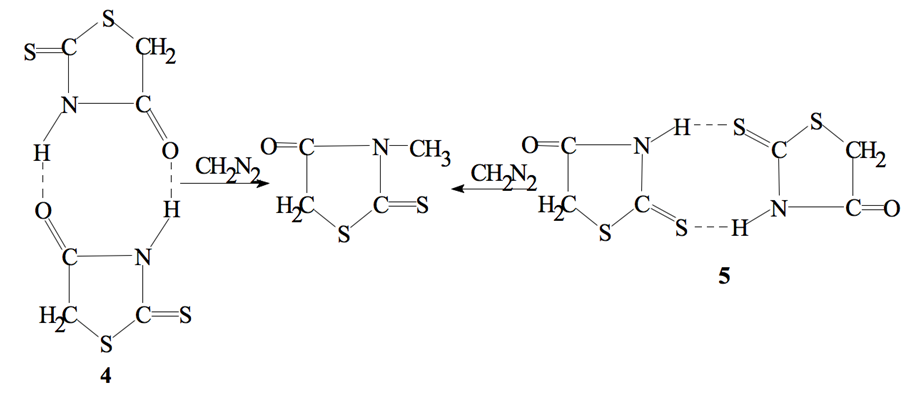
Соединение (2) существует в кристаллическом состоянии в чистой тионной форме в виде димеров двух типов либо за счет связи N3 –H∙∙∙O4’ (димер 1-го типа (4)), либо за счет связи N3 –H∙∙∙S2’ (димер 2-го типа(5)), и в реакции с газообразным диазометаном независимо от типа димера образуется только продукт присоединения CH3-радикала к атому азота в 3-положении тиазолидинового цикла. Продуктов алкилирования по эндоциклическим атомам во 2-м и 4-м положениях цикла обнаружено не было.
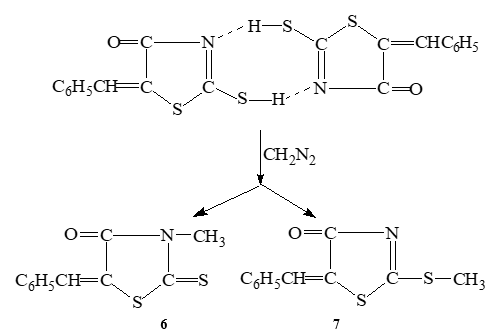
4-Оксо-2-тиоксо-5-бензилиден-1,3-тиазолидин (3) кристаллизуется из растворителей с образованием двух таутомерных форм. Данное соединение существует в кристалле в смеси с меркаптоформой (1). Следует отметить, что обе таутомерные формы также образуют димеры двух типов. Наиболее плотной упаковкой кристаллов будут обладать димеры с водородной связью N3 ··· H – S2’ и N3– Н ··· S, и в реакции с газообразным диазометаном кристаллы (3) образуют N- и S-изомеры в соотношении 1,47, что подтверждается данными ИК спектров в твердой фазе (nC4=O=1688 см-1 (для 1), nC4=O=1717 см-1 (для 3)) [4].
В связи с вышеизложенным представляло интерес исследовать реакцию кристаллов чистой десмотропной формы (1) с газообразным диазометаном. Ранее нами был разработан способ выделения чистой меркаптоформы (1) [3], кристаллы которой не содержат примесей тионной формы (3). Исходя из постулата Китайгородского [5], мы предположили, что плотная упаковка молекул меркаптоформы возможно только в виде димера с образованием сильных водородных связей N3 ··· H – S2’. Проведенные нами исследования не только подтвердили это, но и показали, что, во-первых, поскольку протон находится посередине между атомами N3 ··· H ··· S2’, то в реакции с газообразным диазометаном образуется смесь изомеров – S2-CH3 (6) и – N3-CH3 (7) в соотношении 1:1. Во-вторых, подтвердили высказанное ранее предположение о существовании димеров десмотропных форм с быстрым обменом протона. И, в третьих, показали, что водородные связи в димерах не экранируют реакционные центры.
Экспериментальная часть
4-Оксо-2-тиоксо-5-бензилиден-1,3-тиазолидин получен по методике [6], очищен трехкратной перекристаллизацией из этанола, чистоту полученного вещества проверяли методом ТСХ [6].
Газообразный дазоментан синтезировали из нитрозометилмочевины обработкой 40%-ным раствором едкого калия [1], для осушки образовавшийся диазометан пропускали через трубку с гранулами KOH.
4-Оксо-2-тиоксо-меркапто-D2-1,3-тиазолина. Навеску 2,21 г (0,01 моль) соединения (3) растворяли в 50 мл анилина, перемешивали 10 мин при комнатной температуре, упаривали до половины объема и продували сухим хлороводородом 30 мин, добавляли 50 мл хлороформа, реакционную массу упаривали досуха, твердый остаток обрабатывали 50 мл воды для удаления гидрохлорида анилина, осадок высушивали в эксикаторе над оксидом фосфора. Выход 98%, т.пл. 198ºС. Найдено, %: С 54.28, Н 3.16, N 6.30, S 28.93. C16H14N2OS2. Вычислено, %: 54.30, Н 3.17, N 6.33, S 28.96.
Реакция 5-бензилиден-2-меркапто-Δ2-тиазолидин-4-она с диазометаном в твердой фазе. Через навеску (5·10-4 моля) соединения (1), помещенную в стеклянную трубку, пропускали пары диазометана до полного превращения исходного продукта. Контроль за ходом реакции осуществляли методом ТСХ до полного исчезновения на хроматограмме исходного вещества. Продукты реакции разделяли методом препаративной ТСХ [7], идентифицировали по величине Rf двухмерной ТСХ (Rf 0.39 для – S2-CH3 и Rf 0.67 для – N3-CH3) и пробой смешания с соответствующими стандартными веществами.
ИК спектры получены на ИК спектрометре UR-20. Анализ методом ТСХ проводили на стандартных пластинках Silufol-254 в системе растворителей ацетон-гексан-уксусная кислота (1:2:0.01).
References
Аронова, Е.Б., Гинак А.И. Реакции кристаллов 5-бензилиденроданина и его диэтиламмониевой соли с диазометаном //Журнал общей химии. – 2001. – Т.71, Вып. 10. – С. 1693 – 1695.
Гинак, А.И., Сочилин Е.Г. Реакции 5-бензилиденроданина с диазометаном // Журнал органической химии.–1978.–Т.14, Вып. 5.– С. 1065 – 1069.
Аронова, Е.Б., Гинак А.И. Препаративный метод выделения чистых десмотропных форм таутомерных соединений на примере 5-бензилиден-2-меркапто - 2 -тиазолин-4-она// Журнал прикладной химии.– 2002. – Т.75, Вып. 11. – С. 1922 – 1923.
Вьюнов К.А., Гинак А.И., Сочилин Е.Г. Строение анионов и нейтральных молекул роданина// Журн. прикл. спектроск. – 1977. – Т.27, вып.6. – С.1071-1072.
Китайгородский, Л.И. Молекулярные кристаллы.– М.:Наука, 1972.–242 с.
Brown, F.С. 4-Thiazolidinones// Chem. Rev.– 1961.–Vol.61.– N. 5.– P. 463– 521.Brown, F.С. 4-Thiazolidinones// Chem. Rev.– 1961.–Vol.61.– N. 5.– P. 463– 521.
Гинак, А.И. Вьюнов, Е.Г. Сочилин Е.Г. Тонкослойная хроматография роданинов // ЖПХ.–1971.–Т.44. – № 9.– С. 2123.
