ЭЛЕКТРОХИМИЧEСКОЕ ПОВЕДЕНИЕ UO2F2 В РАСПЛАВЕ ЭВТЕКТИЧЕСКОЙ СМЕСИ LiF-NaF-KF
ЭЛЕКТРОХИМИЧEСКОЕ ПОВЕДЕНИЕ UO2F2 В РАСПЛАВЕ ЭВТЕКТИЧЕСКОЙ СМЕСИ LiF-NaF-KF
Аннотация
Фторидные расплавы могут быть использованы в качестве топливных композиций в жидкосолевых реакторах (ЖСР). В частности, расплавы на основе эвтектической смеси FLiNaK являются перспективными рабочими средами жидкосолевых реакторов-сжигателей. Одной из частых технологических примесей является кислород (элементарный или в виде оксид-ионов), что может привести к образованию в расплаве ионов уранила. В качестве метода разделения компонентов отработавшего ядерного топлива ЖСР можно использовать электролиз. Электрохимическое поведение соединений уранила во фторидных расплавленных электролитах изучено слабо, поэтому целью настоящей работы явилось исследование растворов UO2F2 в расплавах эвтектической смеси LiF–NaF–KF. Эксперименты проводили при 550–590oС в атмосфере аргона. В качестве методов исследования были использованы циклическая и квадратно-волновая вольтамперометрия, хронопотенциометрия, катодная поляризация. Концентрацию фторида уранила в электролите варьировали в диапазоне 1–3 мас. %. На основании анализа результатов электрохимических измерений сделаны выводы о механизме восстановления ионов уранила в расплаве FLiNaK.
1. Введение
Одной из главных задач современной атомной промышленности является эффективная переработка отработавшего ядерного топлива (ОЯТ), которое содержит значительное количество долгоживущих радиоактивных изотопов, включая минорные актиниды, такие как нептуний, америций и кюрий. Данные элементы могут быть выделены при переработке ОЯТ, однако их длительное хранение является сложной технической задачей. Одним из способов решения проблемы накопления долгоживущих нуклидов является их трансмутация в короткоживущие или стабильные. С этой целью могут быть использованы жидкосолевые реакторы (ЖСР). ЖСР обеспечивают возможность дожигания минорных актинидов, что не только уменьшает количество радиоактивных отходов, но и способствует более полному использованию ядерного топлива. Это создает возможность для замыкания топливного цикла, в котором ОЯТ перерабатывается, а его составные части используются для производства энергии, тем самым снижая негативное влияние на окружающую среду.
Ключевым аспектом разработки ЖСР является выбор оптимального состава расплава, в котором будут растворены делящиеся материалы. Наиболее известные фторидные расплавы для таких целей: FLiBe (смесь фторидов лития и бериллия) и FLiNaK (эвтектическая смесь фторидов лития, натрия и калия). FLiBe традиционно рассматривается как основа топлива ЖСР благодаря хорошим ядерно-физическим и теплофизическим характеристикам. Однако в последние годы всё больше внимания уделяется альтернативному составу — FLiNaK, который обладает рядом преимуществ, включая более низкую температуру плавления (~454°C против ~550°C у FLiBe), меньшую вязкость, большую доступность компонентов и отсутствие в составе соединений токсичного бериллия .
Уран является основным делящимся материалом в ядерном топливе. В топливе ЖСР уран присутствует в виде фторидов низших степеней окисления (+3 и +4). В присутствии кислородных или оксидных примесей часть урана в расплаве может быть окислена до высшей степени окисления и присутствовать в форме ионов уранила. В работе было исследовано электролитическое выделение урана из расплава LiF–NaF–KF–UF4 на никелевом электроде. Электролиз проводили при температуре 530оС в течение 90 минут при потенциале 1,85 В относительно потенциала Ni2+/Ni0 в атмосфере аргона. Анализ полученного осадка показал присутствие UO2. Авторы связывают образование диоксида урана с наличием следов кислорода в расплаве или атмосфере. Для понимания поведения уранил-иона в расплаве FLiNaK необходимо исследовать его электрохимические свойства, устойчивость кислородсодержащих соединений в фторидных расплавленных средах, кинетику процессов восстановления. Эти данные важны для разработки технологий производства топлива и переработки ядерных материалов в рамках замкнутого ЯТЦ.
Электрохимическое поведение ионов уранила исследовано как в хлоридных , , , так и во фторидных расплавах , , . В работе в качестве источника ионов UO22+ использовали UO2F2. Электролитом был расплав LiCl–KCl. Результаты анализа циклических и квадратно-волновых вольтамперограмм показали ступенчатое восстановление UO22+ → UO2+ → UO2, рассчитанное число электронов составило 1,20 и 1,16, соответственно. Аналогичные результаты были получены в работе , где источником уранил-ионов служил UO2Cl2. В качестве соли-растворителя также была использована смесь хлоридов лития и калия.
Двухступенчатое восстановление иона уранила было подтверждено и во фторидных электролитах. В работе исследовали расплав LiF–NaF–KF–UO2F2, содержание урана составляло 1,55 мас. %. На циклической вольтамперограмме присутствовали две катодные волны и одна анодная. Авторы предположили, что анодный пик связан с окислением UO2 → UO22+, а катодные соответствуют двум последовательным реакциям восстановления с участием одного электрона. Результаты циклической вольтамперометрии согласуются с квадратно-волновой. В работе эксперименты проводили в расплаве LiF–BeF2. Результаты показали, что восстановление ионов UO22+ происходит в одну стадию с участием двух электронов.
Анализ литературных данных показывает, что исследование электрохимических свойств уранил-иона в расплавах на основе фторидов металлов носит фрагментарный характер. В связи с этим актуальным являлось проведение более детального изучения электрохимического поведения уранил-иона в расплаве FLiNaK, который представляет практический интерес.
2. Методика эксперимента
В эксперименте в качестве растворителя использовали эвтектическую смесь фторидов лития, натрия и калия (массовое соотношение LiF:NaF:KF = 29:12:59). Для электрохимических измерений применяли потенциостат/гальваностат AUTOLAB PGSTAT 12/30/302. Эксперименты проводили в трёхэлектродных ячейках. Рабочий электрод представлял собой вольфрамовый стержень диаметром 1,7 мм, площадь поверхности которого рассчитывали после каждого эксперимента, учитывая глубину погружения. Другой вольфрамовый стержень использовали в качестве квазиэлектрода сравнения, противоэлектродом служил стержень из стеклоуглерода. Исследуемый расплав, содержащий ионы уранила, получали растворением навесок UO2F2 в соли-растворителе. Фторид уранила готовили по реакции триоксида урана с HF. Полученный продукт представлял мелкокристаллическое гигроскопичное вещество лимонно-жёлтого цвета. Рентгенофазовый анализ показал присутствие только фазы UO2F2, рис. 1.
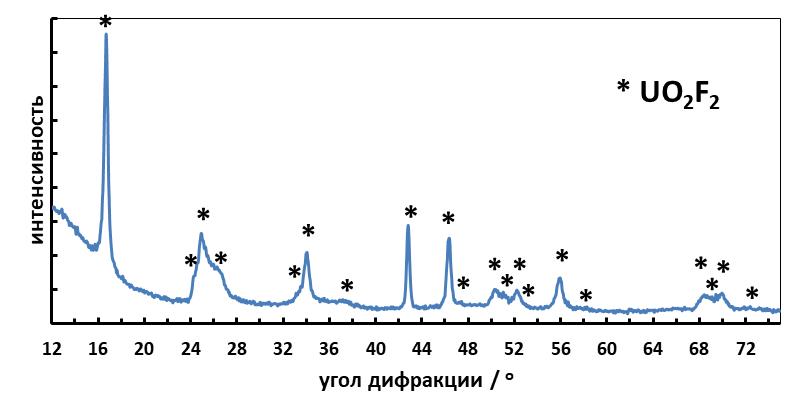
Рисунок 1 - Рентгенограмма фторида уранила, использованного для приготовления электролита
3. Результаты и обсуждение
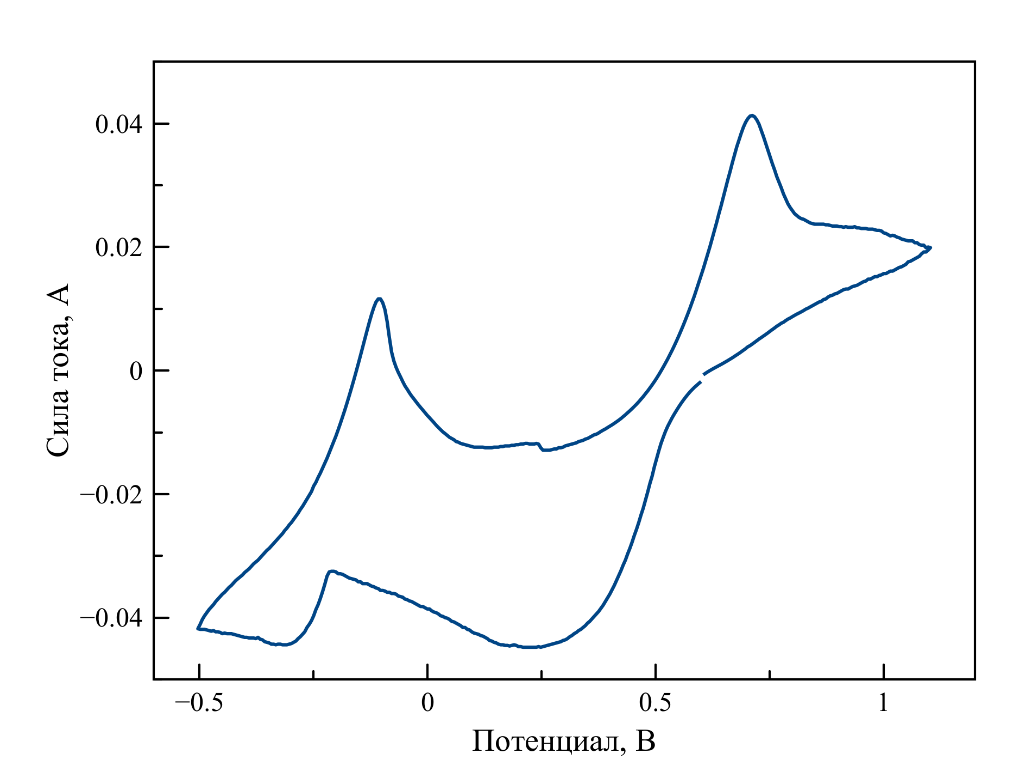
Рисунок 2 - Циклическая вольтамперограмма, зарегистрированная в расплаве NaCl–KCl–UO2Cl2 при 750оС под атмосферой аргона
Примечание: [U] = 0,79 мас.%; скорость поляризации рабочего электрода 0,1 В/с; потенциалы приведены относительно хлоридсеребряного электрода (Ag/AgCl, 1 мол.% в NaCl–2CsCl)
где ЕСР – потенциал пика катодного процесса, В;
ЕСР/2 – потенциал полупика катодного процесса, В;
R – универсальная газовая постоянная, 8,314 Дж/(моль·К);
Т – абсолютная температура, К;
F – постоянная Фарадея, 96485 Кл/моль.
Рассчитанное по данной зависимости число электронов, принимающих участие в процессе восстановления, составило около двух.
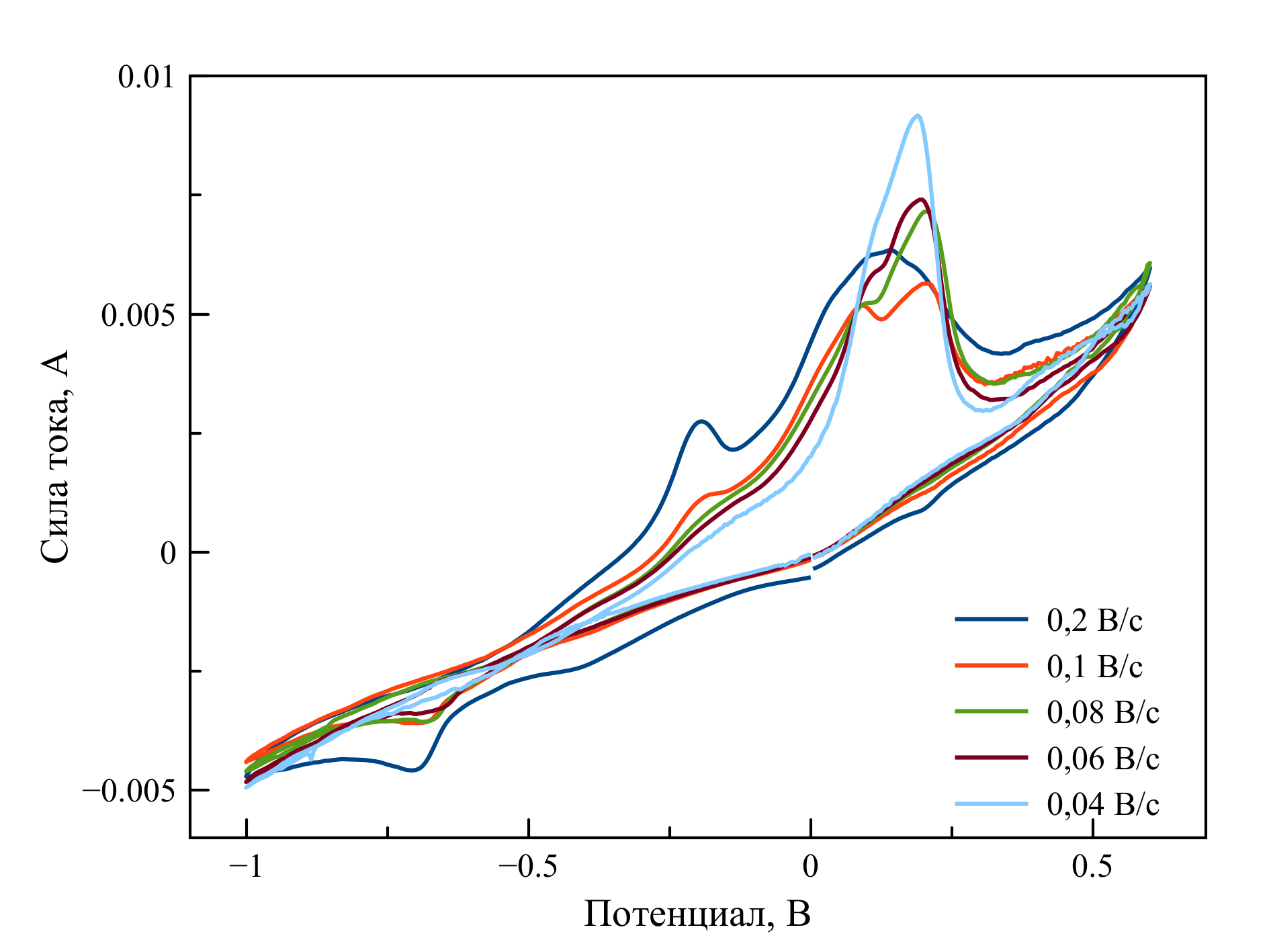
Рисунок 3 - Циклические вольтамперограммы, зарегистрированные в расплаве LiF–NaF–KF–UO2F2
Примечание: при 588oC, [U] = 0,88 мас. %. и разных скоростях поляризации рабочего электрода
![Пример циклической вольтамперограммы, зарегистрированной в расплаве LiF–NaF–KF–UO2F2 при 588oC, [U] = 0,88 мас. % при скорости поляризации рабочего электрода 0,2 В/с (а) и разложение анодной части вольтамперограммы на индивидуальные компоненты (б)](/media/images/2025-07-08/f0487d7f-e7eb-42c2-8814-d5134978832a.png)
Рисунок 4 - Пример циклической вольтамперограммы, зарегистрированной в расплаве LiF–NaF–KF–UO2F2 при 588oC, [U] = 0,88 мас. % при скорости поляризации рабочего электрода 0,2 В/с (а) и разложение анодной части вольтамперограммы на индивидуальные компоненты (б)
Два анодных пика вероятнее всего связаны с двухступенчатым окислением диоксида урана UO2 → UO2+ → UO22+. Для верификации сделанных предположений было рассчитано число электронов, участвующих в каждой стадии окисления. Для реакции UO2 → UO2+ использовали формулу (1), число электронов составило примерно один. Для процесса с участием растворимых форм число электронов, рассчитанное по формуле (2), также составило около один:
Использование квазиэлектрода не позволяет проводить непосредственное сравнение значений электродных и окислительно-восстановительных потенциалов, измеренных в различных фторидных электролитах, но на рис. 5 катодная волна около –0,6 В хорошо согласуется с катодной волной на циклической вольтамперограмме и соответствует процессу UO22+ → UO2. Число электронов, принимающих участие в реакции, рассчитывали по формуле (3):
где W1/2 – полуширина пика, R;
T и F – как указано ранее.
Рассчитанное по формуле число электронов для катодного процесса составило два, что согласуется с результатами анализа циклических вольтамперограмм и подтверждает одностадийное двухэлектронное восстановление ионов уранила.
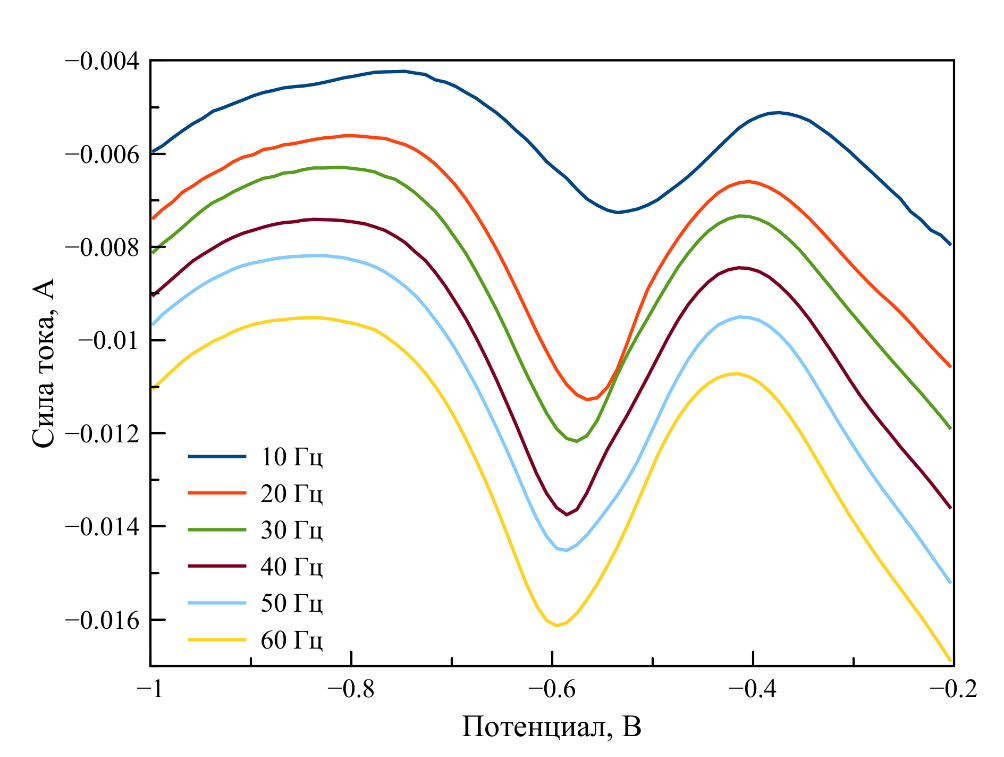
Рисунок 5 - Квадратно-волновые вольтамперограммы, зарегистрированные в расплаве LiF–NaF–KF–UO2F2
Примечание: при 588oC, [U] = 0,88 мас. % и разных частотах сканирования
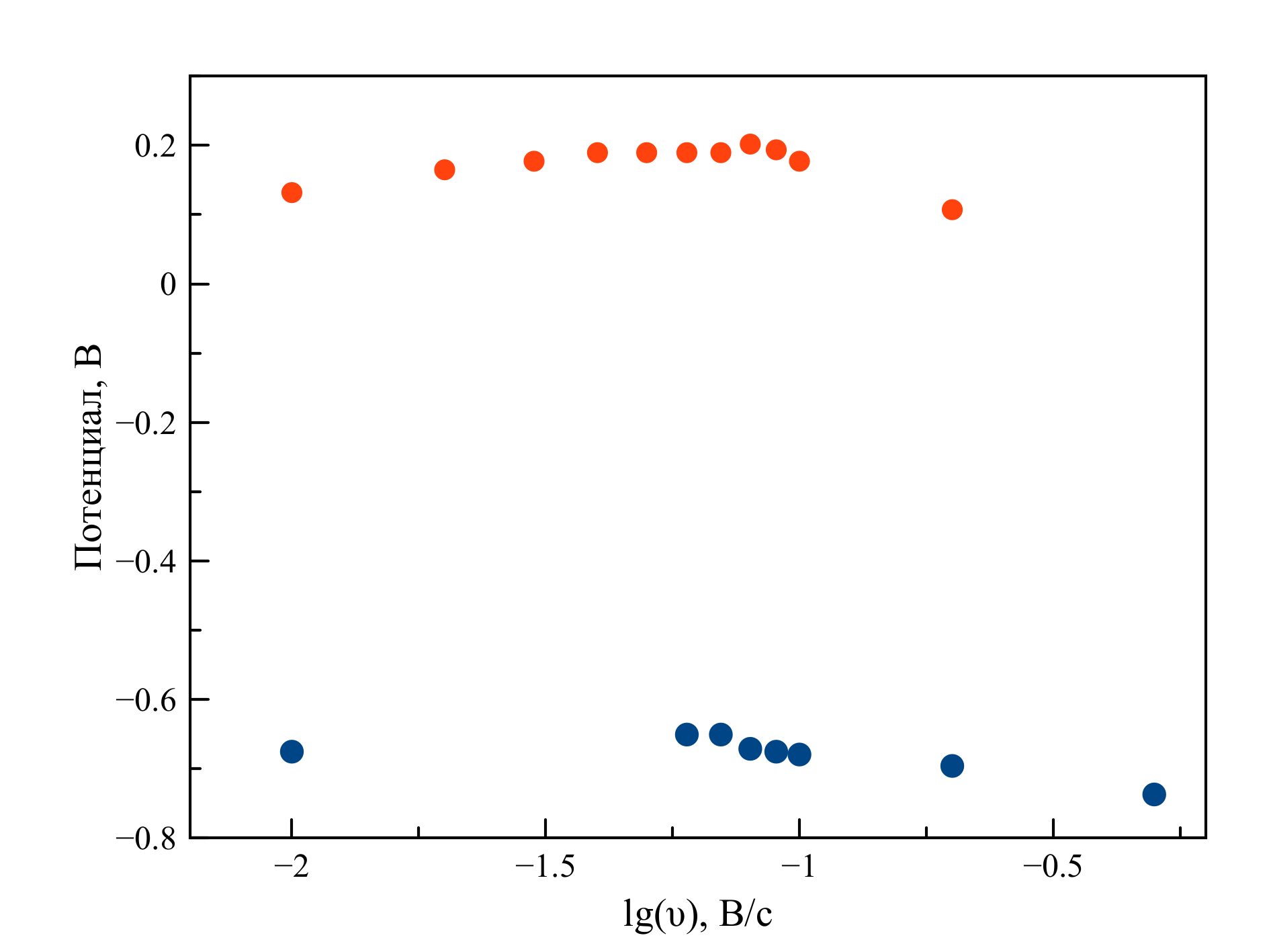
Рисунок 6 - Зависимость потенциалов катодного и анодного пиков от логарифма скорости поляризации рабочего электрода на циклических вольтамперограммах, зарегистрированных в расплаве LiF–NaF–KF–UO2F2
Примечание: при 588oC, [U] = 0,88 мас. %
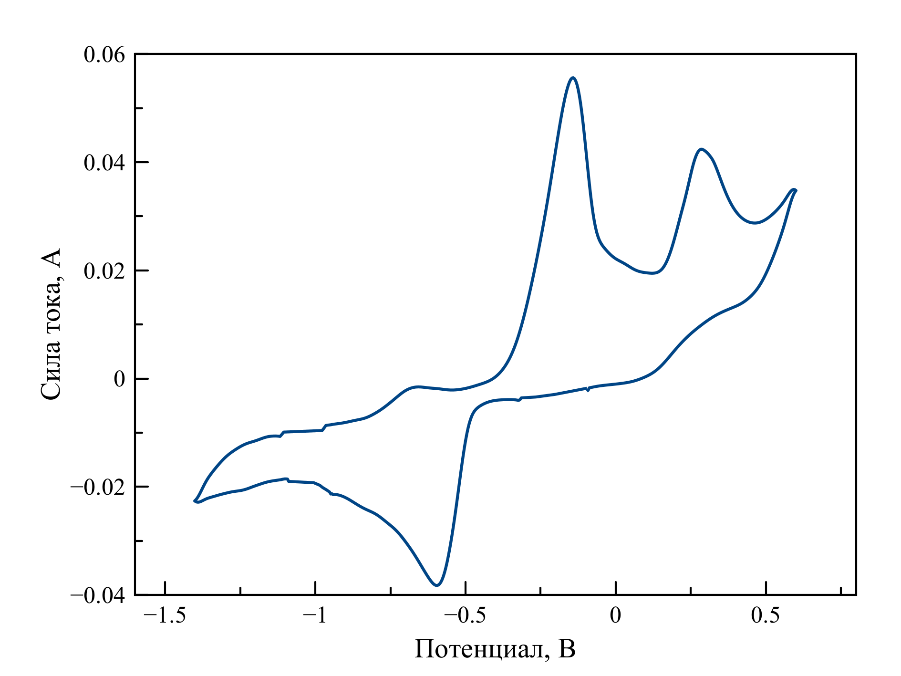
Рисунок 7 - Циклическая вольтамперограмма, зарегистрированная в расплаве LiF–NaF–KF–UO2F2
Примечание: при 573oC, [U] = 1,77 мас. %, скорость поляризации рабочего электрода 0,1 В/с
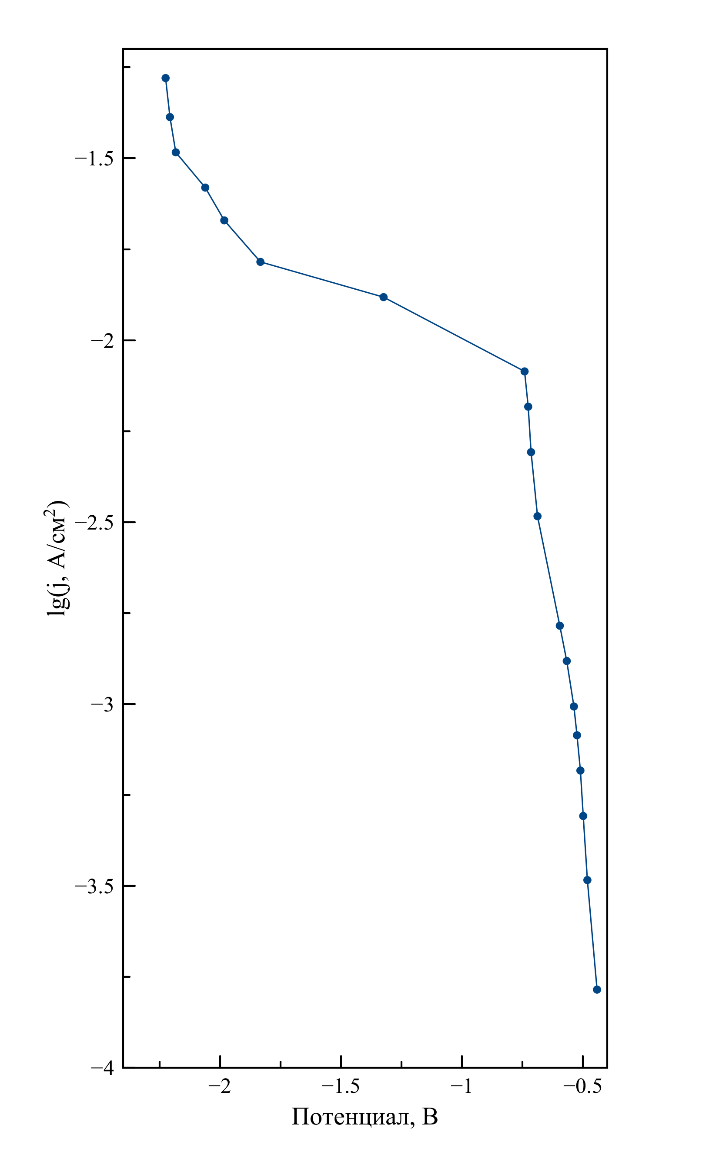
Рисунок 8 - Поляризация вольфрамового катода в расплаве LiF–NaF–KF–UO2F2
Примечание: при 584оС, [U] = 1,59 мас. %
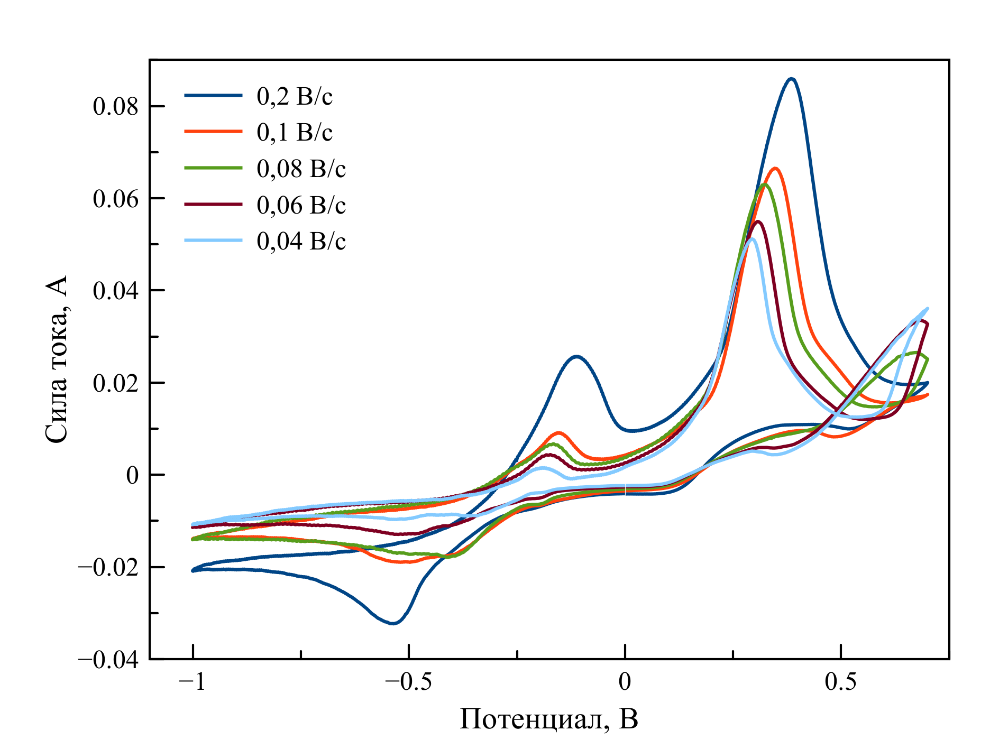
Рисунок 9 - Циклические вольтамперограммы, зарегистрированные в расплаве LiF–NaF–KF–UO2F2
Примечание: при 570oC, [U] = 2,99 мас. %; скорости поляризации рабочего электрода приведены на графике
4. Заключение
В работе было исследовано поведение уранил-ионов в расплаве на основе тройной эвтектической смеси фторидов лития, натрия и калия. На основании анализа результатов циклической вольтамперометрии показано, что при малом содержании фторида уранила происходит одностадийное восстановление U(VI) → U(IV) с образованием диоксида урана и двухстадийное окисление U(IV) → U(V) → U(VI), сделаны выводы об обратимости процесса. При увеличении концентрации урана в расплаве фиксируются две последовательные стадии катодного восстановления UO22+ → UO2+ → UO2. Механизм анодного растворения диоксида урана в этих условиях требует дальнейшего исследования.
