Коррозия хастеллоя g-35 в хлоралюминате натрия
Коррозия хастеллоя g-35 в хлоралюминате натрия
Аннотация
Измерены равновесные потенциалы алюминия и стационарные потенциал коррозии сплавов. Получены данные для оценки коррозионной способности системы солевой расплав хлоралюмината калия — газ (аргон) путем измерения окислительно-восстановительного потенциала указанной среды в зависимости от состава газовой атмосферы над ней, т.е. от примесей паров воды, соляной кислоты, кислорода и других, например, углеродсодержащих газов. Выполнены расчеты эффективности защиты, используя разность потенциалов между металлическим алюминием и защищаемым материалом.
1. Введение
Данная статья посвящена коррозии хастеллоя G35 и влиянии степени подготовки компонентов для работы с данным сплавом. Ранее было исследовано коррозионно-электрохимическое поведение ряда сплавов (Хастеллоев) ХН65МВУ, С 2000, С 276 в солевых системах AlCl3 – ZrCl4, которые показали высокое химическое сопротивление по сплошной (фронтальной) коррозии. Однако их поведение с точки зрения межкристаллитной коррозии и процессов ректификации в оборудовании при температурах выше 500 ºС было неудовлетворительное .
Коррозия в расплавленных солях является электрохимической и состоит из двух сопряженных электродных процессов:
1. Анодного процесса перехода поверхностных атомов металла в виде ионов в расплав в результате сольватации их анионами расплавленной соли;
2. Катодного процесса ассимиляции электронов деполяризатором.
Значение коррозионных исследований определяется тремя аспектами. Первых из них — экономический — имеет целью уменьшение материальных потерь. Второй аспект – повышение надежности оборудования. Надежность является важнейшим условием при разработке оборудования АЭС и систем захоронения радиоактивных отходов. Третьим аспектом является сохранность металлического фонда. Мировые ресурсы металла ограничены, а потери металла в результате коррозии ведут кроме того, к дополнительным затратам энергии и воды . Исходя из этих аспектов, необходимо определить причину коррозии и предложить способы её предотвращения. Таким образом, к настоящему времени способы защиты от коррозии сплава хастеллой G-35 в хлоралюминатах остаются недостаточными.
Целью является:
1. Исследование процесса коррозии сплава хастеллой G35 в хлоралюминате натрия;
2. Выработка рекомендаций по предотвращению коррозии в сплаве.
2. Методы и принципы исследования
Чтобы обеспечить защиту всего оборудования, работающего в среде расплавленных солей хлоралюминатов от сплошной фронтальной коррозии необходимо использовать металлический алюминий в качестве протектора . В этом случае следует выполнить определенные расчеты эффективности защиты, в расчетных формулах которых должна фигурировать разность потенциалов между металлическим алюминием и защищаемым материалом. Поэтому возникает серьезная задача по измерению равновесных потенциалов алюминия и стационарных потенциалов (потенциалов коррозии) материалов оборудования.
Было исследовано корозионно-электрохимическое поведение сплава и определен химический состав сплава хастеллоя G35, результаты исследования приведены в таблице 1.
Таблица 1 - Химический состав сплава хастеллой G35
Элемент | Cr | Fe | Mn | Mo | C | Si | S | Ni |
масс. % | 33,00 | ≤ 2,00 | ≤ 0,50 | 8,00 | ≤0,05 | 0,60 | ≤(0,15-0,20) | 55,83 |
Измерение равновесных потенциалов алюминия и стационарных потенциалов материалов оборудования (сплава хастеллой G35) в расплавленной смеси хлоридов алюминия и натрия в зависимости от температуры и концентрации.
Проведение измерений
Загружаемый хлоралюминат натрия был рафинирован крупкой металлического алюминия. Загрузку соли и сборку ячейки осуществляли в сухом боксе в атмосфере аргона (рис. 1). В собранном виде ячейку вынимали из бокса и вставляли в термостатированную печь с задаваемой программой нагрева. Ячейку в холодном состоянии вакуумировали, затем запускали аргон и вновь вакуумировали . Эту процедуру повторяли дважды, чтобы по возможности полностью удалить адсорбированные кислород и влагу с поверхностей ячейки и ее деталей. «Промытую» ячейку заполняли аргоном и начинали нагревать печь до заданной температуры. При достижении постоянного её значения начинали измерения. За достоверные значения потенциалов принимали такие, которые оставались постоянными длительное время (от одного до двух и более часов) в пределах ±0,002 В.
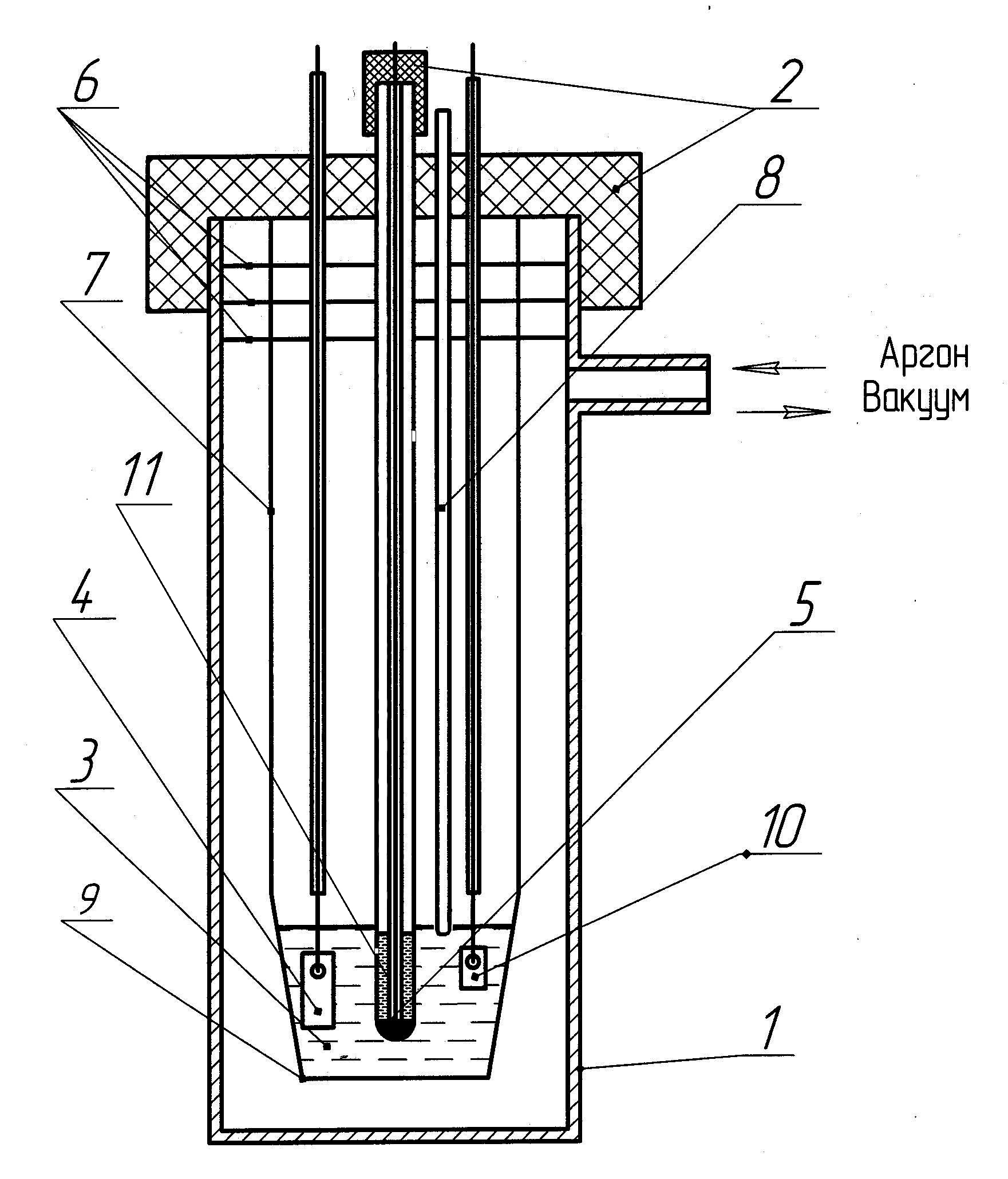
Рисунок 1 - Электрохимическая ячейка для измерения равновесных потенциалов алюминия в расплавленной смеси хлоридов алюминия и натрия в зависимости от температуры и концентрации
Примечание: 1 - ячейка кварцевая; 2 - пробки резиновые; 3 - расплав; 4 - алюминиевый электрод; 5 - свинцовый электрод сравнения; 6 - защитные экраны; 7 - подвеска тигля; 8 - чехол для термопары; 9 - тигель из оксида алюминия (алундовый); 10 - электрод из исследуемого сплава хастеллой G35; 11 - асбестовая диафрагма в чехле электрода сравнения
Измеренные значения равновесных (Е1) и стационарных (Е'1) потенциалов алюминия и сплава хастеллой G35 относительно свинцового электрода сравнения затем пересчитывали на хлорный электрод сравнения, Е и Е' по выражениям:
где E2 — равновесные потенциалы свинца относительно хлорного электрода сравнения; Е' и Е'1 — равновесные и стационарные потенциалы электродов алюминия и из сплавов оборудования относительно хлорного электрода сравнения соответственно; Δφ — величина диффузионного потенциала, возникающего, между электролитами. Её величина для электролитов с высокой электропроводностью очень мала . Была измерена температурная зависимость (в интервале температур 270 – 370 ºС) равновесного потенциала алюминия в расплаве NaAlCl4 (состава NaCl/AlCl3 = 1,0/1,0) относительно хлорсеребряного электрода сравнения. Его величины уменьшались с понижением температуры на 100 ºС от 0,7 до 0,835 мВ.
Были измерены стационарные потенциалы сплава G35 в зависимости от температуры в этом же диапазоне (см. табл. 2). Температурная зависимость стационарных потенциалов сплава хастеллоя G35). Установлено, что величины стационарных потенциалов (потенциалов коррозии) сплава практически не изменяются с температурой, оставаясь постоянной величиной 0,020 мВ относительно хлорсеребряного электрода сравнения , , , .
Таблица 2 - Температурная зависимость стационарных потенциалов сплава хастеллоя G35
№ опыта | Температура, ºС | Величина потенциала Е, мВ | |
Алюминий | Хастеллой G-35 | ||
1 | 270,0 | 0,700 | 0,020 |
2 | 320,0 | 0,750 | 0,020 |
3 | 370,0 | 0,835 | 0,020 |
3. Основные результаты
Были также измерены вольтамперные характеристики этого материала для температуры 370 ºС. Вольтамперная поляризационная кривая зависит экспоненциально от потенциала поляризации с ярко проявляющимся перегибом в районе потенциалов, — 1,32 В относительно хлорсеребряного электрода сравнения . Практически ниспадающая часть поляризационной кривой, начинающаяся от потенциала перегиба, линейная, уравнение линейной аппроксимации начальных участков поляризационных кривых, в полулогарифмических координатах которой описывается выражением:
где I — сила тока поляризации, в мА/ см2; V — величина потенциала поляризации; αV — сила тока коррозии материала G35 при отсутствии поляризации, т.е. когда напряжение поляризации равно нулю
, .Площадь рабочего электрода (S) была равна 4,26 см2. Сила тока I = 0,72 мА и, следовательно, плотность тока коррозии (i) в расчете на 1 см2 будет 0,169 мА/ см2. Величина потенциала точки перегиба есть не что иное, как начало активного анодного растворения стали
. Следует также отметить, что величина равновесного потенциала алюминия в солевом расплаве NaAlCl4 отрицательнее потенциала растворения электрода из сплава на ~ -0,72 до -0,855 В .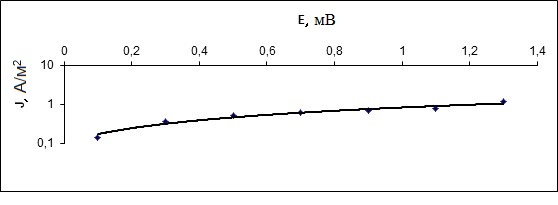
Рисунок 2 - Поляризационная вольтамперная кривая для расчета токов коррозии конструкционных материалов (Хастеллой G35) в расплаве хлоралюмината натрия в зависимости от температуры
На рисунке 2 представлена поляризационная вольтамперная кривая для расчета токов коррозии конструкционных материалов в расплаве хлоралюмината калия в зависимости от температуры.
На графике видно, что при включении анодного тока происходит коррозия, которая затем выходит на плато, где происходит замедленная коррозия и это плато называется пассивацией.
Установлено, что значения стационарных потенциалов сплава G35 практически не изменяются с температурой, оставаясь постоянными.
4. Заключение
Токи коррозии сплава G 35 в солевом расплаве NaAlCl4 значительно ниже, чем в более дорогих сталях ХН65МВУ, С 2000, С 276 (Хастеллои) практически при близкой температуре к 380 ºС, по сравнению с расплавом KAlCl4. В расплаве KAlCl4 высокая улетучиваемость коррозионно-активных компонентов и низкая температура плавления, а также в процессах, где присутствие калия менее предпочтительно по сравнению с натрием по их атомно-физическим свойствам. Так, величины токов коррозии для всех указанных сплавов ХН65МВУ, С 2000, С 276 имеют почти одинаковые скорости коррозии и в среднем незначительно меняются в интервале от ~ 1,00 до 1,50 мА/ см2, в то время как в случае сплава хастеллой G35 скорость коррозии существенно ниже и составляют величину плотности тока коррозии 0,169 мА/ см2.
Измеренные величины стационарных потенциалов материалов оборудования УРХЦГ, отличающиеся на 1 В от равновесного электродного потенциала алюминия, являются основанием для организации эффективной протекторной защиты металлических сплавов от фронтальной коррозии, используя в качестве протектора металлический алюминий.
Неизменность измеренных равновесных потенциалов алюминия и стационарных потенциалов сплава хастеллой G35 от времени и температуры в диапазоне от 270 до 370 ºС свидетельствует о стабильности и устойчивости системы в целом, если она изолирована от внешних факторов, таких как: попадание в систему воздуха или влаги, больших местных перегревов и плохих качеств швов на участках сварки сплава G35. Сплавы с большим содержанием никеля требуют прецизионных условий плавки
.