Твердые электролиты сольватокомплексов сульфатов калия и натрия в пористых слоях аморфного диоксида кремния и аминоацетатных производных ПВХ на волокнах целлюлозной ткани
Твердые электролиты сольватокомплексов сульфатов калия и натрия в пористых слоях аморфного диоксида кремния и аминоацетатных производных ПВХ на волокнах целлюлозной ткани
Аннотация
Синтезированы две линейки твердых электролитов, которые состоят из донорного растворителя в виде пористого слоя из глицинатных производных ПВХ, привитых к микрочастицам аэросила и к волокнам целлюлозной ткани, и растворенных в нем аквакомплексов сульфата натрия в первом случае и сульфата калия во втором. Сорбционный объем растворителя и растворимость сульфата натрия и калия возрастают с увеличением массовой доли аэросила. Для каждого растворителя содержание сульфата калия оказалось больше, чем сульфата натрия. Исследована зависимость тока от напряжения в цепи Pt (+) – раствор K2SO4 – мостик из твердого электролита – раствор K2SO4 Pt (-) и внутреннее сопротивление исследуемых растворов. Длина мостика 20 см, ширина 10 см. В исследуемых областях напряжений (до 25 В) получившиеся электролиты – линейные ионные проводники. Показано, что лимитирующей стадией движения зарядов в цепи является их перенос через электролит. Для каждого растворителя с сульфатом калия напряжение начала движения ионов оказалось ниже, а скорость движения ионов выше, чем у электролитов с сульфатом натрия.
1. Введение
Сформированные на волокнах целлюлозной ткани пористые слои из микрочастиц аморфного диоксида кремния, к развитой поверхности которых привиты аминоацетатные производные ПВХ, и сульфата натрия, сорбированного из водного раствора, представляют собой твердые электролиты [1], [2]. Их электропроводность и поляризуемость зависят от состава раствора и растворителя и возрастают пропорционально массовой доле оксида кремния в растворителе и содержанию соли [2]. Аналогом Na2SO4является K2SO4. В этом аспекте представлял интерес проследить влияние природы катиона на электропроводность твердых растворов 2:1 электролитов в донорном растворителе [2]. Интересующие нас данные в литературе отсутствуют.
Цель исследования - синтезировать и измерить электропроводность твердых электролитов сульфатов калия и сульфата натрия, сорбированных из водных растворов, в растворителе с разным содержанием аэросила.
2. Материалы и методы исследования
Материалы и реактивы: тетрагидрофуран, бензиловый спирт «ч», глицин «ч», гидроокись калия «хч», натрий сернокислой безводный «чда». калий сернокислый, смола ПВХ, марка SG-7, содержание ПВХ 88% пластификатор – эфиры терефталевой кислоты – около 10 %, хлопковая марля, медицинская, отмытая в ТГФ, содержание целлюлозы 97,0-97,5%, плотность 1,45 г/см3, аморфный оксид кремния (аэросил марки А300).
Были приготовлены: 3,33 моль/л раствор глицината калия, 1,5 моль/л сернокислого натрия и 0,6 моль/л сернокислого калия.
Методы исследования - химический анализ, измерение сопротивления (мультиметр Robiton Master DMM-850, погрешность измерения ± 0,8%), вольт-амперометрия по методике [1], [2], погрешность измерения тока при заданном напряжении 0.5 мкА.
3. Основные результаты
По методике [2] были синтезированы три растворителя ГАI, ГАII и ГАIII: масса слоя на волокнах ткани и массовая доля оксида кремния в слое указаны в [2].
Электролиты синтезированы по методике [1], [2] путем выдержки образцов в растворах 1,5 моль/л сульфата натрия или 0,6 моль/л сульфата калия, с последующим удалением окклюдированной жидкости с помощью фильтровальной бумаги, сушкой до постоянной массы при 110-115оС и выдержкой на воздухе со 100 % влажностью. Электролиты сульфата натрия обозначены как ГАIН, ГАIIН и ГАIIIН, а сульфата калия - как ГАIК, ГАIIК и ГАIIIК. Содержание сульфатов (Ссул) и воды (Сaq) в ГАIК – 3.11 и 2.04 ммоль/г, в ГАIIК – 5.22 и 3.90 ммоль/г, а в ГАIIIК – 6.84 и 5.85 ммоль/г. Соответствующие показатели для электролитов с сульфатом натрия приведены в [2].
Во всех случаях Ссул и Сaq возрастает с увеличением массовой доли оксида кремния. Для каждого растворителя содержание сульфата натрия меньше, чем сульфата калия.
Измерение электропроводности электролитов, как электрохимических мостиков проводили по методике [2]. Была сформирована электрохимическая ячейка из двух стаканов с 1.5 М раствором сульфата натрия или с 0.6 М раствором сульфата калия с платиновыми электродами, соединенными с источником постоянного тока и мостиком из твердого электролита (длина 20 см, ширина 10 см), концы которого опущены в растворы на 0.3 см. Задавали напряжение U и измеряли ток J в цепи. Зависимости J от U приведены на рисунке 1. Предварительно были измерены внутренние сопротивления растворов между электродом и концом мостиков. Сопротивление раствора сульфата натрия 2,9 кОм, а раствора сульфата калия 3.6 кОм. Сопротивление мостиков ГАIН -5 кОм, ГАIК – 9 кОм, ГАIIН – 9.8 кОм, ГАIIК – 12 Ком, ГАIIIН – 10.6 кОм, а ГАIIIК – 15 кОм.
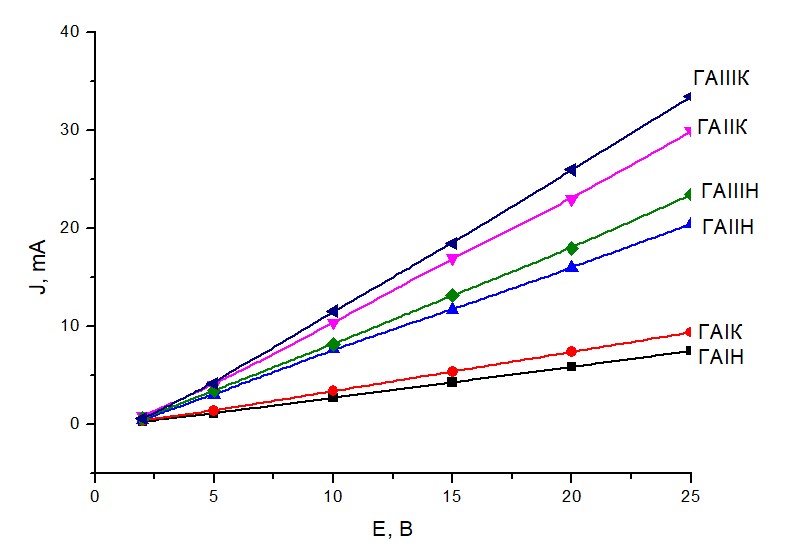
Рисунок 1 - Электропроводность полученных электролитов.
В изученном диапазоне напряжений (до 25 В) величины J/U практически зависит от U, это означает, что электролиты как электрохимические мостики ведут себя как линейные проводники. Поскольку внутреннее сопротивление растворов меньше, чем у электролитов, то лимитирующей стадией движения зарядов в цепи является их перенос через электролит. В таком случае величина тока в цепи соответствует скорости переноса зарядов через электролит и равна Vпер = J/F, где, F – число Фарадея. Установлено, что зависимость V от U отвечает уравнению V= kск(U-U0), где U0 – напряжение, при котором начинается перенос зарядов в электролите, kск - константа скорости переноса зарядов. Их значения приведены в таблице 1.
Таблица 1 - Напряжение начала движения зарядов в цепи и константа скорости переноса заряда в твердом электролите
Электролит | U0, B | Kск*106, г-экв/B*сек |
ГАIH | 0,12 | 1,86 |
ГАIIH | 0,21 | 2,90 |
ГАIIIH | 0,28 | 3,83 |
ГАIК | 0,1 | 3,94 |
ГАIIК | 0,2 | 8,08 |
ГАIIIК | 0,22 | 12,4 |
Видно, что для каждого растворителя напряжение начала движения зарядов в цепи меньше у сульфата калия, а константа скорости переноса заряда в электролите с сульфатом калия выше, чем с сульфатом натрия. С увеличением доли оксида кремния одновременно возрастают как U0, так и kск.
4. Заключение
Влияние природы катиона щелочного металла на состав и электропроводность электролитов можно объяснить следующим образом. В стенках пор производных ПВХ имеются >N-СН2-СОО- * М+ группы [1], [2], производные через O=Si(-O-)-О- СН< группы привиты к развитой поверхность оксида кремния, в стенах пор которых имеются O=Si(O-)2 и O=Si(-O-)-ОН группы [3]. Группы адекватны молекулам жидких неводных донорных и амфипротонных растворителей и ионных жидкостей [4], [5], [6], [7]. При сорбции сульфатов в порах образуются многоядерные сольватокомплексы общей формулы {[M(H2O)jL]2SO4}n где M+= Na+ или K+, L - группировки донорных атомов, построенные как ассоциаты контактных и сольваторазделенных ионных структур [8], [9], [10]. Вокруг Na+ и K+ могут находиться только донорные атомы азота аминогрупп и кислорода из SO42-, -СОО-, O=Si(O-)2, O=Si(-O-)-ОН и O=Si(-O-)-О- СН< групп, причем в оболочку Na+ может входить до 6 -, а и К+ - до 8 атомов донорных атомов. Согласно [11], в кристаллогидратах каждый SO42- как мостик связан с двумя катионами. Судя по величинам отношения Сaq/2Ссул, равного среднему числу атомов кислорода из молекул воды, очевидно, что молекул воды недостаточно для насыщения первой оболочки. Катионы, связанные с группировками растворителя, дислоцированы у стенок пор. С увеличением массовой доли оксида кремния увеличивается содержание O=Si(O-)2, O=Si(-O-)-ОН. В каждом растворителе Сaq/2Ссул для Na+ больше, чем К+. Это указывает на то, что одни и те же группировки связывают большее К+, чем Na+. Молекулы воды и амфипртонные группы одновременно связаны с катионом и с SO42- с образованием развитой системы водородной связи. При подключении источника тока, на платиновом катоде происходит реакция 2Н2О +2е =Н2 +2ОН-, а на аноде - реакция 2Н2О -4е =О2 + 4Н+. В таких условиях движение Na+ или K+ от анода к катоду, а SO42- от катода к аноду исключено. Подвижность Н+ больше ОН- [8]. Перенос Н+ из раствора с анодом в раствор с катодом происходит через систему водородных связей по эстафетному механизму. Как отмечалось выше kск растет с увеличением доли оксида кремния. Это позволяет предположить, что в электролите имеются два канала проводимости – один с участием комплексов, сольватированных группами полимера, а другой - группами оксида кремния. Подвижность Н+ в первом ниже, чем во втором. В первом систему водородных связей формируют молекулы воды, а во втором - молекулы воды и Si-О-Н группы. Значение kск в электролите с сульфатом калия выше, чем с сульфатом натрия. Ионный радиус K+ больше, чем Na+. Это позволяет предположить, что лабильность водородных связей в комплексах калия выше, чем натрия.
