Сравнение интенсивности апоптоза малодифференцированных кардиомиоцитов кур в раннем нормальном и экспериментальном посттравматическом кардиомиогенезах
Сравнение интенсивности апоптоза малодифференцированных кардиомиоцитов кур в раннем нормальном и экспериментальном посттравматическом кардиомиогенезах
Аннотация
Изучение проявлений апоптоза актуально вследствие его универсальности, обнаруживаемости при норме и в различных патологиях.
Цель: определить и сравнить интенсивность апоптоза кардиомиоцитов у эмбрионов кур в раннем нормально развивающемся сердце и при нанесении термотравмы. Материалы и методы: светооптическая и электронная микроскопия, иммуногистохимия, морфометрия.
Результаты: миокард имеет диффузно располагающиеся клетки на различных этапах апоптотической гибели до 96 часов инкубации. Через 12 часов после нанесения термотравмы зарегистрирован пик гибнущих апоптозом кардиомиоцитов. На 108 часах инкубации апоптоз сердечных мышечных клеток в группах уже не обнаруживался. Вывод: наблюдается посттравматическая «стабильность» популяции развивающихся кардиомиоцитов у кур после нанесения локальной термотравмы.
1. Введение
Смертность людей от патологий, связанных с нарушением различных морфологических элементов сердца и кровоснабжающих его сосудов уже не одно десятилетие удерживает 1 место в мире [1]. В патогенезе атеросклероза, инфаркта миокарда, миокардита ведущую роль играет апоптоз – процесс генетически запрограммированной клеточной гибели, затрагивающий прежде всего невосполнимую у взрослого человека популяцию высокодифференцированных кардиомиоцитов [2]. Однако апоптоз развивающихся кардиомиоцитов по мнению ряда авторов [3], [4], [5] обнаруживается и в ходе нормального гистогенеза у экспериментальных животных и человека, являясь одной из важнейших составляющих в ходе кардиогенеза. Работы морфологов, посвященных закономерностям структурных проявлений, хронологическим и посттравматическим особенностям течения апоптотического процесса в ходе кардиогенеза крайне малочисленны.
Целью нашей работы являлось выявление и сравнение интенсивности морфологических проявлений апоптоза у малодифференцированных кардиомиоцитов эмбрионов кур, в ходе раннего нормального развития сердечной мышцы и, в те же сроки, после её локальной термотравмы.
2. Дизайн исследования, материалы и методы
С помощью светооптического гистологического, электронномикроскопического, морфометрического и иммуногистохимического методов в сравнительном аспекте изучался компактный и трабекулярный миокард развивающихся сердец куриных эмбрионов (обыкновенных домашних кур). Данные по забору материала в 2-х группах представлены в таблице №1.
Таблица 1 - Сроки и количество исследуемого материала (сердца куриных эмбрионов) по часам инкубации и часам, прошедшим после эксперимента
Группы/сроки инкубации и забора материала | 72 часа инкубации | 84 часа инкубации. 12 часов после термотравмы | 96 часа инкубации. 24 часов после термотравмы | 108 часа инкубации. 36 часов после термотравмы |
1 гр. контроль, шт | 3 | 3 | 3 | 3 |
2 гр. эксперимент, шт | Нанесение термотравмы | 3 | 3 | 3 |
3. Суть эксперимента
Сердца эмбрионов в экспериментальной группе подвергались локальному термическому повреждению развивающегося сердца на 72-м часе после оплодотворения. Для этого над эмбрионом в скорлупе и волокнистой оболочке инкубированного яйца инъекционной иглой делались доступы диаметром 10-15 мм. Затем сердце повреждалось в области желудочков элекротермокаутером (в течение 5 секунд, температура 180 С). После эксперимента доступ в скорлупе закрывался стерильной полупроницаемой мембраной и яйцо снова помещалось в инкубатор. Сроки забора материала в контрольной и экспериментальной группах указаны в таблице №1. После стандартных этапов фиксации и обезвоживания сердца курных эмбрионов заливали в парафин, затем с помощью микротома ротационного типа КD-2260 из парафиновых блоков изготавливались серийные срезы толщиной 7 мкм., которые окрашивались гематоксилином-эозином и по Малори. После оценки качества полученных срезов проводилось иммуногистохимическое исследование (ИГХ), которое выполнено с использованием стандартных маркеров, выявляющих клетки, гибнущие апоптозом: р53 и Bcl 2. На полученных срезах подсчитывался также митотический индекс и интенсивность экспрессии ИГХ-маркера пролиферации Кi-67. Для трансмиссионной электронной микроскопии часть биоматериала, после соответствующей фиксации глутаральдегидом окрашивалась осмиевой кислотой, обезвоживалась и заливалась в аралдит. Из полученных блоков изготавливались прицельные полутонкие срезы, окрашиваемые толуидиновым синим. С помощью светооптической микроскопии полутонкие срезы анализировались и для дальнейшей обработки на полученных срезах выбирались участки компактного и трабекулярного миокарда. Из участков миокарда «прицеленных» блоков проводилось изготовление ультратонких срезов с последующим их контрастированием уранилацетатом. Полученные ультратонкие срезы просматривались и анализировались на электронном микроскопе Philips/FEI XL 30S FEG SEM; Scanning Electron Microscope EDAX EDS; ЭВМ-100 К и Tecnai G2 Spirit Bio TWIN с системой фотосъемки Tecnai Plate Camera System и цифровой видеокамерой высокого разрешения SIS Mega View III. Морфометрическое исследование включало количественную оценку клеток, гибнущих апоптозом на всех сроках исследования в контроле и эксперименте, а также степени выраженности интенсивности цветовых проявлений иммуногистохимических маркеров (экспрессии) по шкале: не выявляется (отрицательно), слабо выраженный, умеренный, интенсивный. На всех исследуемых сроках, с помощью окуляр – микрометра, на серийных гистологических срезах подсчитывался митотический индекс – МИ. Для объективизации полученных данных применялись методы вариационной статистики (биометрии) – лицензионный пакет компьютерных программ Statistica.
4. Собственные данные
72 часа (только контроль)
р53 – реакция слабо положительная; Bcl 2 – реакция слабо выраженная; митоз МИ - 46±0.2; Кi-67 – реакция интенсивная. Электронная микроскопия – выявляются диффузно расположенные единичные клетки с морфологическими проявлениями апоптоза.
84 часа инкубации (12 часов после термотравмы)
Контроль: р53 - реакция слабо выраженная, Bcl 2 - реакция слабо выраженная, митоз МИ - 18±0.2; Электронная микроскопия - обнаруживаются единичные апоптотические тельца.
Травма: р53 - реакция слабо выряженная; Bcl 2 - реакция слабо выраженная; митоз МИ -16±0.2; Кi-67 – реакция умеренная; Электронная микроскопия - выявляются единичные кардиомиоциты с проявлениями апоптоза преимущественно на стадии апоптотических телец.
96 часа инкубации (24 часов после термотравмы)
Контроль: р53 - реакция интенсивная, Bcl 2- реакция интенсивная, митоз МИ - 18±0.01; Электронная микроскопия - обнаруживаются единичные клетки на различных этапах апоптоза.
Травма: р53 – реакция интенсивная; Bcl 2 – реакция интенсивная; митоз МИ 28±0.3; Кi-67 – реакция умеренная; Электронная микроскопия – в области повреждения обнаруживаются локальные группы кардиомиоцитов с морфологическими проявлениями апоптотической гибели (на разных этапах, в том числе и апоптотические тельца).
108 часа инкубации (36 часов после термотравмы)
Контроль: р53 – реакция отрицательная; Bcl 2 – реакция отрицательная; митоз МИ - 27±0.2; Кi-67 – реакция умеренная; Электронная микроскопия кардиомиоцитов гибнущих апоптозом не выявлено.
Травма: р53 - реакция отрицательная; Bcl 2 - реакция отрицательная; митоз МИ - 25±0.001; Кi-67 – реакция умеренная; Электронная микроскопия – кардиомиоцитов гибнущих апоптозом не выявлено.
Общее описание
На светооптическом уровне в трабекулярном и компактном миокарде на всех исследуемых сроках кардиомиогенеза обнаруживаются обширные группы и тяжи кардиомиоцитов с крупными ядрами, хорошо выраженными 1 или 2 ядрышками, фрагментарно базофильной цитоплазмой. Встречаются клетки с фигурами митоза. Обнаруживаются клетки эндотелия, формирующие примитивные сосуды. Иммуногистохимическое исследование показало, что клетки с интенсивной экспрессией в ядрах и цитоплазме ИГХ-маркеров Bcl-2 и р53, распределены диффузно выявляются и в развивающихся компактном, и в трабекулярном миокарде к 24 суткам после травмы (86 часов инкубации) Рис.1а. Прицельная электронная микроскопия позволяет утверждать, что гибнущие клетки не имеют связи с окружающими дифференцирующимися кардиомиоцитами и окружены неизмененными дифференцирующимися или митотически делящимися миоцитами. Специализированные контакты между ними полностью отсутствуют. Изменяется форма клетки. Ядра подобных кардиомиоцитов имеют инвагинации ядерной оболочки, конденсированный хроматин в виде мелких частиц, равномерно распределённых по всей нуклеоплазме. Объём кардиомиоцитов существенно уменьшается, однако целостность плазмолеммы не нарушается. В цитоплазме сохраняется большинство клеточных структур, присутствует большое количество лизосом, цитоскелет уплотнен. Здесь же наблюдается наличие небольших по размеру митохондрий с умеренно плотным матриксом и развитыми кристами. Идет формирование различных по диаметру апоптотических телец. Рис.1б. Фото ИГХ и электроннограммы на рисунках 2а;2б демонстрируют отсутствие апоптотической активности продолжающих дифференцировку кардиомиоцитов на 108 часах инкубации (36 часов после травмы). Высокие показатели митотического индекса и появление миофибрилл свидетельствуют о продолжающемся кардиомиогенезе.
5. Заключение
Ряд авторов [6], [7], [8] утверждает, что запрограммированная на уровне генома смерть кардиомиоцитов в раннем развитии сердца необходима для нормального течения морфогенетических процессов. В частности – для образования межжелудочковых перегородок. В запуске посттравматического апоптоза участвуют различные компоненты клетки, прежде всего – плазматическая мембрана и митохондрии. Индукция апоптоза и активация проапоптотических белков ведёт к активации каспаз, расщепляющих белки – мишени. В результате происходит разрушение внутриклеточных органелл или их перестройка, фрагментация клетки на апоптотические тельца [9], [10], [11]. Из проведенного нами комплексного исследования формирующегося миокарда на стадии «трубчатого сердца» 86 часов инкубации следует, что среди клеточных элементов как компактного, так и трабекулярного участков миокарда встречаются единичные малодифференцированные кардиомиоциты на различных стадиях апоптотической гибели. Наше электронномикороскопическое исследование убеждает, что кардиомиоциты с проявлениями запрограммированной клеточной гибели в ходе раннего кардиомиогенеза располагаются единично и по отдельности выявлялись с 72 по 96 час инкубации. Через 24 часа после нанесения травмы они обнаруживаются группами и на разных хронологических этапах апоптотической гибели.
Выводы. Из проведенного нами комплексного исследования следует:
1. Апоптотические проявления обнаруживаются в некоторых из дифференцирующихся кардиомиоцитов на 3-х исследуемых сроках (72,84,96 сутках) нормального кардиомиогенеза.
2. Через 24 часа после локальной термотравмы обнаруживаются статистически достоверно большее, чем в контрольной группе количество кардиомиоцитов гибнущих механизмом апоптоза.
3. К 108 часам инкубации у кур в обеих исследуемых группах дифференцирующихся кардиомиоцитов с морфологическими проявлениями генетически запрограммированной клеточной гибели не обнаруживается.
Заключение.
Процесс апоптоза малодифференцированных кардиомиоцитов у кур на ранних стадиях развития характерен для начальных этапов развития миокарда и связан не с травмой, а закономерностями раннего кардиомиогенеза. Несмотря на нанесение термической травмы в область развивающегося миокарда и гибели до 10% клеток, в сердечной мышечной ткани активируются процессы митоза, за счёт которого клеточная популяция дифференцирующихся кардиомиоцитов восполняется, а само развитие миокарда продолжается без дальнейших структурных нарушений.
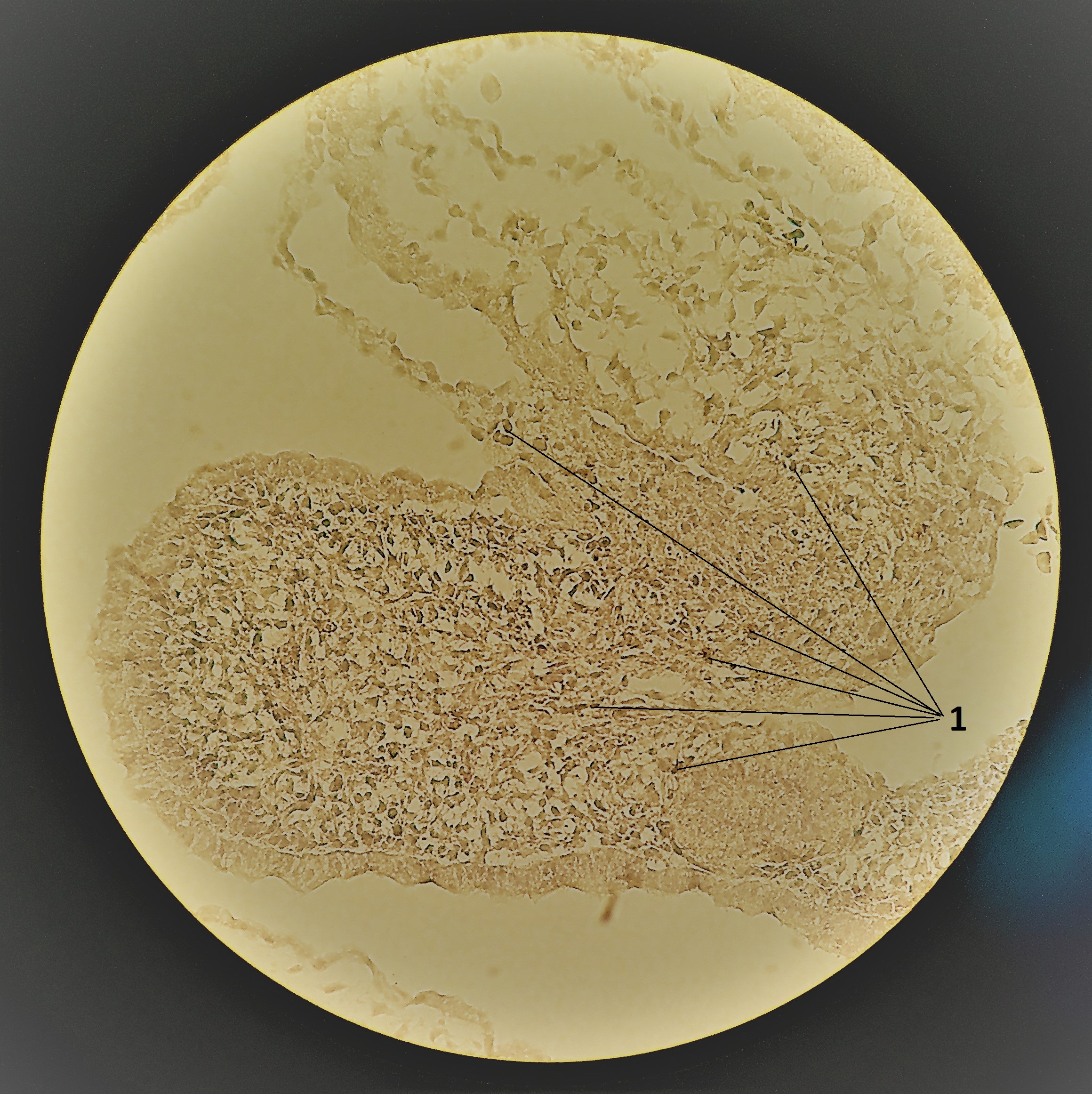
Рисунок 1 - Компактный миокард куриного эмбриона:
1 - малодифференцированные кардиомиоциты на различных стадиях апоптотической гибели
Примечание: 84 часа инкубации; 24 часов после термотравмы; положительная реакция на маркер апоптоза Bcl-2; ув. х10
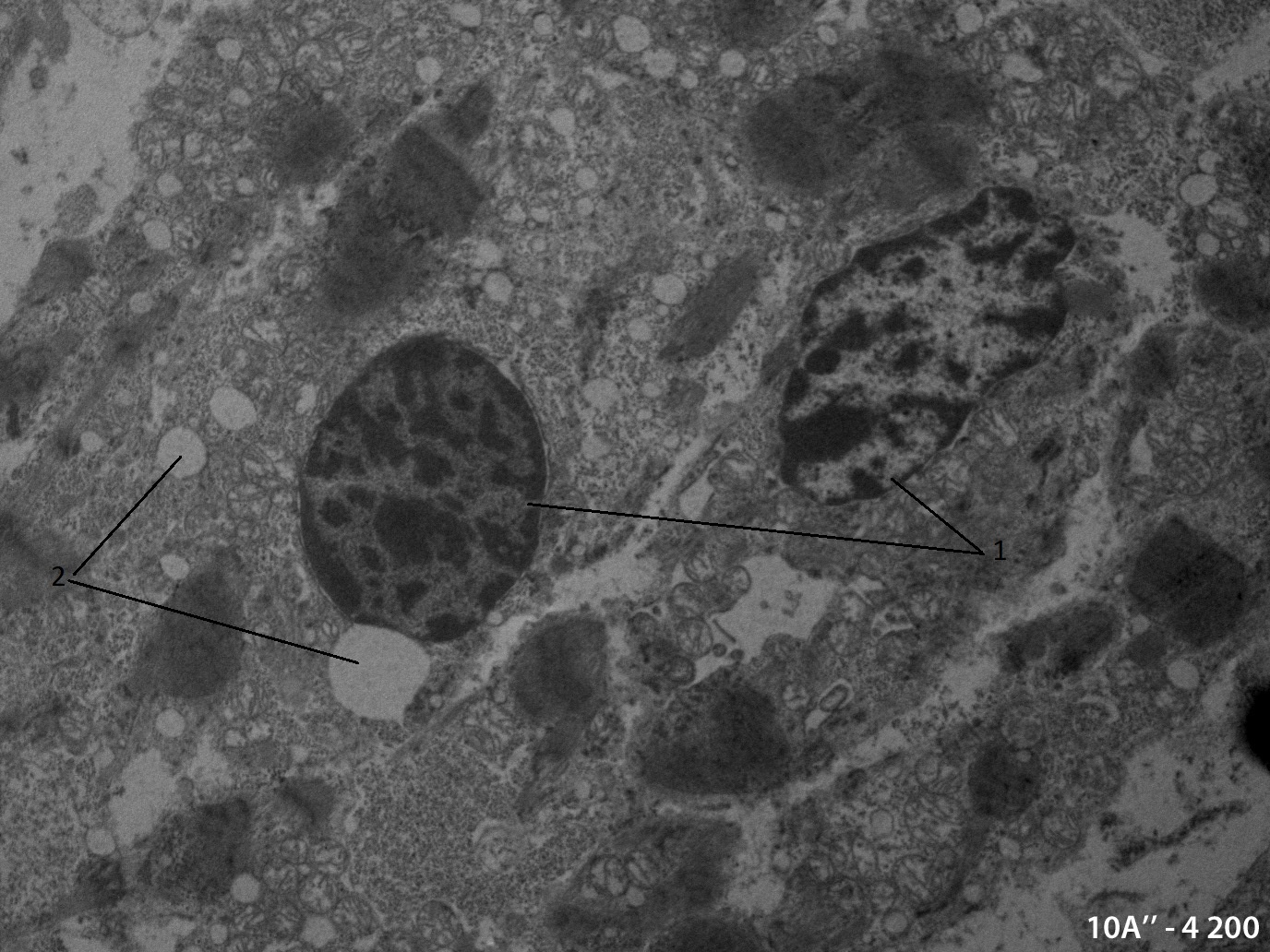
Рисунок 2 - Электронномикороскопическое фото малодифференцированных кардиомиоцитов развивающегося миокарда куриного эмбриона через 24 часов после термотравмы на различных стадиях апоптотической гибели:
1 - уплотнения хроматина в ядрах кардиомиоцитов; 2 - апоптотические тельца
Примечание: 84 часа инкубации; ув. х 4200
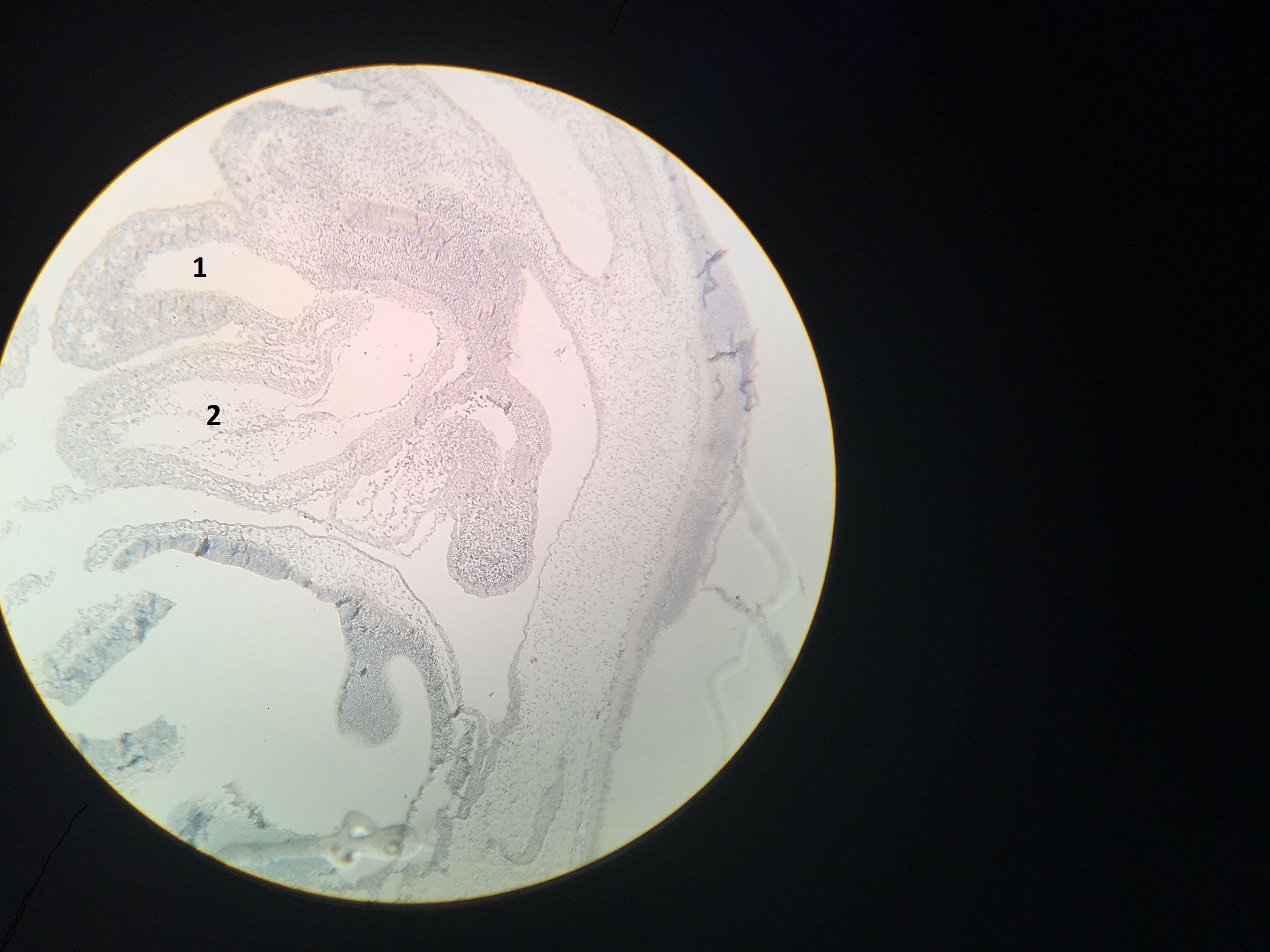
Рисунок 3 - Отрицательная реакция на маркеры апоптоза Bcl-2, р53:
1 - правое предсердие; 2 - правый желудочек
Примечание: сердце куриного эмбриона; 108 часов инкубации; 36 часов после локальной термотравмы
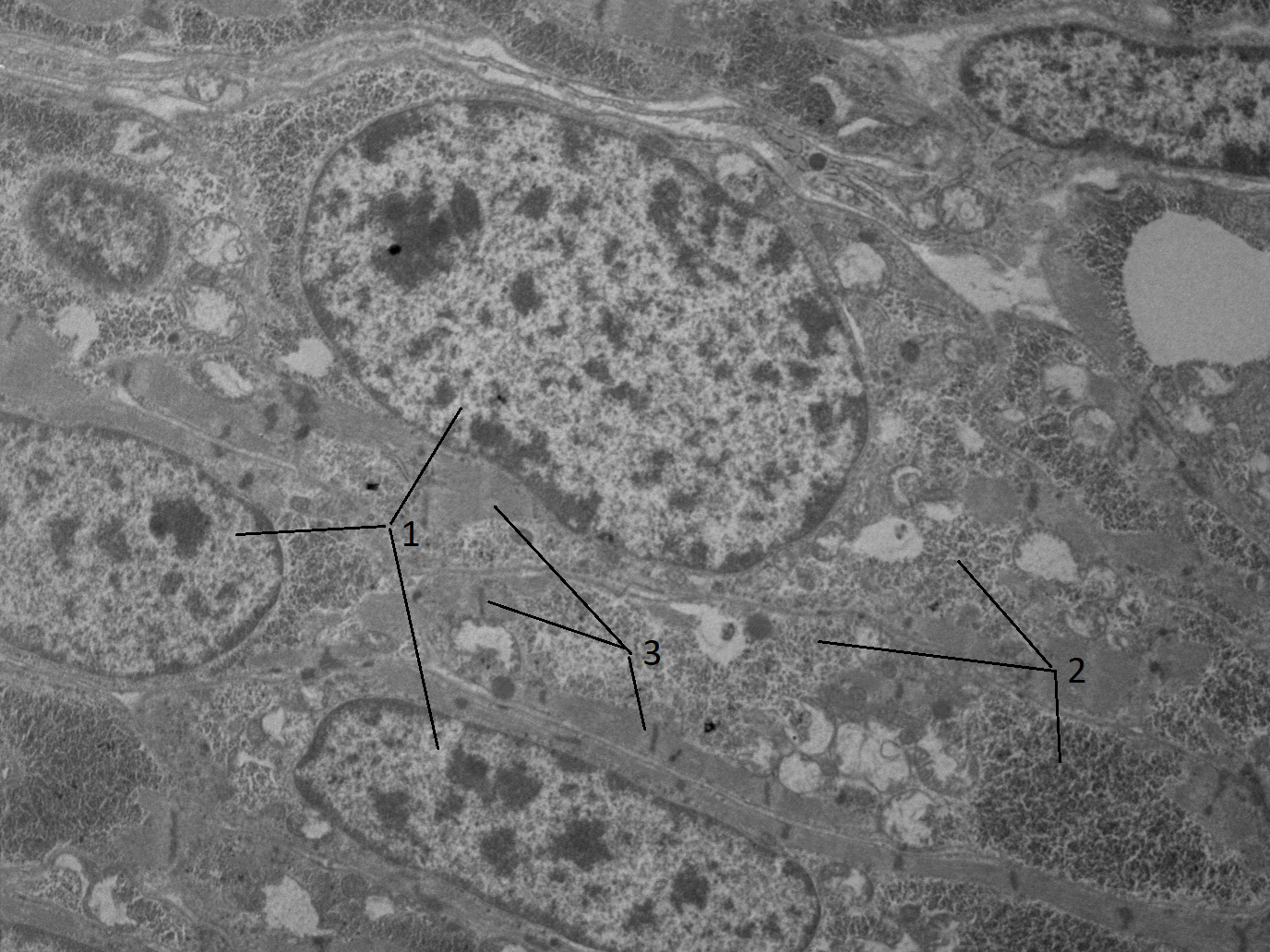
Рисунок 4 - Продолжающие процессы цито дифференцировки в кардиомиоцитах куриного эмбриона:
1 - активный деспирализованный хроматин; 2 - группы полисом; 3 - формирующиеся миофибриллы
Примечание: 108 часов инкубации; 36 часов после нанесения локальной термотравмы; электронная микрофотография; ув. х7500
