ВЛИЯНИЕ СВОБОДНОРАДИКАЛЬНОГО ОКИСЛЕНИЯ НА УРОВЕНЬ КОРТИКОСТЕРОИДНЫХ РЕЦЕПТОРОВ В ПЕЧЕНИ У ЖИВОТНЫХ В ЗАВИСИМОСТИ ОТ ИСХОДНОЙ ЧУВСТВИТЕЛЬНОСТИ К ГИПОКСИИ В ДИНАМИКЕ ПОСТРЕАНИМАЦИОННОГО ПЕРИОДА
Байбурина Г.А.
Кандидат медицинских наук, доцент,
Башкирский государственный медицинский университет в г. Уфе
ВЛИЯНИЕ СВОБОДНОРАДИКАЛЬНОГО ОКИСЛЕНИЯ НА УРОВЕНЬ КОРТИКОСТЕРОИДНЫХ РЕЦЕПТОРОВ В ПЕЧЕНИ У ЖИВОТНЫХ В ЗАВИСИМОСТИ ОТ ИСХОДНОЙ ЧУВСТВИТЕЛЬНОСТИ К ГИПОКСИИ В ДИНАМИКЕ ПОСТРЕАНИМАЦИОННОГО ПЕРИОДА
Аннотация
Эксперимент выполнен на самцах неинбредных белых крыс, разделенных на 2 группы по устойчивости к гипоксии. 5-минутную остановку системного кровообращения моделировали под общим эфирным наркозом интраторакальным пережатием сосудистого пучка сердца с последующей реанимацией. Период наблюдения составлял 35 дней. В плазме крови определяли содержание кортикостерона и альдостерона, в гомогенатах печени уровни ТБК-реагирующих продуктов, карбонилированных белков, железо-зависимое образование битирозина, концентрацию глюкокортикоидных и минералокортикоидных рецепторов. Установлено, что высокая активность свободнорадикального окисления, проявляющаяся развитием карбонильного стресса у низкоустойчивых к гипоксии крыс на фоне снижения активности ключевых антиоксидантов, сопряжена с более выраженными изменениями динамики кортикостероидных рецепторов. В то же время относительно низкая интенсивность окислительного стресса у высокоустойчивых к гипоксии крыс, характеризующаяся только усилением липопероксидации, сопровождается сохранением, в целом, функциональности рецепторов.
Ключевые слова: глюкокортикоидные рецепторы, минералокортикоидные рецепторы, перекисное окисление липидов, окислительная модификация белков, резистентность к гипоксии.
Bayburina G.A.
MD, Associate professor,
Bashkir State Medical University in Ufa
INFLUENCE OF FREE RADICAL OXIDATION ON LEVEL OF CORTICOSTEROID RECEPTORS IN LIVERS OF ANIMALS DEPENDING ON INITIAL SENSITIVITY TO HYPOXIA IN DYNAMICS OF POSTRESUSCITATION PERIOD
Abstract
The experiment was carried out on males of noninbred white rats divided into 2 groups by resistance to hypoxia. A 5-minute stop of the systemic circulation was simulated by general etheric anesthesia by intra-thoracic compression of the vascular bundle of the heart followed by resuscitation. The follow-up period was 35 days. The content of corticosterone and aldosterone were determined in the blood plasma; carbonylated proteins, iron-dependent formation of bityrosine, the levels of TBA-reacting products, the concentration of glucocorticoid and mineralocorticoid receptors were determined in the liver homogenates. It was found that the high activity of free radical oxidation, manifested by the development of carbonyl stress in low-resistant rats against hypoxia against the background of a decrease in the activity of key antioxidants, is associated with more pronounced changes in the dynamics of corticosteroid receptors. At the same time, the relatively low intensity of oxidative stress in those rats, highly resistant to hypoxia, characterized only by increased lipid peroxidation, is accompanied by the preservation, in general, of the functionality of the receptors.
Keywords: glucocorticoid receptors, mineralocorticoid receptors, lipid peroxidation, oxidative modification of proteins, resistance to hypoxia.
В основе развития большинства критических состояний лежат два взаимосвязанных процесса – гипоксия (ишемия), с одной стороны, и реоксигенация (реперфузия), с другой [1, С. 94]. Несмотря на то, что гипоксия-реоксигенация является типовым патологическим процессом и ее механизмы подчинены универсальным закономерностям, степень ущерба и возможности восстановления организма после гипоксического воздействия весьма различаются. В основе различий ответной реакции организма на экстремальные гипоксические воздействия лежат генетически детерминированные физиолого-биохимические реакции [2, С. 202].
Для реализации адаптивно-компенсаторных реакций при острой гипоксии требуется координация большого количества метаболических процессов, включая свободнорадикальное окисление (СРО), осуществляемая при участии кортикостероидных гормонов. Печень является одним из главных органов-мишеней для гормонов, реализующих свое действие через локальную кортикостероид-рецепторную сигнализацию [3, С. 475]. Взаимодействие кортикостероидных гормонов со своими ядерными рецепторами имеет важное значение не только для нормальной функции печени. Её способность противостоять вызовам среды, обеспечивать на них адекватный метаболический ответ, поддерживать гомеостаз во многом определяет жизнеспособность организма.
В цели настоящего исследования входила оценка влияния свободнорадикального окисления на уровень кортикостероидных рецепторов в печени у животных в зависимости от исходной чувствительности к гипоксии в постреанимационном периоде.
Материалы и методы. Серия экспериментов выполнена на 160 половозрелых самцах неинбредных белых крыс массой 200-220 г. Животных содержали на стандартном рационе вивария при свободном доступе к воде. Условия проведения экспериментов для контрольных и опытных групп были идентичными.
По итогам тестирования на устойчивость к гипоксии [4] животные были разделены на 2 группы – неустойчивые (НУ) и высокоустойчивые (ВУ). Группы включали по 70 опытных и 10 контрольных крыс. Через неделю после тестирования под общим эфирным наркозом моделировали 5-минутную остановку кровообращения интраторакальным пережатием сосудистого пучка сердца по методу Корпачева В.Г. [5, С. 78-80]. Реанимация проводилась с помощью наружного массажа сердца и искусственной вентиляции легких. Контрольная группа крыс после тестирования на устойчивость к гипоксии подвергалась эфирному наркозу без моделирования аноксии. Период наблюдения составлял 35 дней. По истечении 1-х, 3-, 5-, 7-, 14-, 21- и 35-х суток животных под эфирным наркозом выводили из эксперимента декапитацией и осуществляли забор крови и тканей для исследования.
Базальный уровень карбонилирования белков (КБ) и интенсивность металл-катализируемого окисления (МКО-КБ) определяли по реакции продуктов окислительной модификации белков (ОМБ) с 2,4-динитрофенилгидразином с последующей спектрофотометрической регистрацией продуктов взаимодействия – динитрофенилгидразонов [6, С. 272], железо-зависимое образование битирозина (БТ) по методу Дубининой Е.Е. [6, С. 275]. Содержание продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-рп), определяли с помощью набора реактивов «ТБК-АГАТ» (фирма ООО АГАТ-МЕД, Москва). С использованием радиоиммунологического метода и стандартных тест-систем IMMUNOTECH (Чехия) исследовали уровень кортикостерона и альдостерона. Изучение содержания глюкокортикоидных (ГР) и минералокортикоидных рецепторов (МР) на грамм белка в гомогенатах печени осуществляли методом иммуноферментного анализа, используя стандартные тест-наборы ELISA Kit (Китай, фирмы Cloud-Clone Сorp., США).
Статистическую обработку результатов проводили с использованием стандартного пакета программ Statistica 6.0. Описательная статистика данных проводилась в виде среднего квадратического отклонения М±m. Сравнение групп проводили с использованием непараметрического (критерий (U) Манна–Уитни) метода.
Результаты исследования. Активность процессов перекисного окисления липидов (ПОЛ) по уровню накопления ТБК-рп была статистически значимо выше у животных с высокой устойчивостью к гипоксии во все исcледованные отрезки времени, включая контрольный (р≤0,05) (рис. 1а). В оппозитной группе отмечалась почти зеркально противоположная картина. Моделирование гипоксии приводило к резкому падению активности процессов ПОЛ, что нашло выражение в статистически значимом снижении содержания ТБК-рп в печени НУ особей на всем протяжении постреанимационного периода.
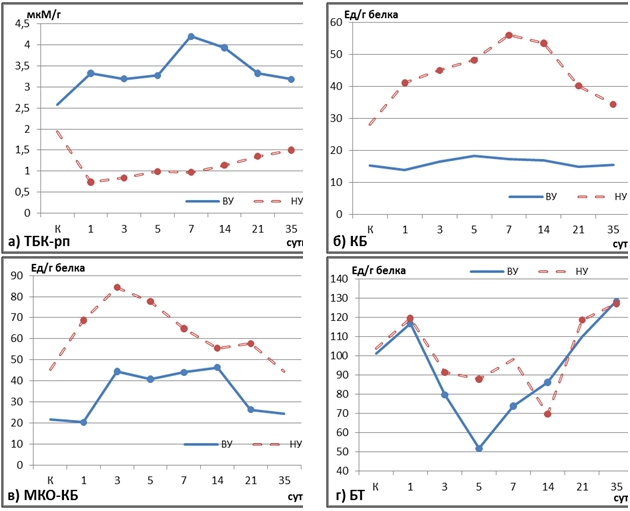
Рис. 1 – Динамика свободнорадикального окисления в печени по уровню ТБК-рп (а), карбонилированных белков (КБ) (б), металл-катализируемого окисления (МКО-КБ) (в), битирозина (БТ) (г) в постреанимационном периоде у крыс в зависимости от исходной чувствительности к гипоксии
Примечание: ● – статистическая значимость различий по отношению к контролю, р≤0,05
Динамика окислительной модификации белков в печени имела обратную зависимость, которая также обнаруживалась уже в контрольных группах: исходные уровни карбонилированных белков (как базальные, так и в ответ на индукцию), кроме битирозина, у НУ крыс были статистически значимо выше. Выраженный карбонильный стресс у НУ крыс наблюдался в ходе всего постреанимационного периода, в то время как у ВУ статистически значимых изменений ОМБ на базальном уровне не было выявлено вообще, а при индукции только в сроки 3-14-е сутки (рис. 1б, в, г).
Выявленные особенности свободнорадикального окисления оказали влияние на функциональность кортикостероидных рецепторов. Известно, что глюкокортикоиды через ГР печени регулируют подачу энергии при экстремальных воздействиях, увеличивая уровень глюконеогенеза [7, С. 25777]. В случае тяжелого энергодефицита печень способна отключать АТФ-потребляющие метаболические программы, в том числе глюконеогенез, посредством механизма, включающего фосфорилирование ГР с помощью MAPK p38 [8, С. 1001]. С помощью регуляции экспрессии фосфоенолпируваткарбоксикиназы 1 и глюкозо-6-фосфатазы ГР также стимулируют в печени синтез жирных кислот посредством индукции гипергликемии и гиперинсулинемии, причем оба процесса связаны с липогенезом de novo [9, С. 5]. ГР печени контролирует ряд этапов метаболизма аминокислот [10, С. 8]. Сбой механизмов быстрой адаптации к регуляторным сигналам в печени приводит к нарушениям метаболического гомеостаза, которые могут иметь далеко идущие последствия [7, С. 25777].
В группе ВУ животных наблюдалась однонаправленная динамика концентрации обоих видов рецепторов в печени и плазменного кортикостерона при сохранении соотношения ГР/МР или смещении баланса в пользу первых (рис. 2а, 3а). Такая реакция рецепторов является закономерной и адекватной: на волне повышения кортикостерона в гормональный ответ вовлекаются не только МР, имеющие высокий аффинитет к гормону, но и ГР. Это свидетельствует о сохранении в постреанимационном периоде у толерантных животных регулирующего глюкокортикоидного влияния на метаболические процессы в печени.
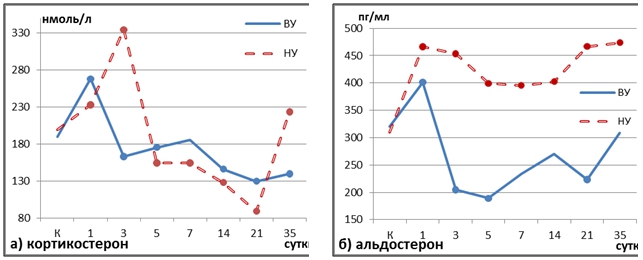
Рис. 2 – Содержание кортикостерона (а) и альдостерона (б) в плазме крови крыс в динамике постреанимационного периода в зависимости от исходной устойчивости к гипоксии
Примечание: ● – статистическая значимость различий по отношению к контролю, р≤0,05
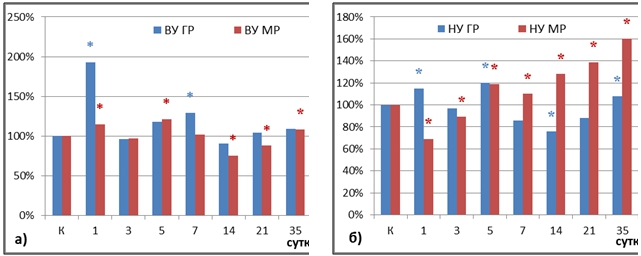
Рис. 3 – Соотношение содержания глюкокортикоидных (ГР) и минералокортикоидных (МР) рецепторов в печени крыс с высокой (а) и с низкой (б) устойчивостью к гипоксии в динамике постреанимационного периода, в % по отношению к контролю
Примечание: * – статистическая значимость различий по отношению к контролю, р≤0,05.Напротив, у низкоустойчивых крыс в период 1-3-и сутки векторы колебаний концентраций кортикостерона и его рецепторов-мишеней оказались разнонаправлены: повышение уровня гормонов сопровождалось снижением содержания ГР и МР (рис. 2а, 3б). Это позволяет сделать вывод о десенситизации кортикостероидных рецепторов в группе НУ к гипоксии животных в раннем постреанимационном периоде. Возможной причиной является окислительная деструкция белков, вызывающая повреждение рецепторов и нарушающая их функционирование. Это подтверждается результатами корреляционного анализа: статистически значимые корреляционные связи были выявлены между уровнями МР и КБ (R= -0,74) в 1-е сутки, КБ-МКО и ГР (R= -0,72), КБ-МКО и МР (R= -0,75) на 3-и сутки.
Изменение кортикостероидной рецепции в группе НУ крыс отмечалось и на 5-е сутки. В этот период уровень кортикостерона резко снижался, а содержание МР и ГР достоверно росло, что свидетельствует о дополнительной стимуляции рецепторов. Возможно, произошло включение механизма регенерации кортикостерона из его неактивных метаболитов с помощью 11β-HSD1, что отражает метаболические потребности органа [11, С.152].
Показано, что стимуляция экспрессии МР в печени вызывает провоспалительные и профибротические эффекты [12, С.399]. Установлено, что повышение уровня мРНК МР в печени достоверно коррелирует с экспрессией провоспалительных и про-фиброзных генов, а применение специфического МР-блокатора эплеренона ослабляет эти эффекты [13, С.2130].
В ходе нашего эксперимента не наблюдалось сколько-нибудь значительного повышения содержания минералокортикоидных рецепторов у высокоустойчивых к гипоксии животных. В оппозитной группе крыс отмечалось постепенное нарастание уровня МР с конца второй недели постреанимационного периода. При этом, начиная с 7-х суток исследования, содержание МР у животных с низкой устойчивостью к гипоксии отчетливо превалировало над содержанием ГР. К 35-м суткам наблюдения на фоне роста содержания плазменного кортикостерона концентрация МР в клетках печени достигла максимальных значений. Уровень циркулирующего альдостерона в этой группе животных держался на высоких цифрах в ходе всего эксперимента (рис. 2б). В период 14-35-е сутки прослеживалась сильная положительная статистически значимая корреляционная связь между уровнем альдостерона и МР. В этих условиях создаются предпосылки для пролонгирования постишемической воспалительной реакции и развития фибротических изменений со снижением специфических функций печени в отдаленной перспективе.
Таким образом, высокая активность свободнорадикального окисления, проявляющаяся развитием карбонильного стресса у НУ животных на фоне снижения активности ключевых антиоксидантов, сопряжена с более выраженными изменениями динамики кортикостероидных рецепторов. И напротив, относительно низкая интенсивность СРО у ВУ крыс, характеризующаяся только усилением липопероксидации, сопровождается сохранением, в целом, функциональности рецепторов.
Выявленные особенности динамики формирования окислительного стресса в печени ВУ и НУ животных в постреанимационном периоде могут оказать существенное влияние на биотрансформацию ксенобиотиков, в том числе и лекарственных препаратов, используемых в коррекции постгипоксических расстройств и инфекционно-воспалительных осложнений у пациентов, перенесших клиническую смерть.
Список литературы / References
- Гринев М. В. Ишемия–реперфузия – универсальный механизм патогенеза критических состояний в неотложной хирургии / М. В. Гринев, Б. Б. Бромберг // Вестник хирургии. – 2012. – Т. 171. – № 4. – С. 94–100.
- Лукьянова Л. Д. Дизрегуляция аэробного энергетического обмена – типовой патологический процесс / Л. Д. Лукьянова // Дизрегуляторная патология / под ред. Г.Н. Крыжановского. – М.: Медицина, 2002. – С. 188–215.
- Roqueta–Rivera SETDB2 links glucocorticoid to lipid metabolism through Insig2a regulation / M. Roqueta–Rivera, R. M. Esquejo, P. E. Phelan et al. // Cell Metabolism. – 2016. – Vol. 24. – № 3. – P. 474–484. doi:10.1016/j.cmet.2016.07.025.
- Способ определения степени устойчивости к гипобарической гипоксии мелких лабораторных животных: пат. 2563059 Рос. Федерация, МПК G09B 23/28 / Г. А. Байбурина, Е. А. Нургалеева, Д. З. Шибкова [и др.]. – № 20141377/14; заявл. 09.2014; опубл. 20.09.2015. Бюл. № 26.
- Корпачев В. Г. Моделирование клинической смерти и постреанимационной болезни у крыс / В. Г. Корпачев, С. П. Лысенков, Л. З. Телль // Патологическая физиология и экспериментальная терапия. – 1982. – № 3. – С. 78–80.
- Дубинина Е. Е. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение). Физиологические и клинико–биохимические аспекты / Е. Е. Дубинина. – СПб.: Медицинская пресса, 2006. – 397 с.
- Marino S. Glucocorticoid receptor beta Induces hepatic steatosis by augmenting inflammation and inhibition of the Peroxisome Proliferator–activated Receptor (PPAR) alpha / J. S. Marino, L. A. Stechschulte, D. E. Stec et al. // J. Biological Chemistry. – 2016. – Vol. 291. – № 50. – P. 25776–25788.
- Patel R. New molecular mediators of glucocorticoid receptor activity in metabolic tissues / R. Patel, J. Williams–Dautovich, L. Carolyn // Molecular Endocrinology. – 2014. – Vol. 28. – № 7– P. 999–1011. doi: 1210/me.2014–1062
- Sun Z. Dissociating fatty liver and diabetes / Z. Sun, M. A. Lazar // Trends in Endocrinology and Metabolism. – 2013. – Vol. 24. – № 1. – P. 4–12. doi: 10.1016/j.tem.2012.09.005.
- Greulich F. There goes the neighborhood: Assembly of transcriptional complexes during the regulation of metabolism and inflammation by the Glucocorticoid Receptor / F. Greulich, H. M. Charlotte, D. A. Rollins et al. // Steroids. – 2016. – Vol. 114. – P. 7–15. doi:10.1016/j.steroids.2016.05.003
- Черкасова О. П. Активность 11β–гидроксистероиддегидрогеназы в тканях крыс при хроническом гранулематозном воспалении / О. П. Черкасова, В. Г. Селятицкая, Н. А. Пальчикова // Успехи современного естествознания. – 2015. – № 5. – C. 152–155.
- Queisser Aldosterone induces fibrosis, oxidative stress and DNA damage in livers of male rats independent of blood pressure changes / N. Queisser, K. Happ, S. Link et al. // Toxicology and Applied Pharmacology. – 2014. – Vol. 280. – № 3. – P. 399–407. doi: 10.1016/j.taap.2014.08.029.
- Pizarro M. Beneficial effects of mineralocorticoid receptor blockade in experimental non–alcoholic steatohepatitis / M. Pizarro, N. Solís, P. Quintero et al. // Liver International. – 2015. – Vol. 35. – № 9. – P. 2129–38. doi: 10.1111/liv.12794.
Список литературы на английском языке / References in English
- Grinev M. V. Ishemija–reperfuzija – universal'nyj mehanizm patogeneza kriticheskih sostojanij v neotlozhnoj hirurgii [Ischemia–perfusion – a universal mechanism of pathogenesis of critical states in emergency surgery] / M. V. Grinev, B. B. Bromberg // Vestnik hirurgii [Herald of surgery]. – 2012. – Vol. 171. – № 4. – P. 94–100. [in Russian]
- Luk'janova L. D. Dizreguljacija ajerobnogo jenergeticheskogo obmena – tipovoj patologicheskij process [Disregulation of aerobic energy metabolism is a typical pathological process] / L. D. Luk'janova // Dizreguljatornaja patologija [Disregulation pathology] / Ed. G. N. Kryzhanovsky. – M.: Medicina Publishers, 2002. – P. 188–215. [in Russian]
- Roqueta–Rivera SETDB2 links glucocorticoid to lipid metabolism through Insig2a regulation / M. Roqueta–Rivera, R. M. Esquejo, P. E. Phelan et al. // Cell Metabolism. – 2016. – Vol. 24. – № 3. – P. 474–484. doi:10.1016/j.cmet.2016.07.025.
- Sposob opredelenija stepeni ustojchivosti k gipobaricheskoj gipoksii melkih laboratornyh zhivotnyh: pat. 2563059 Ros. Federacija, MPK G09B 23/28 [A method for determining the degree of resistance to hypobaric hypoxia small laboratory animals Pat. 2563059 Ros. Federation, IPC G09B 23/28] / G. A. Bajburina, E. A. Nurgaleeva, D. Z. Shibkova [i dr.]. – № 20141377/14; zajavl. 17.09.2014; opubl. 20.09.2015. Bjul. № 26. [in Russian]
- Korpachev V. G. Modelirovanie klinicheskoj smerti i postreanimacionnoj bolezni u krys [Modeling of clinical death and disease in rats postresuscitational] / V. G. Korpachev, S. P. Lysenkov, L. Z. Tell' // Patologicheskaja fiziologija i jeksperimental'naja terapija [Pathological physiology and experimental therapy]. – 1982. – № 3. – P. 78–80. [in Russian]
- Dubinina E. E. Produkty metabolizma kisloroda v funkcional'noj aktivnosti kletok (zhizn' i smert', sozidanie i razrushenie). Fiziologicheskie i kliniko–biohimicheskie aspekty [Oxygen metabolism products in the functional activity of the cells (life and death, creation and destruction). Physiological and biochemical aspects of clinical and] / E. E. Dubinina. – SPb.: izd–vo Medicinskaja pressa, 2006. – 397 P. [in Russian]
- Marino S. Glucocorticoid receptor beta Induces hepatic steatosis by augmenting inflammation and inhibition of the Peroxisome Proliferator–activated Receptor (PPAR) alpha / J. S. Marino, L. A. Stechschulte, D. E. Stec et al. // J. Biological Chemistry.– 2016. – Vol. 291. – № 50. – P. 25776–25788.
- Patel R. New molecular mediators of glucocorticoid receptor activity in metabolic tissues / R. Patel, J. Williams–Dautovich, L. Carolyn // Molecular Endocrinology. – 2014. – Vol. 28. – № 7 – P. 999–1011. doi: 1210/me.2014–1062
- Sun Z. Dissociating fatty liver and diabetes / Z. Sun, M. A. Lazar // Trends in Endocrinology and Metabolism. – 2013. – Vol. 24. – № 1. – P. 4–12. doi: 10.1016/j.tem.2012.09.005.
- Greulich F. There goes the neighborhood: Assembly of transcriptional complexes during the regulation of metabolism and inflammation by the Glucocorticoid Receptor / F. Greulich, H. M. Charlotte, D. A. Rollins et al. // Steroids. – 2016. – Vol. 114. – P. 7–15. doi:10.1016/j.steroids.2016.05.003
- Cherkasova O. P. Aktivnost' 11β–gidroksisteroiddegidrogenazy v tkanjah krys pri hronicheskom granulematoznom vospalenii / O. P. Cherkasova, V. G. Seljatickaja, N. A. Pal'chikova [11β–hydroxysteroid dehydrogenase activity in tissues of rats with chronic granulomatous inflammation] // Uspehi sovremennogo estestvoznanija [Successes of modern natural sciences]. – 2015. – № 5. – P. 152–155.
- Queisser Aldosterone induces fibrosis, oxidative stress and DNA damage in livers of male rats independent of blood pressure changes / N. Queisser, K. Happ, S. Link et al. // Toxicology and Applied Pharmacology. – 2014. – Vol. 280. – № 3. – P. 399–407. doi: 10.1016/j.taap.2014.08.029.
- Pizarro M. Beneficial effects of mineralocorticoid receptor blockade in experimental non–alcoholic steatohepatitis / M. Pizarro, N. Solís, P. Quintero et al. // Liver International. – 2015. – Vol. 35. – № 9. – P. 2129–38. doi: 10.1111/liv.12794.
