ОПТИМИЗАЦИЯ ФЕРМЕНТАЦИОННОЙ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ ШТАММА AMYCOLATOPSIS ORIENTALIS VKM AC-2717D – ПРОДУЦЕНТА АНТИБИОТИКА ЭРЕМОМИЦИНА
Попова Е.Д.1, Глаголев В.И.1, Савушкин В.А.1, Овчинников А.И.1, Савельева В.В.2, Джавахия В.В.3, Шоболов Д.Л.4, Чернобровкин М.Г.5
1Инженер, Федеральное государственное учреждение Федеральный исследовательский центр «Фундаментальные основы биотехнологии» Российской академии наук, 2Аспирант, Федеральное государственное учреждение Федеральный исследовательский центр «Фундаментальные основы биотехнологии» Российской академии наук, 3Кандидат биологических наук, Федеральное государственное учреждение Федеральный исследовательский центр «Фундаментальные основы биотехнологии» Российской академии наук, 4Кандидат фармацевтических наук, Ген. директор, ООО «Технология лекарств», 5Кандидат химических наук, Старший руководитель проектов, ООО «Технология лекарств»
ОПТИМИЗАЦИЯ ФЕРМЕНТАЦИОННОЙ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ ШТАММА AMYCOLATOPSIS ORIENTALIS VKM AC-2717D – ПРОДУЦЕНТА АНТИБИОТИКА ЭРЕМОМИЦИНА
Аннотация
Гликопептидные антибиотики применяются для лечения тяжёлых стафилококковых инфекций в случае β-лактамной лекарственной устойчивости. Повышенная распространённость резистентных штаммов к важнейшему антибиотику этой группы - ванкомицину - привела к необходимости поиска новых антибиотиков того же механизма действия. Эремомицин, являющийся продуктом биосинтеза актиномицета Amycolatopsis orientalis, был впервые выделен и охарактеризован в нашей стране.
В данном исследовании оптимальный состав питательной среды для биосинтеза эремомицина был статистически проанализирован по трём компонентам - глицерин, кукурузный экстракт и MgCl2. Исходя из полученных данных, были построены кривые поверхности отклика и определены оптимальные концентрации этих компонентов (глицерин – 72.1 г/л, кукурузный экстракт - 4.3 г/л, MgCl2 - 1.4 г/л), позволяющие увеличить выход антибиотика на 30%.
Ключевые слова: Ферментация, Amycolatopsis orientalis, гликопептидные антибиотики, эремомицин, оптимизация.Popova E.D.1, Glagolev V.I.1, Savushkin V.A.1, Ovchinnikov A.I.1, Saveleva V.V.2, Dzhavakhiya V.V.3, Shobolov D.L.4, Chernobrovkin M.G.5
1Engineer, Federal Research Centre «Fundamentals of Biotechnology», Russian Academy of Sciences, 2Postgraduate student, Federal Research Centre «Fundamentals of Biotechnology», Russian Academy of Sciences, 3PhD in Biology, Federal Research Centre «Fundamentals of Biotechnology», Russian Academy of Sciences, 4PhD in Pharmaceutics, “Tekhnologiya lekarstv” LLC, 5PhD in Chemistry, “Tekhnologiya lekarstv” LLC
OPTIMIZATION OF FERMENTATION MEDIUM FOR THE CULTIVATION OF AMYCOLATOPSIS ORIENTALIS VKM AC-2717D, A PRODUCER OF THE ANTIBIOTICS EREMOMYCIN
Abstract
Glycopeptide antibiotics are used to treat severe staphylococcal infections in the case of a β-lactam drug resistance. An increased prevalence of strains resistant to vancomycin, the most important antibiotic of this group, led to the need to find new antibiotics of the same mechanism of action. Eremomycin, which represents a biosynthetic product of Amycolatopsis orientalis, was first isolated and characterized in Russia.
In this study, the optimal composition of culture medium for the eremomycin biosynthesis was statistically analyzed by three components - glycerol, corn steep liquor and MgCl2. Based on the obtained data, the response surface curves have been built, and the optimal concentrations of these components have been determined (glycerol - 72.1 g/L, corn extract - 4.3 g/L, MgCl2 - 1.4 g/L) that resulted in the increase of the antibiotic production by 30%.
Keywords: fermentation; Amycolatopsis orientalis; glycopeptide antibiotics; eremomycin; optimization. ВведениеЭремомицин, принадлежащий к группе гликопептидных антибиотиков, был разработан в ГУ НИИ по изысканию новых антибиотиков им. Г.Ф. Гаузе РАМН (ГУ НИИНА им. Г.Ф. Гаузе РАМН) в качестве отечественного аналога распространенного антибиотика ванкомицина. Ванкомицин начали применять в клинической практике в 1958 г. для лечения стафилококковых инфекций, устойчивых к известным на тот момент антибиотикам, однако отмеченный в последние годы рост распространенности устойчивых к нему штаммов стафилококков, энтерококков и пневмококков привел к необходимости поиска новых антибиотиков того же класса, резистентность к которым у патогенных штаммов пока отсутствует.
Эремомицин проявляет бактерицидное действие в отношении большинства грам-положительных микроорганизмов, включая и ванкомицин-резистентные штаммы стафилококков, энтерококков и пневмококков. Упомянутый эффект проявляется путем ингибирования одной или двух последовательных ферментативных реакций, связанных с синтезом клеточной стенки: удлинение пептидогликана (трансгликозилирование) и его сшивка (транспептидация) [1].
Создание эффективной технологии производства антибиотика напрямую связано с повышением уровня его биосинтеза штаммом-продуцентом. Продуктивность штамма может быть увеличена несколькими способами, в том числе путем изменения состава питательной среды. Для оптимизации питательных сред в последние годы все чаще используют математический метод планирования экспериментов, что позволяет обоснованно подходить к конструированию питательных сред и делать их более экономичными, а также быстро достигать поставленной цели [2].
Целью настоящего исследования являлась оценка влияния различных концентраций источников углерода, азота и минеральных солей на биосинтез антибиотика эремомицина. В качестве исследуемых компонентов были выбраны глицерин, кукурузный экстракт и MgCl2. Каждый из параметров был предварительно протестирован в большом диапазоне концентраций, исходя из литературных данных и полученного ранее опыта [3]. Полученные после оптимизации данные были статистически проанализированы.
Материалы и методы
Продуцент эремомицина и среда для культивирования. В качестве продуцента эремомицина использовали штамм A. orientalis VKM Ac-2717D продуктивностью 2.5 г/л. Для выращивания, поддержания и хранения штамма использовали агаризованную среду следующего состава (г/л): глюкоза – 20.0, соевый пептон – 15.0, дрожжевой экстракт –1.0, агар-агар – 20.0, рН 7.0. Штамм культивировали при температуре 28°С в течение 5-7 дней.
Ферментация. Штамм выращивали на ферментативной среде в колбах объемом 50 мл, содержащих 10 мл питательной среды. С помощью микробиологической петли кусочек мицелия 4-6-дневной культуры переносили в колбы с ферментативной средой.
В проведенном ранее исследовании [3] нами было установлено, что максимальный рост и продуктивность продуцента обеспечиваются на ферментационной среде следующего состава (г/л): глицерин – 60.0, соевая мука – 20.0, MgCl2 –1.0, KH2PO4 – 0.2, KNO3 –6.0, CaCl2 –3.0, кукурузный экстракт –3.0, рН 6.8-7.0. Данная среда была взята за основу для дальнейшего проведения оптимизации. Колбы с различными вариантами сред инкубировали при температуре 28°С в течение 144-168 ч на термостатируемой качалочной установке “Inforce HT” (Дания) при 280 об/мин (эксцентриситет 2.5 см). После отбора анализируемые пробы культуральной жидкости смешивали в микропробирках с водой и метанолом в соотношении 1:2:1, далее центрифугировали при 12000 об/мин в течение 5 минут. Супернатант отбирали и содержание эремомицина определяли при помощи ВЭЖХ.
Количественное определение содержания эремомицина в культуральной жидкости. Оценку количественного содержания эремомицина в культуральной жидкости проводили методом ВЭЖХ на хроматографической системе «Agilent Technologies» [4].
Анализ проводили на колонке Luna C8(2) 100A (4мм х 125 мм, 5 мкм), 280 нм, подвижная фаза: А – раствор формиата аммония (6 г/л), доведенный аммиаком до рН 7.8-7.9; В – ацетонитрил в градиентном режиме (табл. 1).
Стандартный образец эремомицина был получен в ГУ НИИНА им. Г.Ф. Гаузе РАМН. Чистота образца составляла не менее 97%.
Таблица 1 - Таблица градиента подвижной фазы
| Время, мин | Раствор А, % | Раствор В, % | Скорость потока, мл/мин |
| 0 | 100 | 0 | 1,2 |
| 0,01 | 92 | 8 | 1,2 |
| 15 | 85 | 15 | 1,2 |
| 30 | 60 | 40 | 1,2 |
| 40 | 25 | 75 | 1,2 |
| 45 | 92 | 8 | 1,2 |
| 50 | StopTime | ||
Оптимизация состава питательной среды. Для проведения оптимизации по методу полного факторного эксперимента (ПФЭ) [5] нами были выбраны три фактора: Х1 – концентрация кукурузного экстракта; Х2 – концентрация глицерина; Х3 – концентрация MgCl2 в ферментационной среде; кроме того, был использован дополнительный нулевой фактор Х0 (Х0 = 1). Изменение этих факторов проводили на двух уровнях: нижнем (-1) и верхнем (+1). Центр плана (Z) и шаг варьирования (W) для этих факторов (см. табл. 2) был построен, исходя из литературных данных и предыдущего опыта исследования влияния этих компонентов на биосинтез эремомицина. В качестве выходного параметра оптимизации (Y) была выбрана концентрация эремомицина (г/л) в культуральной жидкости (КЖ) после проведения ферментации.
Таблица 2 – Центр плана и шаг варьирования исследуемых факторов
| Факторы | Х1 | Х2 | Х3 |
| Наименование факторов | Концентрация кукурузного экстракта | Концентрация глицерина | Концентрация MgCl2 |
| Z, г/л | 3 | 60 | 1 |
| W, г/л | 1 | 5 | 0.2 |
| -1 | 2 | 55 | 0.8 |
| +1 | 4 | 65 | 1.2 |
Количество опытов определяли по формуле: N = nk, где n – количество уровней варьирования, k – количество факторов. В нашем случае N = 8. Исходя из этого, была построена матрица планирования эксперимента для ПФЭ типа 23 (таб.3).
Таблица 3 – Матрица планирования эксперимента для ПФЭ типа 23
| № опыта | Факторы в кодированном виде | Факторы в натуральном масштабе, г/л | |||||
| Х0 | Х1 | Х2 | Х3 | Х1 | Х2 | Х3 | |
| 1 | +1 | +1 | +1 | +1 | 4 | 65 | 1.2 |
| 2 | +1 | -1 | +1 | +1 | 2 | 65 | 1.2 |
| 3 | +1 | +1 | -1 | +1 | 4 | 55 | 1.2 |
| 4 | +1 | -1 | -1 | +1 | 2 | 55 | 1.2 |
| 5 | +1 | +1 | +1 | -1 | 4 | 65 | 0.8 |
| 6 | +1 | -1 | +1 | -1 | 2 | 65 | 0.8 |
| 7 | +1 | +1 | -1 | -1 | 4 | 55 | 0.8 |
| 8 | +1 | -1 | -1 | -1 | 2 | 55 | 0.8 |
Для проверки значимости коэффициентов регрессии использовали доверительный интервал Δbi, равный Sbi*tt, где Sbi - среднеквадратичное отклонение bi, tt – табличное значение критерия Стьюдента [6]. Значимость коэффициентов оценивали, сравнивая абсолютные значения коэффициента и доверительного интервала:
если bi > ∆bi - коэффициент значим.
Для построения поверхности отклика использовали программу Matlab 7ой версии.
Результаты
В биотехнологическом процессе, основанном на использовании высокопродуктивных штаммов–продуцентов, необходимо уделять внимание не только созданию продуцента и его поддержанию, но и условиям его культивирования. Для роста продуцента требуются жизнеспособный посевной материал, источники энергии, питательные вещества и соответствующие физико-химические условия культивирования [7]. Оптимизация условий культивирования может осуществляться на основе сочетания экспериментального и математического моделирования с проведением вычислительного эксперимента, который содержит важный этап – определение математической модели, то есть, уравнения регрессии, характеризующего связь параметра оптимизации с основными факторами. Использование такой упрощенной модели позволяет достаточно быстро сделать необходимые выводы о значимости тех или иных компонентов питательной среды, а также качественном и количественном ее составе [8].
В данной работе был проведен эксперимент по оптимизации состава среды с использованием метода крутого восхождения, совмещающего в себе планирование эксперимента (ПФЭ) с методом движения по градиенту (метод Уилсона-Бокса). В проведённых нами ранее экспериментах был определён основной компонентный состав ферментационной среды, позволивший увеличить продуктивность штамма A. orientalis VKM Ac-2717D до 2.5 г/л эремомицина в КЖ. Предварительные результаты показали, что на уровень биосинтеза эремомицина продуцентом наибольшее влияние оказывают три компонента питательной среды: кукурузный экстракт, глицерин и MgCl2.
На первом этапе работы по построенной нами матрице планирования эксперимента была поставлена серия опытов, каждый опыт проводился в трёх повторностях. Результаты данных опытов представлены в таблице 4.
Таблица 4 – Результаты эксперимента (значения выходного параметра)
| № опыта | Yuk1* | Yuk2 | Yuk3 | Yu** |
| 1 | 2.90 | 2.87 | 2.84 | 2.87 |
| 2 | 2.74 | 2.70 | 2.66 | 2.70 |
| 3 | 2.48 | 2.52 | 2.56 | 2.52 |
| 4 | 2.14 | 2.19 | 2.24 | 2.19 |
| 5 | 2.50 | 2.47 | 2.44 | 2.47 |
| 6 | 2.60 | 2.55 | 2.50 | 2.55 |
| 7 | 2.10 | 2.05 | 2.00 | 2.05 |
| 8 | 2.23 | 2.18 | 2.13 | 2.18 |
* Yuk – численное значение функции отклика каждой из повторностей, полученное после проведения эксперимента, г/л;
** Yu – среднеарифметическое значение функции отклика, г/л.
Коэффициенты уравнения регрессии определяли по методу наименьших квадратов [9].
Полином первой степени при проведении планирования эксперимента ПФЭ 23 имел вид Y = 2.44+ 0.04Х1 + 0.21Х2 + 0.13Х3.
Однородность и воспроизводимость эксперимента оценивали по критерию Кохрена [9]. Для полученных нами данных Gp=0.17, что меньше критерия Кохрена для наших степеней свободы. Исходя из этого, нами был сделан вывод об однородности и воспроизводимости поставленного эксперимента. Рассчитанная ошибка опыта составила 0.0019. Проверка значимости коэффициентов регрессии показала, что все коэффициенты являются значимыми.
Проверка адекватности по критерию Фишера [10] полинома первого порядка показала, что полученное нами уравнение является неадекватным, т.е. оно не в полной мере описывает исследуемый нами процесс. Исходя из этого, нами было принято решение о построении новой матрицы планирования эксперимента, учитывающей взаимное влияние факторов друг на друга, и рассчитаны новые коэффициенты регрессии.
Полученное уравнение регрессии имело следующий вид:
Y= 2.44+0.04Х1+ 0.21Х2+ 0.13Х3 – 0.01Х1Х2 + 0.09Х1Х3+ 0.01Х2Х3 – 0.03Х1Х2Х3
Исходя из рассчитанного доверительного интервала, равного 0.036, значимыми являются коэффициенты b1, b2, b3 и b5 и их следует включить в модель, а коэффициенты b4, b6, b7 незначимы и их следует отбросить, не включая в искомую модель. На основании полученных данных математическая модель (уравнение регрессии), включающая только значимые коэффициенты, выглядит следующим образом:
Y= 2.44+0.04Х1+ 0.21Х2+ 0.13Х3 + 0.09Х1Х3
Построение кривых поверхности отклика показало, что каждый из выбранных нами факторов в той или иной степени влияет на биосинтез эремомицина и, следовательно, является значимым. Кривые поверхности отклика представлены на рисунке 1.
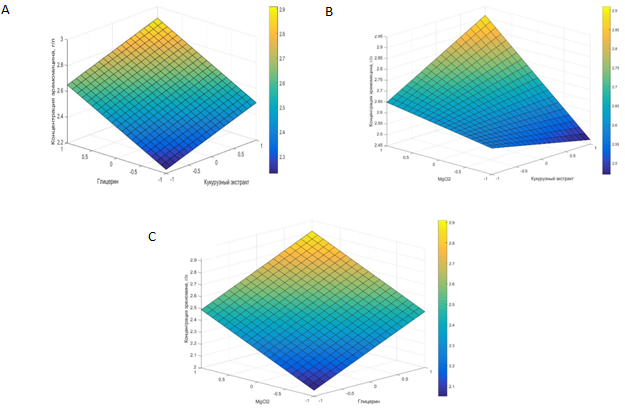
Рис.1 – Кривые поверхности отклика, показывающие влияние каждого фактора на биосинтез антибиотика эремомицина (А-Х1=1; В-Х2=1; С-Х3=1)
Проверка адекватности показала, что полученное нами уравнение является адекватным. На основании результатов проведенного ПФЭ можно предположить, что для дальнейшей оптимизации среды применение метода крутого восхождения будет эффективным, так как полученная линейная модель адекватна и не является резко асимметричной относительно коэффициентов [11].
Величину шага движения по градиенту концентраций факторов в ферментационной среде рассчитывали по стандартной методике [5], исходя из полученных значений коэффициентов регрессии.
![]() ,
,
где, а – наименьший коэффициент регрессии; bi – коэффициент регрессии i-го фактора; b – новый рассчитанный коэффициент регрессии.
Далее была построена новая матрица реализации эксперимента (таб.5), исходя из нового шага варьирования (Wi), рассчитанного по новым коэффициентам регрессии по формуле:
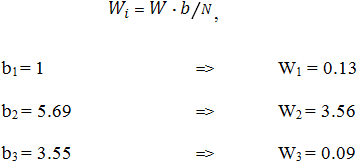
Таблица 5 – Матрица реализации факторного эксперимента по методу крутого восхождения
| № опыта | Факторы | Yu, г/л | ||
| Х1 | Х2 | Х3 | ||
| 1 | 4.00 | 65.00 | 1.20 | 2.87±0.05 |
| 2 | 4.13 | 68.56 | 1.29 | 2.90±0.03 |
| 3 | 4.25 | 72.11 | 1.38 | 3.26±0.05 |
| 4 | 4.38 | 75.67 | 1.47 | 3.14±0.04 |
| 5 | 4.50 | 79.22 | 1.56 | 2.82±0.02 |
| 6 | 4.63 | 82.78 | 1.64 | 1.98±0.03 |
| 7 | 4.75 | 86.34 | 1.73 | 1.43±0.05 |
| 8 | 4.88 | 89.89 | 1.82 | 1.20±0.01 |
| 9 | 5.00 | 93.45 | 1.91 | 0.97±0.03 |
| 10 | 5.13 | 97.00 | 2.00 | 0.56±0.06 |
| 11 | 5.25 | 100.56 | 2.09 | 0.05±0.02 |
На основании проведенных исследований можно заключить, что метод крутого восхождения в данном случае оказался эффективным, так как по сравнению с результатом, полученным для ПФЭ 23 (2.87 ± 0.03 г/л), продуктивность штамма в опыте № 3 увеличилась примерно на 15% (3.26 ± 0.05 г/л). Таким образом, в результате эксперимента, проведенного по плану «крутого восхождения», была разработана оптимизированная ферментационная среда следующего состава (г/л): глицерин – 72.1, соевая мука – 20.0, MgCl2 – 1.4, KH2PO4 – 0.2, KNO3 –6.0, CaCl2 –3.0, кукурузный экстракт – 4.3. На данной среде продуктивность штамма VKM Ac-2717D достигала 3.26±0.05 г/л, что более чем на 30% превысило среднюю продуктивность на исходной среде (2.5 г/л).
Обсуждение
В нашем исследовании мы сосредоточились на оптимизации состава ферментационной среды для культивирования штамма A. orientalis VKM Ac-2717D с помощью метода полного факторного эксперимента. Подход позволил определить оптимальный состав ферментационной среды, при котором наблюдается наивысшая продуктивность данного штамма.
Состав среды для культивирования является одним из важных параметров, влияющих на конечную продуктивность штамма. Варьирование концентрацией каждого из компонентов среды может позволить значительно увеличить удельную продуктивность штамма без особых экономических затрат.
Реализация опытов, рассчитанных на стадии крутого восхождения, обеспечила увеличение значения продуктивности штамма VKM Ac-2717D (3.26 ± 0.04 г/л) на 30% по сравнению с продуктивностью, полученной на исходной ферментационной среде (2.5 г/л).
С экономической точки зрения увеличение продуктивности штамма на 30%, при незначительном увеличении стоимости питательной среды, позволило уменьшить себестоимость 1 кг субстанции антибиотика на 400 рублей. Это в свою очередь доказывает рентабельность проведённой нами работы по оптимизации состава питательной среды.
Список литературы / References
- Nagarajan R. Antibacterial activities and modes of action of vancomycin and related glycopeptides/ R. Nagarajan// Antimicrob Agents Chemother. – 1991. - Apr;35(4). – P. 605-609.
- Арзамасцев А. А. Математические модели кинетики микробного синтеза: возможности использования и новые подходы к разработке/ А. А. Арзамасцев, А. А. Андреев – Вестн. Тамбов. ун-та. Серия: Естеств. и техн. науки. – Т. 5, №1, – 111–130 c.
- Попова Е. Д. Разработка высокоактивного штамма-продуцента антибиотика эремомицина методом индуцированного ненаправленного мутагенеза/ Е. Д. Попова, В. И. Глаголев, В. А. Савушкин, А. И. Овчинников, В. В. Джавахия // III Международная конференция молодых учёных: биотехнологов, молекулярных биологов и вирусологов – Сб. тез., 2016. – С. 72-75.
- Kysilka R. Determination of lovastatin (mevinolin) and mevinolinic acid in fermentation liquids / R. Kysilka, V. J. Kren // Chromatography. – – V.630. – Р. 415-417.
- Адлер Ю.П. Планирование эксперимента при поиске оптимальных условий/ Ю.П. Адлер, Е.В.Маркова, Ю.В.Грановский – М.Наука, 1976. – 280 c.
- Афанасьев В.В. Теория вероятностей в вопросах и задачах/ В.В. Афанасьев – М.: 2007. – 350 c.
- Перт С. Д. Основы культивирования микроорганизмов и клеток/ С.Д. Перт – М.: Мир, 1978. – 331 с.
- Жерносекова И.В Методы планирования экспериментов при оптимизации питательной среды для стрептомицета/ И.В Жерносекова, Н. П. Черногор, А.А. Тымчук, А. И. Виннико// Visnyk of Dnipropetrovsk University. Biology. Ecology. – 2001. – Vol. 18. N 1 – 20=–28.
- Гайдадин А.Н. Применение полного факторного эксперимента при проведении исследований: метод. указания / А.Н. Гайдадин, С.А.Ефремова – ВолгГТУ. Волгоград, 2008. – 16 c.
- Бондарь А.Г.Математическое моделирование в химической технологии/ А.Г. Бондарь – «Вища школа», – 280 c.
- Налимов В.В. Логические основания планирования эксперимента / В. В. Налимов, Т. И. Голикова. - М.: Металлургия, 1981. – 155 c.
Список литературы на английском языке / References in English
- Nagarajan R. Antibacterial activities and modes of action of vancomycin and related glycopeptides/ R. Nagarajan// Antimicrob Agents Chemother. – 1991. - Apr;35(4). – P. 605-609.
- Arzamastsev A.A. Matematicheskiye modeli kinetiki mikrobnogo sinteza: vozmozhnosti ispolzovaniya i novye podhody k razrabotke [Mathematical models of kinetics of the microbial synthesis: application and new approaches to the development] / Arzamastsev A.A., Andreev A.A. // Vestnik Tambovskogo universiteta. Seriya: Estestvennye i tekhnicheskiye nauki. [Bulletin of Tambov university. Series: natural and technical sciences] – V. 5, No 1, 2000. – P. 111–130. [In Russian]
- Popova E.D. Razrabotka vysokoaktivnogo shtamma-produtsenta antibiotika eremomitsina metodom indutsirovannogo napravlenogo mutageneza [Development of highly producing strain of antibiotic-induced ehremomitcin by undirected mutagenesis] / E.D. Popova, V.I. Glagoliev, V.A. Savushkin, A.I. Ovchinnikov, V.V. Dzhavakhiya // III Mezhdunarodnaya konferentsiya molodykh uchenykh: biotekhnologov, molekuliarnykh biologov i virusologov – sb. tez [III International Conference of young scientists: biotechnologists, molecular biologists and virologists – Bulletin], 2016. – P.72–75. [In Russian]
- Kysilka R. Determination of lovastatin (mevinolin) and mevinolinic acid in fermentation liquids / R. Kysilka, V. J. Kren // Chromatography. – – V.630. – Р. 415–417.
- Adler Y.P. Planirovaniye eksperimenta pri poiske optimalnykh usloviy [Planning of Experiment in Search for Optimum Conditions] / Y.P. Adler, E.V. Markova, Yu.V. Granovsky – M. Nauka, 1976. – 280 p. [In Russian]
- Afanasiev V.V. Teoriya veroyatnostey v voprosakh i zadachakh [Probability theory in questions and problems] / V.V. Afanasiev – M.: 2007. – 350 p. [In Russian]
- Pert S.D. Osnovy kultivirovaniya mikroorganizmov i kletok [Basic cultivation of microorganisms and cells] / S.D. Pert – M.: Mir, 1978. – 331 p. [In Russian]
- Zhernosekova I.V. Metody planirovaniya eksperimentov pri optimizatsii pitatelnoy sredy dlia streptomitseta [Methods of Experiment Planning in the Optimization of the Culture Medium for Streptomyces] / I.V. Zhernosekova, N.P. Chernogor, A.A. Tymchuk, A.I. Vinnik // Bulletin of Dnipropetrovsk University. Ecology [Visnyk of Dnipropetrovsk University. Biology. Ecology.] – 2001. – Vol. 18. No 1 – P. 20–28. [In Russian]
- Gaydadin A.N. Primeneniye polnogo faktornogo eksperimenta pri provedenii issledovaniy: metod. ukazaniya [The Use of Full Factorial Experiment in Research: Method. Instructions] / A.N. Gaydadin, S.A. Efremova // - VSTU. Volgograd, 2008. – 16 p. [In Russian]
- Bondar A.G. Matematicheskoye modelirovaniye v khimecheskoy tekhnologii [Mathematical modeling in chemical technology] / A.G. Bondar – "Vishcha Shkola", 1973. – 280 p. [In Russian]
- Nalimov V.V. Logicheskiye osnovaniya planirovaniya eksperimenta [Logical planning of the experiment base] / V.V. Nalimov, T.I. Golikova. - M.: Metallurgy, 1981. – 155 p. [In Russian]
