ОПРЕДЕЛЕНИЕ КАЧЕСТВЕННОГО СОСТАВА КРАПИВЫ ДВУДОМНОЙ (URTICA DIOICA L.) МЕТОДОМ ТСХ
Великая Т.В.1, Кожанова К.К.2, Жетерова С.К.3, Дрегерт O.4
1 Магистрант 2-го года обучения; 2-3 кандидат фармацевтических наук, доцент; 4 Инженер; 1-3 Казахский Национальный медицинский университет им. С.Д. Асфендиярова (Алматы, Казахстан); 4 Технологический институт Карлсруэ, Институт технической химии (Карлсруэ, Германия)
ОПРЕДЕЛЕНИЕ КАЧЕСТВЕННОГО СОСТАВА КРАПИВЫ ДВУДОМНОЙ (URTICA DIOICA L.) МЕТОДОМ ТСХ
Аннотация
В статье приводятся методика качественного изучения ЛРС крапивы двудомной (Urtica dioica L.) методом тонкослойной хроматографии с использованием высокоэффективных пластинок
Ключевые слова: исследование, тонкослойная хроматография, крапива двудомная (Urtica dioica L.)
Velikaya T.V. 1, Kozhanova K.K. 2, Zheterova S.K. 3, Dregert O. 4
1 Undergraduate; 2-3 PhD in Pharmaceutics, Associate Professor, 4 dipl.-ing.(HF); 1-3 Asfendiyarov Kazakh National Medical University (Almaty, Kazakhstan); 4 Karlsruher Institute of Technology, Institute for Technical Chemistry (Karlsruhe, Germany)
TO DETERMINE THE QIALITATIVE COMPOSITION OF THE URTICA DIOICA L. BY THIN-LAYER CHROMATOGRAPHY
Abstract
The article presents method of qualitative study of medicinal plant Urtica dioica L. by thin-layer chromatography with the use of high-performance records
Keywords: research, thin-layer chromatography, Urtica dioica L.
Хлорофиллы, также как и каротиноиды, не растворимы в воде, но хорошо растворимы в органических растворителях.
Для экстрагирования пигментов из сухого материала высушенные листья крапивы (навеска 1,1015г) помещали в круглодонную колбу на 100мл, ошпаривали кипятком для лучшего извлечения пигментов, затем воду сливали, приливали 50мл ацетона и экстрагировали в течении 20мин на кипящей водяной бане с обратным холодильником. Затем содержимое колбы охлаждали и осторожно сливали экстракт в мерную колбу на 250мл. Экстракцию небольшими порциями растворителя повторяли до тех пор, пока пигменты не были извлечены полностью. Содержимое колбы доводили ацетоном до метки и использовали для определения концентрации пигментов - раствор А.
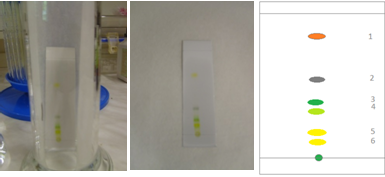
Качественный состав экстракта крапивы определяли методом тонкослойной хроматографии (ТСХ) с использованием высокоэффективных пластинок TLC Silicagel 60 F254 ,Aluminium sheet 5x10cm (Merck KGaA, Germany).
В методе ТСХ неподвижная твердая фаза тонким слоем нанесена на алюминиевую пластинку. В 1 см от края пластинки на стартовую линию наносят пробу анализируемой жидкости и край пластинки погружают в растворитель. Под действием капиллярных сил растворитель движется вдоль слоя сорбента и с разной скоростью переносит компоненты смеси, что приводит к их разделению.
Высушенная пластинка является хроматограммой исследуемых веществ.
Для хлорофилла и каротинидов использовали систему растворителей "Гексан – изопропиловый спирт – водный раствор Na2CO3" (50:5:0,25).
В результате хроматографирования в этой системе в экстракте крапивы визуальным методом по окраске пятен были идентифицированы наблюдаемые пятна пигментов на хроматограмме – хлорофиллов, феофитина (продукт деградации хлорофиллов) и каротиноидов, которые были идентифицированы по окраске:
- хлорофилл а – сине-зеленое пятно, Rf =0,203
- хлорофилл б – желто-зеленое пятно, Rf =0,171
- феофитин – серое пятно, Rf = 0,304
- ß-каротин – темно-желтое пятно с Rf =0,696
Также на хроматограмме экстракта крапивы наблюдаются дополнительные пятна желтого цвета, которые по месту расположения можно отнести к ксантофилам (Rf0,114; 0,094) (рис.1).
Рис.1 Хроматограмма растительных пигментов крапивы: 1 –β-каротин, 2 – феофитин, 3 – хлорофилл а, 4 – хлорофилл b, 5,6 –ксантофиллы.
Определение концентрации пигментов без их предварительного разделения проводился на спектрофотометре UV mini-1240 Shimadzu (Япония) при длинах волн: для ацетона – 662, 644, 440 нм.
 |
Спектральный диапозон – 190,0 – 1100,0 нм Спектральная ширина щели – 5 нм Оптическая схема – однолучевая Детектор – кремниевый фотодиод |
Концентрация пигментов (С) в мг/л вычислялась по формулам:
для 100 % ацетона (по Хольму-Веттштейну):
Схл.а= 9,784 ∙ D662 – 0,990 ∙ D644,
Схл.b= 21,426 ∙ D644 – 4,650 ∙ D662,
Cхл.a+хл.b=5,134∙ D662+ 20,436∙ D644
Скaр= 4,695 ∙ D440 – 0,268 ∙ Схл.а+хл.b
Где Схл.а, Схл.b, Cхл.a+хл.b и Скaр– соответственно концентрации хлорофиллов а и b, их суммы и каротиноидов в мг/л;
D– экспериментально полученные величины оптической плотности при соответствующих длинах волн (при толщине слоя 1 см).
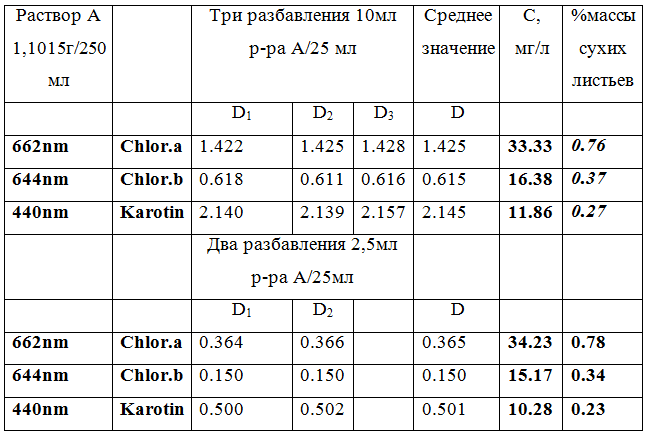
Результат количественного анализа концентраций хлорофиллов и каротиноидов в экстракте крапивы представлены в таблице 1.
Табл.1 Определение концентрации хлорофиллов и каротиноидов
Из полученных результатов можно сделать вывод, что содержание хлорофилла в сухих листьях крапивы составляет в среднем 1,1%, при этом хлорофилла а - 67-69%, хлорофилла b - 30-32%.
Каротиноидов в листьях примерно в три раза меньше, чем хлорофилла.
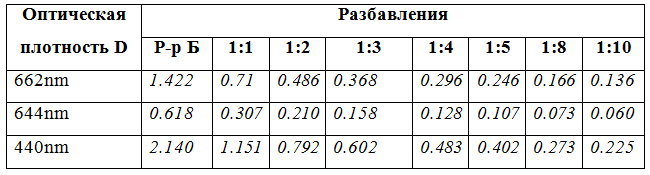
Также был определен спектр поглощения хлорофилла. Для наблюдения спектров поглощения растворов с разной концентрацией хлорофилла разбавили раствор Б (10мл раствора А/25мл) ацетоном в отношениях 1:1, 1:2, 1:3, 1:4, 1:5, 1:8 и 1:10 и исследовали оптические свойства полученных растворов. Результаты данного опыта занесены в Таблицу 2.
Tабл.2
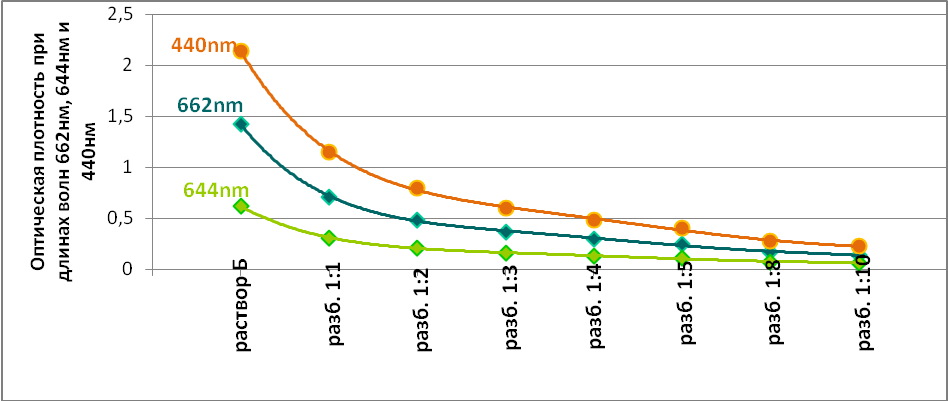
Также построен график зависимости спектра поглощения хлорофилла от концентрации его раствора (Рис.2)
Рис.2 График зависимости спектра поглощения хлорофилла от концентрации его раствора.
Сравнивая спектры поглощения растворов пигментов разной концентрации, можно определить степень поглощения отдельных лучей видимого спектра: чем слабее поглощается данный участок спектра, тем концентрированнее нужно взять раствор пигмента.
Наиболее сильно поглощаемые лучи можно узнать по темным полосам в спектре поглощения очень разбавленного раствора, тогда как наименее поглощаемые лучи проходят даже через довольно концентрированный раствор, это значит, что спектр поглощения хлорофилла экспоненциально уменьшается в зависимости от длины оптического пути и концентрации вещества в образце.
Литература
- Годнев Т.Н. Хлорофилл. Его строение и образование в растении. - Минск: 1963. - 319 с.
- Павлов В.Ю., Пономарев Г.В. Пути модификации переферических заместителей хлорофиллов а и b и их производных // Химия гетероциклических соединений. - 2004. - №4. - С. 483-519.
References
- Godnev T.N. Hlorofill. Ego stroenie i obrazovanie v rastenii. - Minsk: 1963. - 319 p.
- Pavlov V.Ju., Ponomarev G.V. Puti modifikacii perefericheskih zamestitelej hlorofillov a i b i ih proizvodnyh // Himija geterociklicheskih soedinenij. - 2004. - №4. - P. 483-519