ИЗУЧЕНИЕ ПОТЕНЦИАЛЬНОЙ РОЛИ КРИОКОНСЕРВИРОВАННЫХ МЕЗЕХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК ПЛАЦЕНТЫ В ИНГИБИРОВАНИИ НЕЙРОДЕГЕНЕРАТИВНЫХ ИЗМЕНЕНИЙ СЕТЧАТКИ ПРИ СТРЕПТОЗОТОЦИНОВОМ ДИАБЕТЕ 2 ТИПА ПО ДИНАМИКЕ ИЗМЕНЕНИЙ VEGF И BDNF
Демин Ю.А.1, Демина М.Ю.2, Сергиенко А.Н.3
1 профессор, доктор медицинских наук, Харьковская Медицинская Академия Последипломного Обучения, 2 аспирант, магистр медицины, Харьковская Медицинская Академия Последипломного Обучения, 3 профессор, доктор медицинских наук, медицинский центр «Офтальмологическая клиника профессора Сергиенко»
ИЗУЧЕНИЕ ПОТЕНЦИАЛЬНОЙ РОЛИ КРИОКОНСЕРВИРОВАННЫХ МЕЗЕХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК ПЛАЦЕНТЫ В ИНГИБИРОВАНИИ НЕЙРОДЕГЕНЕРАТИВНЫХ ИЗМЕНЕНИЙ СЕТЧАТКИ ПРИ СТРЕПТОЗОТОЦИНОВОМ ДИАБЕТЕ 2 ТИПА ПО ДИНАМИКЕ ИЗМЕНЕНИЙ VEGF И BDNF
Аннотация
В современной офтальмологии возрастает интерес к использованию стромальных клеток для лечения заболеваний сетчатки [1]. В этом исследовании мы использовали криоконсервированные мезенхимальные стромальные клетки плаценты (кМСКП), так как плацента [2], содержит достаточное количество стромальных клеток. Также привлекательным является отсутствие этических проблем, поскольку плацента является побочным продуктом при нормальных родах [3].
Ключевые слова: диабетическая ретинопатия, криоконсервированные мезенхимальные стромальные клетки плаценты, VEGF, BDNF.
Demin Yu.A.1, Demina M.Yu.2, Sergienko A.N.3
1 professor, MD, Kharkov Medical Academy of Postgraduate Education, 2 postgraduate student, master of medicine, Kharkov Medical Academy of Postgraduate Education, 3 professor, MD, Medical center “Professor`s Sergienko Eye Clinic”
STUDY OF POTENTIAL ROLE OF CRYOPRESERVED PLACENTAL MESENCHYMAL STROMAL CELLS IN INHIBITING O RETINAL NEURODEGENERATION CHANGES IN STREPTOZOTOCIN TYPE 2 DIABETES ON DYNAMICS OF VEGF AND BDNF PARAMETERS
Abstract
In current ophthalmology an interest to application of stromal cells to treat retinal diseases has increased[1]. In this research we used placental stromal cells because the placenta [2] comprises a sufficient number of stromal cells. The absence of ethical problems is also attractive because placenta is the side product at normal delivery [3].
Keywords: diabetic retinopathy, cryopreserved placental mesenchymal stromal cells, VEGF, BDNF
Актуальность темы. Использование кМСКП для регенерации ретинальных клеток является одним из наиболее перспективных методов терапии заболеваний сетчатки. С прогрессом в изучении клеточных технологий кМСКП рассматриваются как перспективный источник замены клеток и нейропротекции. Некоторые факторы роста, участвующие в развитии клеток сетчатки могут иметь важное значение для дифференцировки МСК в клетки сетчатки. Эти молекулы включают в себя нейротрофический фактор головного мозга (BDNF) и антиангиогенные нейротрофические факторы [4].
Цель данного исследования изучить динамику изменения BDNF и VEGF в сетчатке после трансплантации кМСКП крысам в лечении экспериментального стрептозотоцининдуцированного сахарного диабета 2 типа.
Материалы и методы. Молекулярнобиологические исследования проводилось в лаборатории Банка пуповинной крови, других тканей и клеток человека, г. Киев. Уровень экспрессии генов VEGF и BDNF определяли в образцах сетчатки глаз опытных животных.
Исследования проводили на модели сахарного диабета (СД) 2 типа, индуцированном стрептозотоцином и высококалорийной диетой, на половозрелых самцах лабораторных крыс линии Вистар [5]. Все манипуляции с животными проводились соответственно с положениями «Европейской конвенции о защите позвоночных животных, используемых для экспериметальных и научных целей» (Страсбург, 1986) и постановления IV Национального конгресса по биоэтике (Киев,2010).
Через семь дней после последней инъекции стрептозотоцина всех экспериментальных животных разделили на группы: контрольная, здоровые животные, получающие кМСКП (Н+кМСКП), животные с СД, получающие кМСКП (Д+кМСКП) и животные с СД получающие плацебо (Д+плацебо).
КМСКП вводили в/в в концентрации 1,1х106 и интравитреально в концентрации 0,1х106 здоровым животным и крысам с СД 2 типа, индуцированным высококалорийной диетой и стрептозотоцином.
Крысы группы «Д+плацебо» получали плацебо соответствующего объема по аналогичной схеме.
Криоконсевирование МСКП проводили соответственно с разработанной и запатентованой технологией [6].
Для определения уровня экспрессии генов VEGF и BDNF в препаратах сетчатки глаз крыс проводилось ПЦР в реальном времени (RT-PCR) [6].
Статистическую обработку полученных данных выполняли при помощи программы SPSS 21 для Windows XP, используя методы первичной описательной статистики, t-критерий Стьюдента. Проверка на нормальность проводилась по критерию согласия Колмогорова - Смирнова.
Изучаемые признаки имели нормальное распределение в группах, поэтому в работе данные представлены в виде M±m, где М – среднее (Mean), m – стандартная ошибка (SD).
Результаты. ПЦР в режиме реального времени показала значительный уровень экспрессии нейротрофических факторов в сетчатке крыс.
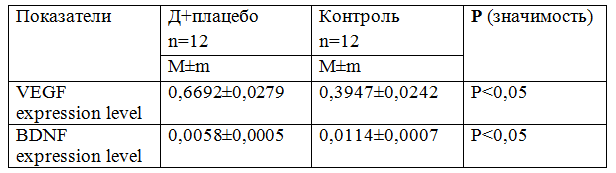
При этом, в группе Д+плацебо наблюдается увеличение уровня экспрессии VEGF до 0,6692±0,0279 по сравнению с контрольной группой 0,3947±0,0242 (P<0,05).
В группе Д+плацебо наблюдается снижение уровня BDNF до 0,0058±0,0005, тогда как в контрольной группе он составляет 0,0114±0,0007. Это различие было статистически достоверным P<0,05 (табл.1).
Таблица 1 - Показатели уровня экспрессии VEGF и BDNF у животных в группе Д+плацебо и контрольной группы.
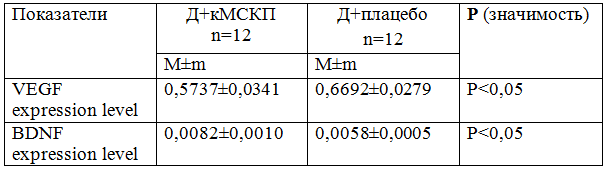
Качественный и количественный анализ показал, что наибольшие пики концентрации были достигнуты нейротрофическим фактором мозга у крыс с трансплантированными стромальными клетками по сравнению с диабетическими крысами (табл.2).
Таблица 2 - Показатели уровня экспрессии VEGF и BDNF у животных в группах Д+кМСКП и Д+плацебо.
В группе Д+плацебо уровень экспрессии VEGF достигал 0,6692±0,0279, при введении кМСКП показатели уровня экспрессии VEGF в группе Д+кМСКП снижался до 0,5737±0,0341. Это различие было статистически значимым P<0,05. Значительное уменьшение уровня экспрессии VEGF в группе Д+кМСКП по сравнению с группой Д+ плацебо свидетельствует о возможном антиангиогенном эффекте препарата кМСКП при экспериментальной модели СД.
Значительно более высокий уровень BDNF наблюдался в сетчатке крыс группы Д+кМСКП по сравнению с группой Д+плацебо. Уровень экспрессии BDNF в группе Д+кМСКП достиг 0,0082±0,0010 , тогда как уровень экспрессии BDNF в группе Д+плацебо была 0,0058±0,0005 (P<0,05).
Увеличение уровня BDNF у крыс с пересаженными кМСКП подчеркивает возможный высокий потенциал нейропротекторного действия, что согласуется с данными [7].
Таким образом, кМСКП обладают нейропротекторным и ангиогенным действием, что способствует восстановлению сетчатки.
Обсуждение результатов. Нами предложен алгоритм использования кМСКП in vivo при ДР, который основывается на двух подходах: внутривенное и интравитреальное введение. Нейротрофический фактор BDNF может быть вовлечен в восстановление ретинальных клеток при ДР [9].
Интравитреальное введение кМСКП обеспечивает высокий уровень нейротрофинов, которые могут проникнуть в сетчатку. Кроме того, интравитреальная трансплантация кМСКП может минимизировать повреждение сетчатки [8].
Нейротрофины, выделяющиеся из кМСКП обеспечивают регресс нейродегенеративных изменений сетчатки при стрептозотоцининдуцированном СД 2 типа.
Интравитреальная инъекция кМСКП с экспрессией BDNF может предотвратить повреждение и гибель ганглиозных клеток в течение 21 суток.
Системное введение кМСКП приводило к благотворному эффекту для фоторецепторов и предотвращению патологического роста сосудов сетчатки, что согласуется с данными литературы [6] .
Выводы. КМСКП являются перспективным препаратом для нейропротекции при экспериментальной ДР поскольку они продуцируют нейротрофические и антиангиогенные факторы, полезные для выживания клеток сетчатки и способствуют антиангиогенному эффекту, предотвращая развитие ДР.
Литература
- Joe AW, Gregory-Evans K. Mesenchymal stem cells and potential applications in treating ocular disease.Curr Eye Res. 2010;35(11):941–952.
- Tsagias N, Koliakos I, Lappa M, et al. Placenta perfusion has hematopoietic and mesenchymal progenitor stem cell potential. 2011 Mar 7.
- Abdulrazzak H, Moschidou D, Jones G, et al. Biological characteristics of stem cells from foetal, cord blood and extraembryonic tissues.J R Soc Interface. 2010;7(Suppl 6):S689–S706.
- Hicks D, Courtois Y. Fibroblast growth factor stimulates photoreceptor differentiation in vitro.J Neurosci. 1992;12:2022–2033.
- Preventive effect of taurine on experimental type II diabetic nephropathy [Text] / S. Lin, J. Yang, G. Wu [et al.] // J. Of Biomedical Science. – 2010. – Vol. 17, Suppl. – P. 46 –56.
- Лобинцева Г.С. Патент (11) 46673 А, Україна, Спосіб консервування гемопоетичних клітин людини. - Бюл. №5 15.05.2002
- Mahdy RA, Nada WM, Hadhoud KM, et al. The role of vascular endothelial growth factor in the progression of diabetic vascular complications.Eye (Lond) 2010;24(10):1576–1584.
- Nemeth K, Keane-Myers A, Brown JM, Metcalfe DD, Gorham JD, Bundoc VG, Hodges MG, Jelinek I, Madala S, Karpati S, Mezey E. Bone marrow stromal cells use TGF-beta to suppress allergic responses in a mouse model of ragweed-induced asthma.Proc Natl Acad Sci USA. 2010;107:5652–5657.
- Yu S, Tanabe T, Dezawa M, Ishikawa H, Yoshimura N. Effects of bone marrow stromal cell injection in an experimental glaucoma model.Biochem Biophys Res Commun. 2006;344:1071–1079.
References
- Joe AW, Gregory-Evans K. Mesenchymal stem cells and potential applications in treating ocular disease. Curr Eye Res. 2010;35(11):941–952.
- Tsagias N, Koliakos I, Lappa M, et al. Placenta perfusion has hematopoietic and mesenchymal progenitor stem cell potential. Transfusion. 2011 Mar 7.
- Abdulrazzak H, Moschidou D, Jones G, et al. Biological characteristics of stem cells from foetal, cord blood and extraembryonic tissues. J R Soc Interface. 2010;7(Suppl 6):S689–S706.
- Hicks D, Courtois Y. Fibroblast growth factor stimulates photoreceptor differentiation in vitro. J Neurosci. 1992;12:2022–2033.
- Preventive effect of taurine on experimental type II diabetic nephropathy [Text] / S. Lin, J. Yang, G. Wu [et al.] // J. Of Biomedical Science. – 2010. – Vol. 17, Suppl. 1. – P. 46 –56.
- Lobinceva G.S. Patent (11) 46673 A, Ukraїna, Sposіb konservuvannja gemopoetichnih klіtin ljudini. - Bjul. №5 15.05.2002
- Mahdy RA, Nada WM, Hadhoud KM, et al. The role of vascular endothelial growth factor in the progression of diabetic vascular complications. Eye (Lond) 2010;24(10):1576–1584.
- Nemeth K, Keane-Myers A, Brown JM, Metcalfe DD, Gorham JD, Bundoc VG, Hodges MG, Jelinek I, Madala S, Karpati S, Mezey E. Bone marrow stromal cells use TGF-beta to suppress allergic responses in a mouse model of ragweed-induced asthma. Proc Natl Acad Sci USA. 2010;107:5652–5657.
- Yu S, Tanabe T, Dezawa M, Ishikawa H, Yoshimura N. Effects of bone marrow stromal cell injection in an experimental glaucoma model. Biochem Biophys Res Commun. 2006;344:1071–1079.