Анализ результатов микробиологической идентификации грибов рода Candida в многопрофильном стационаре
Анализ результатов микробиологической идентификации грибов рода Candida в многопрофильном стационаре
Аннотация
Инвазивные инфекции, вызванные видами рода Candida, остаются одной из ключевых проблем стационарной помощи и ассоциированы с высокой летальностью у пациентов отделений реанимации и интенсивной терапии. Цель исследования — проанализировать результаты микробиологической идентификации грибов рода Candida spp. в многопрофильном стационаре Приморского края в течение 7-летнего периода (2018–2025 гг.), оценить видовой состав, источники клинического материала и сопоставить показатели с региональными данными AMRcloud. Проведен ретроспективный анализ результатов микробиологического мониторинга в Приморской краевой клинической больнице № 1 за 2019–2025 гг. с расчетом абсолютных и относительных показателей, построением временных рядов и сравнением с данными 29 медицинских организаций Приморского края за 2023–2025 гг.
За указанный период зарегистрировано 23733 случая выделения микроорганизмов, из них Candida spp. — 3587 (15,1%) с выраженным ростом от 19 случаев в 2019 г. до 837 в 2025 г. и статистически значимым восходящим трендом. Доминирует C. albicans (85,6% выделений в 2020–2025 гг.), при этом нарастает значение азол-резистентных видов, прежде всего C. krusei и C. tropicalis, демонстрирующей многократное увеличение частоты выявления. Основным источником выделения является дыхательный тракт (80,3% случаев), отражающий высокую частоту колонизации у тяжелых пациентов, тогда как кандидурия и кандидемия встречаются реже, но имеют существенное клиническое значение. Удельный вес Candida в исследуемом стационаре многократно превышает средний региональный показатель (15,1% против 0,31%), что связано с концентрацией тяжелого контингента и более развитыми возможностями микробиологического мониторинга. Полученные данные подчеркивают рост грибковой нагрузки в крупном стационаре и необходимость оптимизации противогрибковой терапии, расширения лабораторной диагностики и усиления эпидемиологического надзора за резистентными штаммами Candida.
1. Введение
Инвазивные инфекции, вызванные видами рода Candida, остаются одной из наиболее значимых проблем инфекционного контроля и эпидемиологии в больничных учреждениях во всем мире . По данным наиболее актуального глобального анализа, опубликованного в 2024 году в журнале Lancet Infectious Diseases с анализом данных более чем из 120 стран, ежегодно регистрируется приблизительно 1565000 случаев кандидемии или инвазивного кандидоза с 995000 летальных исходов (63,6% от всех случаев). Эти данные подчеркивают глобальный масштаб проблемы и необходимость постоянного совершенствования диагностических и клинических подходов. Более того, авторы этого исследования отмечают, что эти оценки основаны на консервативных предположениях, и реальное число случаев может быть существенно выше, особенно в странах с низким и средним уровнем доходов, где системы эпидемиологического надзора менее развиты. Летальность при кандидемии остается высокой даже при адекватном противогрибковом лечении. По рекомендациям Infectious Diseases Society of America (IDSA) 2016 года , летальность при кандидемии в развитых странах составляет 30–60%, причем более высокие показатели регистрируются у пациентов с полиорганной недостаточностью, септическим шоком или заболеваниями крови. Это указывает на то, что кандидемия является истинной угрозой для жизни, требующей не только адекватного лечения, но и своевременной диагностики.
Эпидемиология инвазивного кандидоза претерпела существенные изменения за последние два десятилетия. Если исторически C. albicans доминировала в структуре инвазивного кандидоза, то в настоящее время отмечается прогрессивный и статистически значимый рост удельного веса видов, не относящихся к C. albicans (non-albicans Candida, NAC) . Видовой состав возбудителей имеет критическое значение для выбора эмпирической противогрибковой терапии, так как различные виды демонстрируют разные профили антифунгальной чувствительности, вирулентности и ассоциированные с ними показатели смертности. По современным представлениям, основанным на анализе более 150 клинических исследований, более чем 90% инвазивного кандидоза вызывается пятью основными видами: C. albicans, C. glabrata, C. tropicalis, C. parapsilosis и C. krusei . Каждый из этих организмов обладает уникальным потенциалом вирулентности, специфическими механизмами морфогенеза и собственным профилем антифунгальной резистентности.
C. tropicalis привлекает все большее внимание исследователей и клиницистов как возбудитель, характеризующийся высокой вирулентностью и летальностью на уровне 55–60%, что существенно превышает таковую для C. albicans (20–40%) . Систематический обзор, подготовленный для Всемирной организации здравоохранения, показал, что риск инвазивных инфекций, вызванных C. tropicalis, существенно повышен у пациентов с острой лейкемией (вероятность 4,77) и хроническими заболеваниями легких (вероятность 2,62). Более того, C. tropicalis демонстрирует устойчивость к флюконазолу у 40–80% изолятов, что требует использования альтернативных антифунгальных препаратов .
Множественные факторы риска развития инвазивного кандидоза в условиях стационара хорошо документированы в международной литературе и подтверждены многочисленными клиническими исследованиями. Согласно руководствам ESCMID и IDSA, к основным факторам риска относятся: пролонгированное пребывание (более двух недель) в отделении интенсивной терапии и реанимации (ОРИТ) (среди кандидемичных пациентов среднее время пребывания в ОРИТ до начала инфекции составляет 12,9 дней), наличие центральных венозных катетеров, использование механической вентиляции легких (встречается у 88% пациентов с COVID-19-ассоциированной кандидемией), предшествующая терапия широкого спектра антибиотиков, полное парентеральное питание, иммуносупрессия, нейтропения, злокачественные новообразования и трансплантация органов , , , . В недавнем исследовании из двух китайских больниц (2019–2023) было показано, что независимыми факторами риска развития кандидемии являются возраст (OR = 1,038, 95% CI: 1,007–1,071, P = 0,018) и септический шок (OR = 3,307, 95% CI: 1,205–9,071, P = 0,020). Интересно отметить, что более 70% пациентов в этом исследовании имели non-albicans Candida инфекции (71,97%, или 95 из 132 случаев) .
Пандемия COVID-19 привела к значительному увеличению частоты инвазивного кандидоза в стационарах по всему миру. Новое исследование из США показало, что вероятность летальности у пациентов с COVID-19-ассоциированной кандидемией была существенно выше (76%) по сравнению с пациентами в предпандемийный период (44%) и пациентами без COVID-19 в период пандемии (32%). Более того, пациенты с COVID-19 и кандидемией имели более высокую частоту диагностированной инфекции в ОИТ (92% против 49% в предпандемийный период и 44% в период пандемии без COVID-19) .
Цель исследования — проанализировать динамику выделения Candida spp. в многопрофильном стационаре Приморского края, оценить видовой состав, источники клинического материала и сопоставить показатели с региональными данными AMRcloud.
2. Методы и принципы исследования
Настоящее исследование является ретроспективным анализом микробиологического мониторинга, проводимого в бактериологической лаборатории многопрофильного стационара на территории Приморского края Российской Федерации. Исследуемое учреждение, Приморская краевая клиническая больница №1, является многопрофильным центром, включающим отделения интенсивной терапии, хирургии, онкологии, неврологии, пульмонологии и другие специализированные отделения. Период наблюдения составил семь лет (2019–2025).
Исследование включило анализ всех случаев выделения видов рода Candida из биологических материалов пациентов, независимо от возраста, пола и характера патологии. Собирали следующую информацию: общее количество регистрируемых инфекционных случаев, абсолютное число выделений Candida spp., видовую идентификацию возбудителей и источник выделения биологического материала. Для сравнительного анализа использованы данные эпидемиологического надзора Приморского края, полученные из системы онлайн учета выявленных возбудителей AMRcloud.
Статистический анализ включал расчет абсолютных и относительных показателей частоты выделения Candida spp. по годам наблюдения, вычисление процента выделений в общей структуре микробиологических находок, анализ динамики показателей за весь период, построение временных рядов для оценки трендов. Для выявления различий между группами использовались показатели соотношения и процентных вычислений. Сравнение с данными по Приморскому краю проводилось путем расчета относительных показателей удельного веса кандидоза в исследуемом стационаре и в регионе в целом.
3. Результаты и обсуждение
3.1. Общие эпидемиологические показатели
За семилетний период 2019–2025 годов в исследуемом стационаре было зарегистрировано всего 23733 случаев выделения различных микроорганизмов (таблица 1). Из них Candida spp. выделены в 3587 случаях, что составляет 15,1% от всех выявленных микроорганизмов. Это сопоставимо с глобальными оценками доли Candida среди внутрибольничных инфекций (обычно 8–15% в развитых странах) , .
Таблица 1 - Динамика выделения возбудителей инфекционных заболеваний по годам (2019–2025) в Приморской краевой клинической больнице № 1
2019 | 2020 | 2021 | 2022 | 2023 | 2024 | 2025 | Суммарно | |
Все возбудители | 1438 | 2066 | 3426 | 2984 | 3812 | 5164 | 4843 | 23733 |
Candida spp. | 19 | 271 | 585 | 424 | 721 | 730 | 837 | 3587 |
Candida albicans | 0 | 218 | 491 | 389 | 699 | 718 | 801 | 3316 |
Candida krusei | 0 | 12 | 39 | 11 | 19 | 10 | 14 | 105 |
Candida parapsilosis | 0 | 5 | 5 | 3 | 0 | 0 | 6 | 18 |
Candida lusitaniae | 0 | 3 | 0 | 6 | 0 | 0 | 0 | 9 |
Candida ciferrii | 0 | 2 | 0 | 10 | 0 | 0 | 0 | 12 |
Candida dubliniensis | 0 | 2 | 4 | 0 | 0 | 0 | 0 | 6 |
Candida tropicalis | 0 | 2 | 6 | 5 | 3 | 2 | 16 | 34 |
Candida glabrata | 0 | 0 | 10 | 0 | 0 | 0 | 0 | 10 |
Candida famata | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 2 |
Не уточненные | 19 | 27 | 28 | 0 | 0 | 0 | 0 | 74 |
За период 2019–2025 гг. было зарегистрировано от 19 случаев в 2019 г. (из 1438 микроорганизмов, 1,32%) до 837 случаев в 2025 г. (из 4843, 17,28%), с увеличением в 14,3 раза в 2020 г., максимумом в относительном выражении в 2021 г. (585 из 3426, 17,08%), снижением в 2022 г., повторным подъемом в 2023 г. (721 из 3812, 18,91%), максимумом в абсолютном выражении в 2024 г. и продолжением роста в 2025 г. Анализ частоты выявления Candida spp. у пациентов стационара по годам показан на рисунке 1. Диаграмма показывает резкий рост случаев с 19 в 2019 г. до пика 837 в 2025 г., с долей от 1,32% до максимума 18,91% в 2023 г. Увеличение в 14,3 раза произошло в 2020 г., за которым последовали колебания с общим восходящим трендом. Резкое увеличение случаев выявления Candida spp. в 2020 году, относительно 2019 года совпадает с началом пандемии COVID-19, когда значительно возросло число пациентов в ОРИТ, требующих механической вентиляции и различных инвазивных медицинских устройств. Средний показатель за 2020–2025 годы составил 16%, что подтверждает стойкое и высокое присутствие кандидоза в структуре инфекционных осложнений в стационаре.
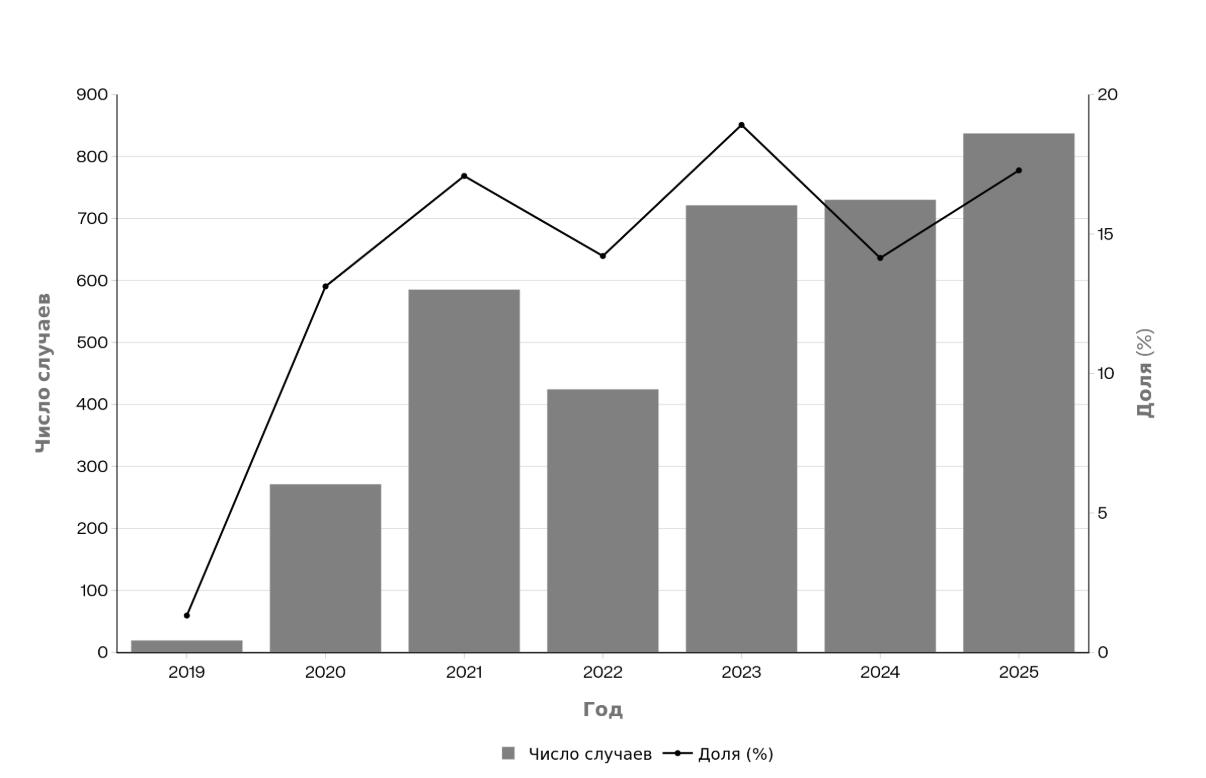
Рисунок 1 - Динамика случаев Candida spp. по годам (2019–2025) в Приморской краевой клинической больнице № 1
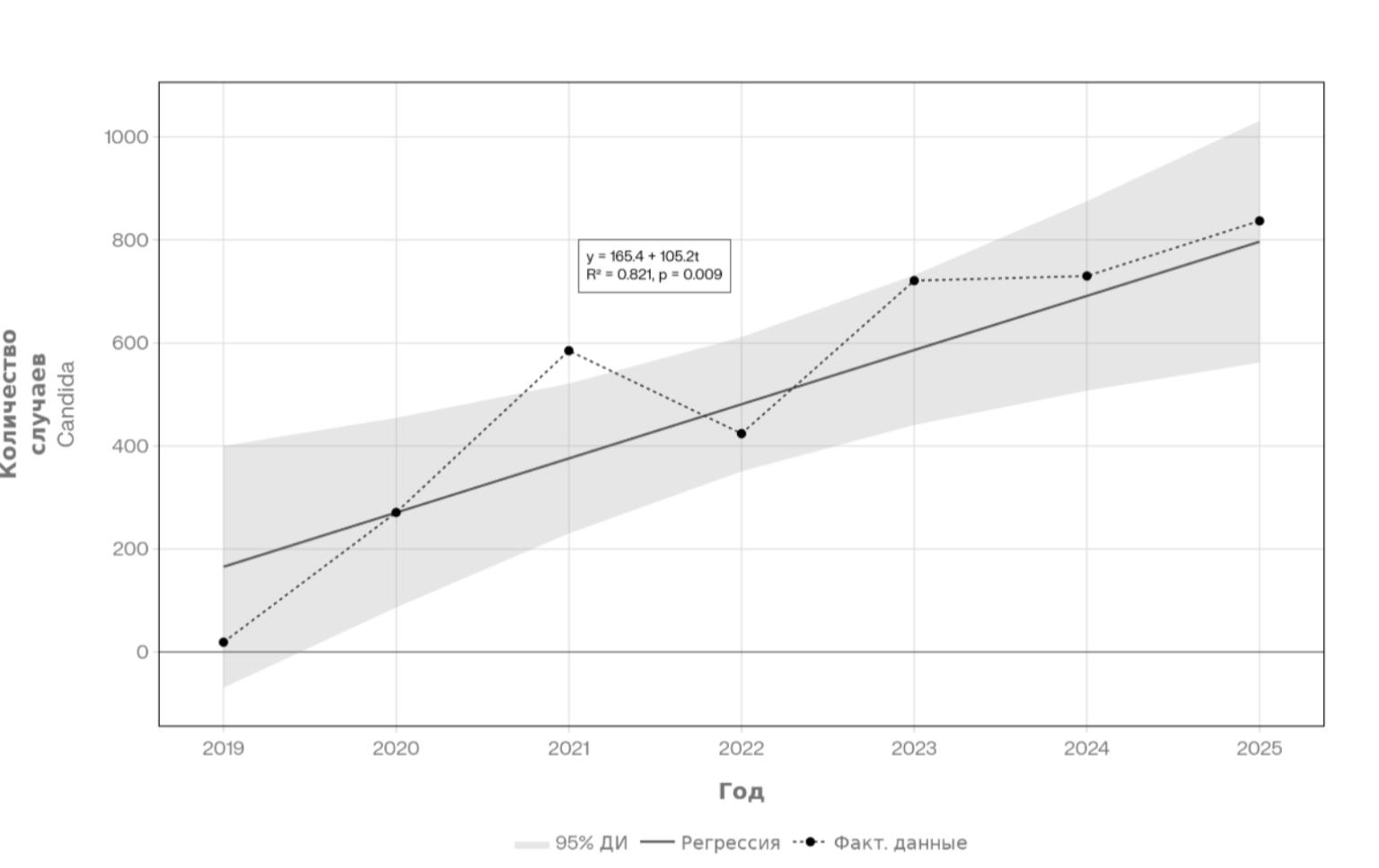
Рисунок 2 - Временная динамика инфекций Candida (2019–2025) с линией регрессии в Приморской краевой клинической больнице № 1
Глобальные данные, опубликованные в 2024 году, подтверждают, что инвазивный кандидоз остается одной из наиболее серьезных инфекций в условиях стационаров, с ежегодным числом случаев, достигающим 1565000 с летальностью 63,6% . Исследование из США показало, что пациенты с COVID-19-ассоциированной кандидемией имели существенно более высокую вероятную летальность (76%) по сравнению с пациентами в предпандемийный период (44%) и пациентами без COVID-19 в период пандемии (32%) .
3.2. Видовой состав возбудителей
C. albicans оставалась доминирующим видом на протяжении всего периода наблюдения (рисунок 3). Из всех выделений 2020–2025 годов C. albicans составила 3318 случаев из 3868 (85,6%). Однако выявлен значительный рост абсолютного числа выделений: с 218 в 2020 году до 801 в 2025 году, что представляет увеличение в 3,67 раза за пятилетний период и отражает общий рост инфекционной нагрузки в стационаре. Доминирование C. albicans в исследуемом стационаре соответствует наблюдениям в развитых странах и подтверждает, что этот вид остается наиболее частой причиной инвазивного кандидоза , .
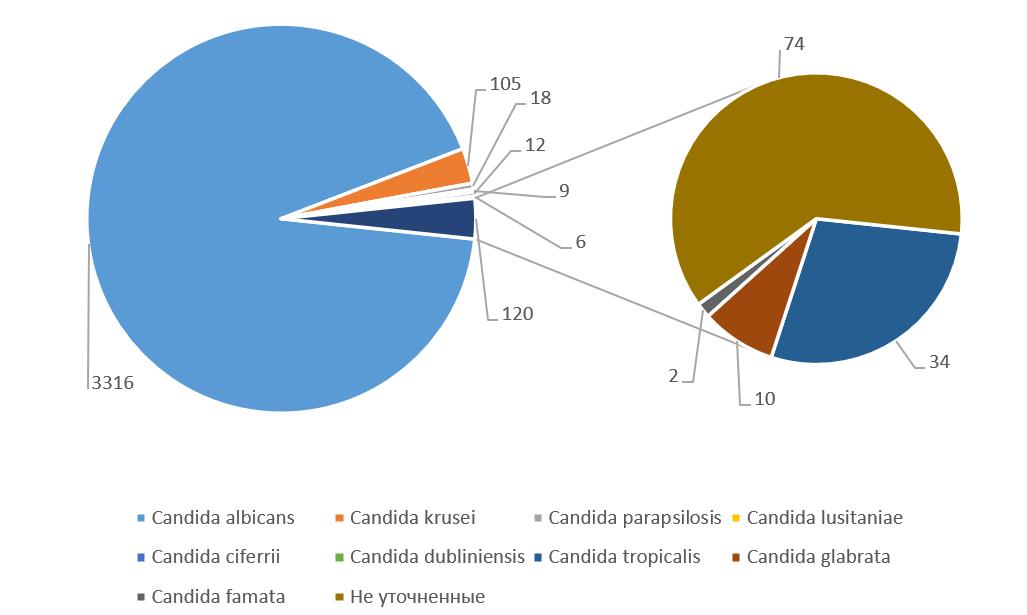
Рисунок 3 - Видовой состав выделений Candida spp. в Приморской краевой клинической больнице № 1 за 2019–2025 гг.
Среди видов, требующих особого внимания, C. tropicalis выделена в 34 случаях (рисунок 3) с тревожной тенденцией к увеличению, особенно в последние годы: от 2 случаев в 2020 году до 16 случаев в 2025 году (увеличение в 8 раз) (таблица 1). Систематический обзор для ВОЗ показал, что C. tropicalis демонстрирует:
– высокую летальность: 55–60%, что превышает таковую для C. albicans;
– высокую азол-резистентность: флюконазол 40–80%, но сохраняет чувствительность к эхинокандинам (0–1%), амфотерицину B (0%) и флуцитозину (0–4%);
– ассоциацию с тяжелыми заболеваниями: лейкемия (OR=4,77) и хронические заболевания легких (OR=2,62) являются независимыми факторами риска.
Эти данные указывают на необходимость срочного внедрения мониторинга распространения C. tropicalis в регионе.
Остальные зафиксированные виды Candida (C. lusitania, C. ciferrii, C. dubliniensis, C. tropicalis, C. glabrata, C. famata) занимают незначительную долю выявленных случаев (2,56%). При этом, C. parapsilosis (19 случаев) остается важным этиологическим агентом катетер-ассоциированных кровяных инфекций, особенно в связи с его способностью формировать стойкие биопленки на поверхности медицинских устройств и центральных венозных катетеров, что обусловливает длительную персистентность инфекции несмотря на терапию , . C. glabrata (20 случаев) показала значительную вариабельность чувствительности к эхинокандинам и азолам, что затрудняет выбор оптимальной терапии и требует проведения определения чувствительности для каждого отдельного штамма , .
3.3. Анализ по источникам выделения биологического материала
По рекомендациям ESCMID, выделение Candida из различных материалов имеет разное клиническое значение, и необходимо четко различать колонизацию от потенциально значимой инвазивной инфекции. Это требует не только лабораторной идентификации вида, но и глубокого понимания клинического контекста .
Таблица 2 - Частота выделений грибков вида Candida из биологического материала по годам (2019–2025) в Приморской краевой клинической больнице № 1
| 2019 | 2020 | 2021 | 2022 | 2023 | 2024 | 2025 | Суммарно |
Мокрота | 9 | 74 | 153 | 76 | 65 | 100 | 114 | 591 |
БАЛ | 5 | 9 | 1 | 2 | 7 | 6 | 6 | 36 |
Кровь | 1 | 0 | 10 | 3 | 0 | 1 | 7 | 22 |
Моча | 0 | 26 | 15 | 17 | 20 | 22 | 32 | 132 |
Ключевой вопрос клинической практики касается интерпретации выделения Candida из дыхательного материала. В исследуемом стационаре из респираторного тракта кандиды выделены в 627 случаях (80,3% от всех выделений) (таблица 2). При этом мокрота представлена 591 случаем (75,7% от всех материалов), максимум выделений кандид из мокроты приходился на 2021 год (153 случая), что соответствует пику инфекционной нагрузки на стационар в период пандемии COVID-19. Бронхоальвеолярный лаваж (БАЛ), являющийся более инвазивным методом получения материала из нижних отделов дыхательных путей, представлен 36 случаями (4,6%). Согласно актуальным рекомендациям ESCMID, выделение Candida из респираторных секреций не должно служить основанием для назначения противогрибковой терапии. Выделение Candida из мокроты или даже из БАЛ в подавляющем большинстве случаев отражает колонизацию дыхательного тракта, а не инвазивную инфекцию .
Однако колонизация дыхательного тракта Candida может служить маркером высокого риска развития вторичной бактериальной инфекции, особенно вентилятор-ассоциированной пневмонии. Исследование, опубликованное в 2025 году, показало, что различные виды Candida, включая C. albicans, C. glabrata, C. parapsilosis, C. tropicalis и C. dubliniensis, при интраназальной колонизации мышей вызывали различные степени воспаления легких. После инфекции Candida albicans отмечалось значительное увеличение цитокинов IL-8 и IL-1β в дыхательных путях, что указывает на активацию локального воспаления. Гистопатологические исследования постмортальных препаратов показали, что истинная инвазивная кандидозная пневмония встречается крайне редко, и даже при выделении Candida при прижизненной бронхоскопии инвазивный кандидоз легких был подтвержден менее чем в 10% случаев . Однако растущее число исследований указывает на то, что колонизация дыхательного тракта Candida ассоциирована с неблагоприятными исходами, включая развитие вторичной бактериальной вентилятор-ассоциированной пневмонии и повышенную летальность в ОРИТ. Механизм этого явления может быть связан с индукцией локального воспаления, нарушением функции альвеолярных макрофагов и облегчением адгезии и колонизации бактериальными патогенами , .
Candida выделена из мочи в 132 случаях (16,9% от всех материалов) (таблица 2). Распределение по годам показывает стабильный уровень: 26 (2020), 15 (2021), 17 (2022), 20 (2023), 22 (2024) и 32 (2025) случаях. Согласно рекомендациям ESCMID, кандидурия у большинства пациентов не требует противогрибкового лечения. Повторное выделение одного и того же вида Candida при посеве мочи от симптоматичного пациента с клинической картиной инфекции мочевыводящих путей (дизурия, боли в поясничной области) можно расценивать как истинную инфекцию, требующую лечения. Однако у подавляющего большинства асимптоматичных или малосимптомных пациентов антифунгальное лечение кандидурии не показано . Возрастание числа выделений в 2025 году (32 случая по сравнению с 22 случаями в 2024 году и средним 20 за 2020–2023 годы) может быть связано как с общим увеличением популяции катетеризированных пациентов, требующих длительной катетеризации мочевыводящих путей, так и с совершенствованием микробиологической диагностики . Кандидурия, как правило, представляет простую колонизацию мочевыводящих путей и не требует лечения. Единственными исключениями являются:
1) пациенты с высоким риском диссеминированного кандидоза (нейтропеничные пациенты, новорожденные с очень низкой массой тела);
2) пациенты, которым планируется урологическое вмешательство. В целом, у подавляющего большинства госпитализированных пациентов без факторов риска антифунгальное лечение кандидурии не показано и может способствовать развитию резистентности , .
Выделение Candida из венозной крови диагностирует кандидемию и требует немедленного начала противогрибковой терапии. Кандидемия ассоциирована с высокой летальностью: 30–60% даже при адекватном лечении . По данным систематического обзора 19-летней когорты из китайского стационара, 30-дневная летальность при кандидемии достигала 52,99%. Это подчеркивает критическую важность своевременной диагностики и начала лечения , . Возбудитель кандидемии в исследуемом стационаре был выявлен в 22 случаях (2,8% от всех материалов) (таблица 2). Распределение по годам не равномерно: 1 (2019), 0 (2020), 10 (2021), 3 (2022), 0 (2023), 1 (2024) и 7 (2025). Максимум приходится на 2021 год (10 случаев), что совпадает с пиком инфекционной нагрузки во время пандемии COVID-19. Отсутствие выделений в 2020 и 2023 годах может указывать либо на случайные колебания, либо на проблемы с организацией процесса забора крови для посева, что остается одной из наиболее частых проблем в микробиологической диагностике , .
3.4. Сравнение данных исследуемого стационара с региональными показателями
В регионе расположения исследуемого стационара (Приморский край) статистика выделения микроорганизмов в медицинских учреждениях ведется только с 2023 года. Согласно данным AMRcloud, в 29 медицинских учреждениях Приморского края (за исключением исследуемого стационара), за трехлетний период (2023–2025 года) было зафиксировано 26052 случая выделения всех видов микроорганизмов, из которых Candida выделена в 81 случае (0,31% от всех микроорганизмов) (таблица 3). Удельный вес кандидоза в исследуемом стационаре (15,1%) в 48,7 раза превышает региональный средний показатель (0,31%). Абсолютное число выделений Candida в одном стационаре (2 288 случаев) в 28,2 раза превышает общее число выделений по всему Приморскому краю (81 случай).
Таблица 3 - Выделение возбудителей инфекционных заболеваний по за период 2023–2025 годов в медицинских учреждениях Приморского края
| В крае, за исключением исследуемого стационара, абсолютное число | В исследуемом стационаре | Всего в крае, абсолютное число | |
абсолютное число | % | |||
Всего микроорганизмов | 26025 | 13819 | 34,6 | 39871 |
Candida spp. | 81 | 2288 | 96,58 | 2369 |
Таким образом, за период 2023–2025 годов показатели существенно различаются. Эта значительная разница объясняется несколькими факторами:
1) тип и профиль учреждения: исследуемое учреждение является многопрофильным центром с наличием нескольких отделений интенсивной терапии, хирургии и других специализированных отделений высокой сложности, в которых сосредоточены пациенты с множественными факторами риска инвазивного кандидоза;
2) уровень микробиологического мониторинга: стационар имеет хорошо оборудованную микробиологическую лабораторию с возможностью рутинной видовой идентификации грибков, в то время как многие другие учреждения региона могут проводить лишь базовую культуральную диагностику;
3) интенсивность использования инвазивных процедур: в исследуемом стационаре выше частота применения центральных венозных катетеров, механической вентиляции легких и других процедур;
4) интенсивность антибиотикотерапии: более интенсивное и продолжительное использование широкого спектра антибиотиков в условиях ОИТ.
Однако краевые показатели (0,31%) выглядят невероятно низкими и, очевидно, отражают недостаток микробиологического мониторинга в большинстве стационаров региона.
4. Заключение
Анализ семилетних данных микробиологического мониторинга в исследуемом многопрофильном стационаре Приморского края выявил значительное увеличение частоты выделения Candida spp., с доминированием C. albicans (85,6%), но с растущей долей видов, устойчивых к азолам, особенно C. tropicalis. Удельный вес кандидоза в исследуемом стационаре (19,0%) существенно превышает региональный средний показатель (0,31%), указывая на особенности контингента пациентов и необходимость совершенствования управления инфекциями.
Полученные данные свидетельствуют о растущем бремени инвазивного кандидоза: за период 2019–2025 выделено 3587 случаев Candida из 23733 всех микроорганизмов, с максимальной долей 15,1%. Четко прослеживается роль COVID-19: пандемия привела к резкому увеличению случаев в 2020 году с последующей стабилизацией на уровне 14–18%. Дыхательный тракт является основным источником выделений Candida: 80,3% выделений из дыхательного материала отражают высокую частоту колонизации при механической вентиляции. Увеличение выявлений C. tropicalis в 8 раз в 2025 году свидетельствует о растущей угрозе данного рода и требует пристального внимания со стороны эпидемиологического сообщества.
Выявлено 48-кратное превышение показателей в стационаре по сравнению с краем в целом, что, по всей видимости, связано с невозможностью рутинно уточнять грибковых возбудителей.
Практические рекомендации
1. Внедрение программ оптимизации использования антифунгальных препаратов: на основе актуальных рекомендаций ESCMID и IDSA с четкими критериями для дифференциации колонизации от потенциально значимой инфекции.
2. Совершенствование микробиологической диагностики: во всех стационарах региона с обеспечением возможности рутинного уточнения грибковых возбудителей, их видовая идентификация и определение чувствительности к антифунгальным препаратам.
3. Усиление эпидемиологического надзора грибковых возбудителей, включая C. tropicalis, с целью своевременного выявления распространения высоковирулентных и резистентных штаммов.
4. Повышение осведомленности клинического персонала: о фактических факторах риска инвазивного кандидоза, клинической значимости выделений из различных материалов и критериях для начала противогрибковой терапии.
5. Гармонизация региональной системы эпидемиологического надзора: для обеспечения полноты и точности регистрации грибковых инфекций во всех стационарах Приморского края.
