Перспектива применения метода полимеразной цепной реакции в реальном времени для диагностики инфекционных ониходистрофий
Перспектива применения метода полимеразной цепной реакции в реальном времени для диагностики инфекционных ониходистрофий
Аннотация
Микозы кожи и придатков — одни из самых распространенных грибковых заболеваний, а онихомикозы составляют до 86% Онихомикозы представляют значительную медико-социальную проблему, о чем свидетельствуют эпидемиологические данные: только в 2021 году в России было зарегистрировано около 115 тысяч случаев заболевания. Традиционные методы диагностики, такие как КОН-микроскопия и культуральное исследование, обладают ограниченной чувствительностью и длительностью выполнения. В данном исследовании оценивалась эффективность метода количественной ПЦР в реальном времени для диагностики онихомикозов.
В исследовании участвовали 57 человек, включая 34 пациента с ониходистрофией и 23 человека контрольной группы. Методом ПЦР-РВ анализировались 10 мишеней, включая общую грибковую массу, дерматофиты, дрожжевые и плесневые грибы. Установлены диагностически значимые cut-off значения: 4 lg для общей грибковой массы, 3 lg для Candida spp. и 3 lg для Aspergillus/Penicillium.
Ключевые результаты показали, что дерматофиты (pan-Dermatophytes) обнаруживались исключительно в группе пациентов с ониходистрофией и были выявлены у 15 пациентов, в то время как культуральный метод подтвердил их наличие только у 2 пациентов с высокими концентрациями по ПЦР. Статистически значимые различия между группами получены для общей грибковой массы (p < 0,001), Aspergillus/Penicillium (p < 0,01) и Candida spp. (p < 0,05).
Анализ микробных ассоциаций выявил преобладание микст-инфекций (23,5% — комбинация дерматофитов и плесеней), что подчеркивает сложность микобиома при ониходистрофиях. Сравнительный анализ методов диагностики показал случаи как полного соответствия результатов ПЦР и посева, так и значительные расхождения, особенно при низких концентрациях патогенных возбудителей.
Исследование демонстрирует преимущества количественной ПЦР-диагностики, включая более высокую чувствительность по сравнению с традиционными методами, возможность установления объективных диагностических порогов и выявления микст-инфекций. Полученные данные обосновывают целесообразность внедрения количественной ПЦР в клиническую практику для улучшения диагностики и оптимизации терапии онихомикозов.
1. Введение
Микозы кожи и ее придатков являются наиболее распространённой группой грибковых заболеваний. По эпидемиологическим данным, в 2022 году диагноз «трихофития» был присвоен 2,4 тыс. пациентов, диагноз «микроспория» — 54,7 тыс., а диагноз «микоз стоп и кистей» — 163,4 тыс. пациентов . Распространенность возбудителей, их чувствительность к антимикотическим препаратам создает важные задачи для медицинской микологии, не говоря уже о значительном психоэмоциальном и физическом дискомфорте пациентов . Онихомикоз (микоз ногтей) представляет собой патологический процесс, возникающий вследствие инфицирования грибковыми патогенами ногтевых пластин человека. Среди различных патологий ногтей, на онихомикозы может приходиться до 86% случаев . По данным Центрального научно-исследовательского института организации и информатизации здравоохранения в 2021 году в России заболеваемость микозами ногтей, кистей и стоп составляла почти 167 тысяч случаев в абсолютном выражении. При этом диагноз «онихомикоз» был поставлен в почти 115 тысячах случаев в абсолютном выражении . Онихомикозы наиболее распространены среди пожилых людей ввиду ряда физиологических факторов, как например замедление роста ногтевых пластин . Однако и молодые люди по причине травматизации ногтевых пластин или наличия хронических заболеваний, таких как псориаз, диабет и ВИЧ, также могут быть группой риска , . Возбудителями онихомикозов зачастую являются дерматофиты, дрожжи и недерматофитные плесневые грибы (НеД плесень) , , .
К дерматофитам, вызывающим онихомикоз, первоочередно относят представителей рода Trichophyton, а именно T. rubrum, T. interdigitale, входящий в комплекс T. mentagrophytes . Также среди дерматофитных возбудителей онихомикоза упоминается и E. floccosum . Candida — это комменсальный дрожжевой гриб, который преимущественно колонизирует слизистые оболочки. Однако есть достаточно много упоминаний этого микроорганизма в отношении онихомикозов , , . Среди онихомикозов, вызываемых Candida, основным возбудителем отмечают C. albicans. Второй по частоте выделения вид — C. parapsilosis . НеД плесени представляют собой нитчатые грибы, которые обычно встречаются в окружающей среде как сапрофиты и патогены растений . Наиболее распространенными видами, участвующими в патогенезе микоза ногтей, являются Scopulariopsis brevicaulis, Aspergillus spp., Fusarium spp. и Acremonium spp., Penicillium spp. . К сожалению, в отношении дрожжей и НеД плесени не всегда можно точно определить этиологический инфекционный агент ониходистрофии. Так, например, при использовании метода выделения культур, участие НеД плесени в патологии ногтей можно с определенной уверенностью заключить в случае их неоднократного выделения из ногтей пациента , .
Смешанные инфекции вызывают клинические трудности, поскольку не все микроорганизмы одинаково реагируют на лечение. Например, системные противогрибковые препараты, такие как тербинафин и азолы, часто необходимы для эффективного лечения онихомикоза, вызванного дерматофитами . Однако, учитывая их потенциальные побочные эффекты и риск взаимодействия с другими препаратами, назначение этих средств должно быть тщательно продумано и оправдано . Хотя классические клинические признаки часто указывают на грибковую инфекцию, существует ряд заболеваний, таких как псориаз, злокачественные новообразования или травмы, которые могут имитировать микоз ногтей . Для онихомикозов выявление грибкового возбудителя играет ключевую роль в установлении источника инфекции и способствует повышению приверженности пациента к длительной терапии, несмотря на возможные побочные эффекты. Важным моментом является то, что выбор подходящего антимикотического препарата должен основываться на принадлежности к роду/виду возбудителя . В частности, онихомикозы, вызванные НеД плесенью, проявляют устойчивость к тербинафину и азолам, поэтому местное использование амфотерицина B рассматривают в качестве терапии первой линии , . Устойчивость к антимикотическим препаратам также становится нарастающей проблемой для некоторых дерматофитов, особенно для Trichophyton rubrum и комплекса Trichophyton mentagrophytes , , .
Диагностика онихомикозов является затруднительной задачей ввиду ряда причин. В данный момент микробиологические методы диагностики, такие как КОН-микроскопия и посевы, являются основными, используемыми для обнаружения грибов в ногтях , , . Эти методы легкодоступны и экономически целесообразны для лабораторий. Однако как КОН-микроскопия, так и культуральный метод, показывают низкую чувствительность для обнаружения грибов и, как следствие, огромное количество ложноотрицательных результатов . При исследовании культур и микроскопической морфологии грибов опытный лаборант может идентифицировать род/вид гриба, что затруднительно для прямой КОН-микроскопии , , . Для проведения культуральной диагностики существует широкий спектр питательных сред, предназначенных для культивирования жизнеспособных грибов. Среды могут быть дополнены антибиотиками с целью достижения селективности и специфичности. Например, используется декстрозный агар Сабуро, обогащённый циклогексимидом, хлорамфениколом и гентамицином для подавления роста бактерий и большинства недерматофитных плесеней. Процесс роста культур достаточно длительный и может продолжаться до одного месяца или даже дольше для получения окончательных результатов , . Однако идентифицированные грибы, хоть и жизнеспособны, могут быть контаминантом, а не возбудителем онихомикоза. Поэтому важна синергия опыта лаборанта и опыта врача, чтобы оценить вероятность того, что грибковый агент является причиной патологии ногтей. Молекулярно-биологические методы, например полимеразная цепная реакция в реальном времени (ПЦР-РВ), в свою очередь, выигрывают в скорости, чувствительности и специфичности по сравнению с микробиологическими методами , , , . Нет сомнений, что применение данного метода оправдано в отношении выявления патогенных грибов дерматофитов . Однако, ПЦР-РВ может иметь свои сложности в интерпретации результатов при исследовании ногтей пациентов на наличие дрожжей и недерматофитной плесени как этиологических агентов возникшего микоза ногтей из-за того, что данные микроорганизмы могут присутствовать на поверхности ногтевых пластин и в норме .
Цель данного исследования была оценить перспективы применения метода ПЦР-РВ в отношении диагностики инфекционной природы ониходистрофий.
2. Методы и принципы исследования
В исследовании приняли участие всего 57 человек, которые были разделены на две клинические группы. Основную группу составили 34 пациента с клиническими признаками ониходистрофии, а группу контроля — 23 условно здоровых добровольца без патологии ногтевых пластин. Все участники исследования были обследованы с применением комплекса современных лабораторных методов для проведения сравнительного анализа микробиологических показателей.
Пробоподготовка и ПЦР-РВ
Полученные образцы ногтевых пластин подвергались пробоподготовке с использованием реагента для выделения ДНК бактерий и грибов из кожи человека и её придатков ПРОБА-ДЕРМ (ООО «ДНК-Технология-ТС»).
Для количественной оценки микобиоты была разработана современная мультиплексная ПЦР-РВ система, которая впоследствии легла в основу набора реагентов «ОнихоСкрин» (ООО «ДНК-Технология-ТС»). Данная система включала анализ десяти диагностически значимых мишеней в ITS-регионах грибов. В перечень анализируемых параметров вошли: общая грибковая масса как интегральный показатель общей грибковой нагрузки; дерматофиты, включая pan-Dermatophyte маркер, охватывающий такие роды как Trichophyton spp., Microsporum spp., Nannizzia spp. и вид Epidermophyton floccosum, а также родо-видовые маркеры Trichophyton spp., Trichophyton rubrum и Trichophyton mentagrophytes complex; дрожжевые грибы, включая родовые маркеры Candida spp. и видовой маркер Candida albicans; недерматофитные плесневые грибы, включая групповой маркер Aspergillus spp./Penicillium spp. и родовые маркеры Scopulariopsis spp. и Fusarium spp. Референтные последовательности для разработки системы были получены из международной базы данных GenBank и тщательно проанализированы с использованием современной биоинформатической программы Unipro UGENE v50.0. Измерение концентраций анализируемых грибов в пересчете на копии ДНК в миллилитре проводили относительно калибровочных кривых, разработанных с применением стандартизированной методики ООО «НПФ ДНК-Технология». Данная методика включала прямое измерение концентрации генно-инженерных конструкций с помощью современного спектрофотометрического метода. Количественную оценку грибов в образцах проводили методом построения калибровочных кривых с использованием серийных разведений стандартных образцов ДНК с известной концентрацией. Полученные значения выражали в десятичных логарифмах количества копий ДНК на миллилитр (lg копий/мл).
Амплификацию проводили на амплификаторе «ДТпрайм 5М1» (НПО «ДНК-Технология», Россия) со следующим профилем температурных циклов: предварительная инкубация при 80°C в течение 30 с (активация ДНК-полимеразы); начальная денатурация при 94°C в течение 90 с; 5 циклов денатурации при 94°C (30 с) и отжига при 64°C (15 с) с детекцией флуоресцентного сигнала; 45 циклов денатурации при 94°C (10 с) и отжига при 64°C (15 с) с детекцией сигнала; финальное охлаждение при 94°C в течение 5 с. Общее число циклов амплификации составило 50. Детекцию флуоресцентного сигнала проводили на стадии отжига праймеров (64°C).
Специфичность подобранных олигонуклеотидов тщательно тестировали на отсутствие перекрестных реакций с использованием охарактеризованных штаммов из научно-исследовательской лаборатории «Российская коллекция патогенных грибов» Северо-Западного государственного медицинского университета имени И.И. Мечникова. Валидация проведена на десяти референс-штаммах, включающих Aspergillus flavus РКПГF 1247/1094, Aspergillus fumigatus РКПГF 1248/880, Fusarium oxysporum РКПГF 155/4138, Scopulariopsis brevicaulis РКПГF 153/3572, Microsporum canis РКПГF 1630/1121, Trichophyton tonsurans РКПГF 1396/228, Trichophyton rubrum РКПГF 1868/334, Trichophyton interdigitale РКПГF 1459/11044, Trichophyton mentagrophytes РКПГF 1425 и Epidermophyton floccosum РКПГF 1659/17.
Секвенирование по Сэнгеру
Для независимой верификации результатов ПЦР-РВ было проведено секвенирование ITS-регионов грибов по классическому методу Сэнгера. Процесс амплификации осуществляли на современном амплификаторе «ДТпрайм 5М1» производства ООО «НПО ДНК-Технология» (Россия) (программа прописана ранее). Продукты полимеразной цепной реакции анализировали в 2% агарозном геле с последующей очисткой с использованием набора реагентов «Cleanup Mini» от ЗАО «Евроген» (Москва). Реакции секвенирования выполняли в обоих направлениях — прямом и обратном — с использованием тех же праймеров, что применялись для первичной ПЦР-амплификации. Разделение полученных фрагментов проводили на автоматическом генетическом анализаторе 3500 Genetic Analyzer компании Thermo Fisher Scientific с тщательным соблюдением всех протоколов и рекомендаций производителя. Последующий анализ последовательностей осуществляли с помощью программы Unipro UGENE v50.0 с обязательным сравнением с референтными последовательностями из международной базы данных NCBI GenBank.
КОН-микроскопия и посев
Из традиционных микологических методов в исследовании были применены КОН-микроскопия и культуральное исследование. Прямую микроскопию проводили с использованием 20% раствора гидроксида калия. Образцы тщательно исследовали под световым микроскопом на предмет наличия характерных грибковых элементов — гиф или спор. Результат считали однозначно положительным только при четкой визуализации характерных грибковых структур.
Культуральное исследование выполняли посевом на селективную питательную среду Сабуро с добавлением хлорамфеникола для эффективного подавления бактериальной контаминации. Чашки Петри с посевами инкубировали при температуре 25–27°C в течение срока до 5 недель с регулярным мониторингом роста грибковых колоний. Идентификацию выросших микроорганизмов проводили на основе комплексной оценки макро- и микроскопических морфологических признаков.
Статистика
Статистическую обработку полученных данных проводили с использованием программного обеспечения Microsoft Excel 2019 и специализированных статистических пакетов, реализованных на языке программирования Python. Для сравнения количественных показателей между группами применяли непараметрический U-критерий Манна-Уитни для показателей с распределением, отличающимся от нормального, и параметрический t-тест Стьюдента для показателей с нормальным распределением. Предварительную проверку нормальности распределения осуществляли с помощью теста Шапиро-Уилка. Уровень статистической значимости устанавливали при значении p < 0,05. Для определения диагностических пороговых значений использовали расчет 95% процентиля распределения соответствующих показателей в контрольной группе.
3. Основные результаты
Сравнительный анализ микробиологических показателей между группой пациентов с ониходистрофией и контрольной группой выявил статистически значимые различия по большинству исследуемых параметров. На основе 95% процентиля распределения в контрольной группе были установлены следующие диагностические пороговые значения (cut-off): для общей грибковой массы — 4,41 lg копий ДНК/мл, для Candida spp. — 2,90 lg копий ДНК/мл, для Aspergillus/Penicillium — 3.26 lg копий ДНК/мл (рис. 1).
Особенно показательными оказались результаты по дерматофитам: pan-Dermatophytes были обнаружены исключительно в группе пациентов с ониходистрофией, в то время как в контрольной группе данный показатель полностью отсутствовал. Все результаты pan-Dermatophytes приходились на род Trichophyton spp. Секвенирование образцов независимо подтвердило корректность идентификации возбудителей.
Общая грибковая масса показала высокую диагностическую ценность с четким разделением между группами и статистической значимостью p < 0,001. Распределение значений ОГМ в группе ониходистрофии характеризовалось большим разбросом (от 2,88 до 6,68 lg), что отражает вариабельность грибковой нагрузки у разных пациентов, в то время как в контрольной группе значения были сконцентрированы в более узком диапазоне более низких концентраций (от 2,59 до 4,88 lg).
Для недерматофитных плесеней Aspergillus/Penicillium были получены статистически значимые различия (p < 0,01) с установленным cut-off на уровне 3,26 lg копий ДНК/мл. В отличие от этого, показатель Fusarium spp. не показал статистически значимых различий между группами, что возможно связано с ограниченностью выборки. Scopulariopsis brevicaulis не был обнаружен ни в одной группе.
Дрожжевые грибы, представленные Candida spp., показали умеренную, но статистически значимую разницу между группами (p < 0,05) с cut-off значением 2,90 lg копий ДНК/мл. При этом в контрольной группе также отмечались отдельные случаи с повышенными значениями, что отражает возможность бессимптомного носительства дрожжевых грибов.
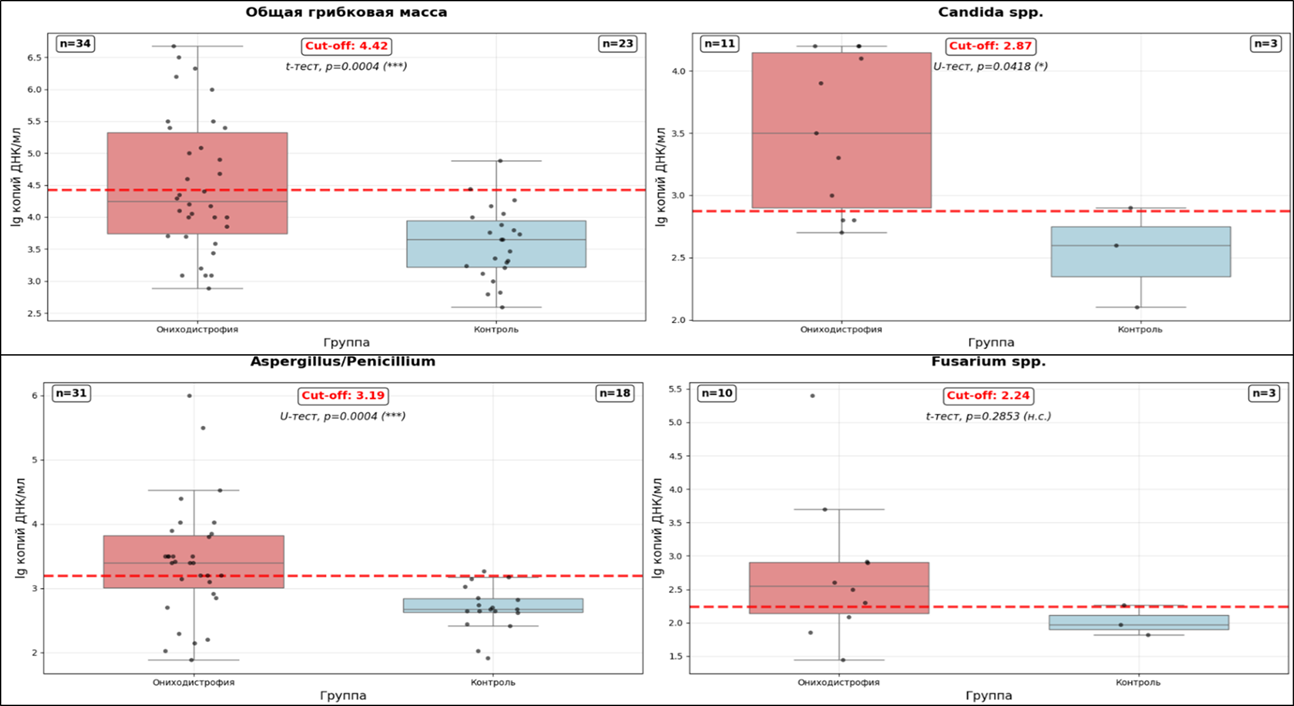
Рисунок 1 - Сравнительный анализ количественных показателей грибковой нагрузки у пациентов с ониходистрофией и в контрольной группе
Таблица 1 - Распределение грибковых ассоциаций в группе «ониходистрофии»
«Дерматофиты» | «НеД плесень» | «Дрожжи» | Количество | Процент |
+ | + | + | 5 | 14,7 |
+ | + | – | 8 | 23,5 |
+ | – | + | 3 | 8,8 |
+ | – | – | 7 | 20,6 |
– | + | + | 4 | 11,8 |
– | – | + | 2 | 5,9 |
– | + | – | 3 | 8,8 |
– | – | – | 2 | 5,9 |
Общая выборка (N) | 34 | 100 | ||
На основании анализа соотношения общей грибковой массы (ОГМ) и идентифицированных микроорганизмов выявлены значительные различия в полноте охвата микробиома, применяемой диагностической панелью. У доли пациентов с ониходистрофией обнаружена выраженная «неидентифицированная» грибковая масса, превышающая 1 lg, что свидетельствует о присутствии грибковых таксонов, не входящих в текущую диагностическую панель. График распределения пациентов по степени покрытия ОГМ (рис. 2) демонстрирует четкое разделение на две группы: пациенты с практически полным покрытием микобиома известными возбудителями и пациенты с долей неидентифицированных грибов.
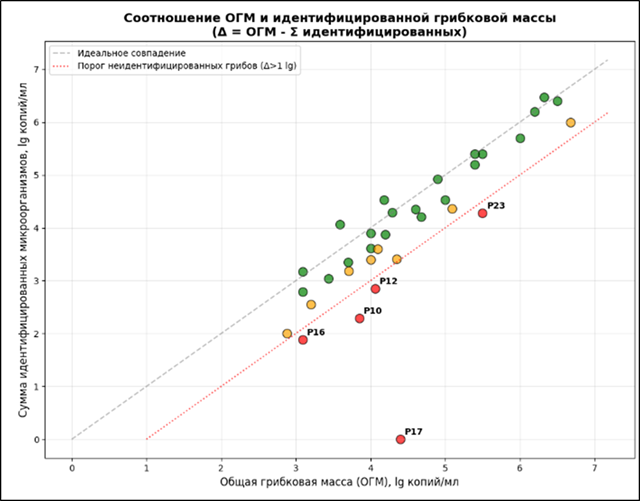
Рисунок 2 - График распределения пациентов по степени покрытия ОГМ, где Δ = ОГМ - Σ идентифицированных микроорганизмов
Примечание: зеленый – полная идентификация (Δ < 0,5 lg); желтый – частичная идентификация (0,5 ≤ Δ ≤ 1,0 lg); красный – неидентифицированные грибы (Δ > 1,0 lg)
Положительные результаты КОН-микроскопии получены при инфекциях, вызванных в одном случае Trichophyton rubrum, во всех трех случаях инфицирования Penicillium spp., а также при обнаружении Alternaria spp. культуральным методом. Особый диагностический интерес представляют два случая с положительной КОН-микроскопией при отрицательном результате посева. В этих образцах ПЦР-анализ выявил значимые концентрации дрожжевых грибов рода Candida (3,5 и 4,6 lg копий ДНК/мл соответственно), причем вся грибковая масса в этих случаях приходилась исключительно на Candida spp., а значения превышали установленный cut-off уровень 2,90 lg копий ДНК/мл.
В двух образцах из контрольной группы методом посева были обнаружены Rhodotorula mucilaginosa и Aspergillus niger, при этом КОН-микроскопия этих же образцов дала отрицательный результат. Так же были 2 случая положительной КОН-микроскопии при отрицательных результатах посева. Результаты ПЦР при этом для общей грибковой массы находились ниже уровня cut-off. Количественная ПЦР-диагностика этих образцов показала значения общей грибковой массы 3,9 и 3,4 lg копий ДНК/мл соответственно, что находится в пределах физиологической нормы и подтверждает статус бессимптомного носительства. При этом концентрация Aspergillus/Penicillium в обоих случаях составляла 2,7 lg копий ДНК/мл, что ниже установленного cut-off уровня (3,26 lg копий ДНК/мл) и соответствует фоновым значениям.
4. Обсуждение
Проведенное исследование демонстрирует высокую диагностическую ценность количественной ПЦР в дифференциальной диагностике инфекционных ониходистрофий. Установленные cut-off значения для основных микробиологических показателей позволяют объективизировать процесс интерпретации результатов и стандартизировать диагностический подход.
Полное отсутствие дерматофитов в контрольной группе и их обнаружение только у пациентов с ониходистрофией подтверждает их ключевую роль в этиологии онихомикозов . Этот факт согласуется с данными литературы, где дерматофиты рассматриваются как основные патогены при грибковом поражении ногтей. Выявления Trichophyton rubrum и Trichophyton mentagrophytes complex, обнаруженные в нашем исследовании, соответствуют современным представлениям о ведущей роли этих видов в патогенезе онихомикозов.
Особый интерес представляет анализ распределения микробных ассоциаций. Высокая частота микст-инфекций (23,5% для комбинации дерматофитов и недерматофитных плесеней) свидетельствует о сложном характере микробиома при ониходистрофиях. Это подчеркивает необходимость комплексного подхода к диагностике, учитывающего возможное многообразие грибковых ассоциаций. Обнаружение тройных микробных ассоциаций у 14,7% пациентов указывает на возможность формирования сложных микробных сообществ, что может иметь значение для выбора терапевтической тактики.
Соответствие результатов ПЦР и посева для Trichophyton rubrum (в высоко концентрированных образцах) подтверждает высокую специфичность молекулярных методов. В то же время случаи расхождения результатов, такие как обнаружение Alternaria spp. в посеве при доминировании Trichophyton mentagrophytes complex по данным ПЦР, демонстрируют важность применения более чувствительных методов для определения истинного этиологического возбудителя. Переход от традиционной микробиологической диагностики к молекулярным методам позволил бы значительно повысить выявляемость дерматофитов: с 2 случаев при посеве до 15 случаев при ПЦР-исследовании.
Результаты КОН-микроскопии подтверждают ее ценность как скринингового метода, однако случаи ложноотрицательных результатов подчеркивают необходимость дополнения микроскопии более чувствительными и специфичными методами. Обнаружение дрожжевых грибов рода Candida в концентрациях, превышающих cut-off уровень, при отрицательном посеве свидетельствует о возможных ограничениях культурального метода в диагностике кандидозных онихий.
Обнаружение Rhodotorula mucilaginosa и Aspergillus niger в контрольной группе также расширяет представление о спектре грибковых микроорганизмов, способных колонизировать ногтевые пластины без развития патологического процесса, что имеет значение для интерпретации результатов микологических исследований в клинической практике.
Эти находки демонстрируют, что даже у клинически здоровых лиц может присутствовать грибковая микрофлора в низких концентрациях, не вызывающая клинических проявлений заболевания. Расхождение между результатами посева и микроскопии в этих случаях подчеркивает более высокую чувствительность культурального метода по сравнению с микроскопией при низких концентрациях возбудителей. Одновременно количественная ПЦР позволяет объективно оценить уровень грибковой нагрузки и дифференцировать бессимптомное носительство от активной инфекции.
Установленные в исследовании cut-off значения обладают высокой клинической значимостью. Для унификации диагностических критериев и с учетом аналитической погрешности метода ПЦР целесообразно округление расчетных порогов до целых чисел. Порог 4 lg копий ДНК/мл для общей грибковой массы позволяет надежно дифференцировать патологическое состояние от бессимптомного носительства. Аналогично, cut-off значения для Candida spp. (3 lg) и Aspergillus/Penicillium (3 lg) обеспечивают объективные и практичные критерии для клинической интерпретации результатов.
Ограничением исследования можно считать относительно небольшой размер выборки, что могло повлиять на статистическую значимость некоторых показателей, в частности Fusarium spp. Критически важным преимуществом количественной оценки общей грибковой массы (ОГМ) является её способность однозначно указывать на грибковую этиологию ониходистрофии даже в тех случаях, когда конкретные возбудители не идентифицированы стандартной ПЦР-панелью. Полученные данные демонстрируют, что разнообразие грибковых микроорганизмов, потенциально вовлеченных в патологический процесс, настолько масштабно, что их невозможно полностью охватить в рамках даже расширенной ПЦР-системы. Выявление значительной «неидентифицированной» грибковой массы, превышающей 1 lg у доли пациентов, красноречиво свидетельствует о присутствии многочисленных грибковых таксонов, остающихся за пределами текущей диагностической панели. Таким образом, ОГМ служит универсальным маркером грибковой инфекции, позволяющим установить грибковую этиологию ониходистрофии независимо от того, какие конкретно виды грибов присутствуют в образце. Этот подход особенно ценен в сложных диагностических случаях, где традиционные методы, ориентированные на ограниченный набор патогенов, могут давать ложноотрицательные результаты.
Полученные данные убедительно свидетельствуют о преобладании микст-инфекций над моногрибковым поражениями, что подчеркивает необходимость комплексного подхода к диагностике и терапии онихомикозов с учетом возможного многообразия грибковых ассоциаций.
5. Заключение
Представленные данные свидетельствуют о том, что молекулярные методы могут внести неоспоримый вклад в постановку диагноза при неизвестной этиологии ониходистрофии. Это имеет важное значение, так как лабораторное подтверждение диагноза необходимо для назначения адекватной терапии и повышения приверженности пациента к лечению, которое может длиться месяцами. Безусловно, необходимо сопоставить преимущества, обеспечиваемые методом ПЦР-РВ для рутинной лабораторной диагностики, с затратами на реагенты и оборудование по сравнению с культуральным методом. Но в то же время следует учитывать высокий риск получения ложноотрицательных результатов, длительность диагностики, а также частоту контаминации при использовании культурального метода.
