РОЛЬ МУТАЦИЙ В ГЕНАХ BRCA 1/2 В ОПРЕДЕЛЕНИИ ТАКТИКИ ПЕРВИЧНОЙ ТЕРАПИИ РАКА ЯИЧНИКОВ. РЕТРОСПЕКТИВНЫЙ АНАЛИЗ РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ
РОЛЬ МУТАЦИЙ В ГЕНАХ BRCA 1/2 В ОПРЕДЕЛЕНИИ ТАКТИКИ ПЕРВИЧНОЙ ТЕРАПИИ РАКА ЯИЧНИКОВ. РЕТРОСПЕКТИВНЫЙ АНАЛИЗ РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ
Аннотация
Рак яичников (РЯ) в России занимает 9 место по заболеваемости (4,2%) и 7 место по смертности (5,6%) среди онкологических заболеваний у женщин. Наследственные формы часто связаны с мутациями в генах BRCA1/2. Тактика терапии распространенных форм РЯ остается дискуссионной. Целью работы была разработка алгоритма выбора первичной тактики лечения (первичная циторедуктивная операция — ПЦР или неоадъювантная полихимиотерапия с интервальной циторедукцией — НАПХТ+ИЦР) на основе ретроспективного анализа данных 240 пациенток с использованием модели регрессии Кокса.
В общей популяции ПЦР показала значимое преимущество перед интервальным методом по выживаемости без прогрессирования (ВБП): HR=0.46, 95% CI 0.32-0.66, p=0.00097. Многофакторный анализ выявил, что наличие мутации BRCA1/2 и проведение поддерживающей терапии являются значимыми прогностическими факторами. В группе НАПХТ+ИЦР пациентки с BRCA-мутацией (BRCA-mut) и поддерживающей терапией (независимо от наличия мутации) имели на 80% меньший риск прогрессирования по сравнению с пациентками без мутаций и без поддерживающей терапии (HR=0.17, 95% CI 0.07–0.40). Для пациенток с BRCA-wt выбор ПЦР в качестве первичной тактики лечения имел большее значение, чем для BRCA-mut.
На основе результатов предложена алгоритм принятия решений в реальной клинической практике.
1. Введение
В 2021 году в России рак яичников (РЯ) занял 9-е место по заболеваемости (4,2%, 17,05 на 100 тыс.) и 7-е место по смертности (5,6%, 9,23 на 100 тыс.) среди женского населения
. Средний возраст больных с впервые выявленным раком яичников – 59,1 года. Около 10% случаев РЯ связаны с наследственными синдромами, наиболее распространенный из которых обусловлен мутациями в генах BRCA1/2 . Большинство эпизодов РЯ носит спорадический характер, при этом для заболевания характерно раннее распространение по брюшине, поэтому более половины случаев диагностируются на III-IV стадиях .Тактика лечения распространенных форм РЯ не стандартизирована вплоть до настоящего времени. При возможности выполнения оптимальной циторедукции рекомендуется первичная операция
, . При невозможности – лечение начинают с химиотерапии , . Сложность возникает в ситуациях, когда применимы оба подхода. Крупные метаанализы (Bristow R, Du Bois) демонстрируют преимущество агрессивной хирургии , , в то время как другие исследования (Fagotti A) указывают на рост осложнений и отсутствие разницы в выживаемости, предлагая НАПХТ , . Cho J с соавторами считает необходимым отталкиваться от генетических особенностей опухоли . Исследование TRUST (ClinicalTrials.gov ID NCT02828618), результаты которого были доложены летом этого года на American Society of Clinical Oncology's 2025 annual meeting (ASCO 2025) также не показало убедительных преимуществ одного метода над другим (ВБП: HR=0,8; ОВ: HR=0,89, p=0,24). Кроме того, результаты передовых клиник не всегда воспроизводимы в региональных центрах.В связи с этим, целью настоящей работы стало создание авторской модели принятия решений в условиях реальной клинической практики на основе статистического анализа собственных данных.
2. Методы и методы
Проведен ретроспективный анализ 240 пациенток с гистологически верифицированным эпителиальным РЯ (90,0% – серозная карцинома высокой степени злокачественности, стадия FIGO IIIa-IV). Всем выполняли анализ на герминальные мутации BRCA1/2 методом ПЦР (87,4%) и/или NGS (50,1%, в т.ч. с оценкой HRD – 13,2%). Данные для анализа были взяты из базы данных пациентов с раком яичников, ведущейся в учреждении (свидетельство на регистрацию базы данных № 2024626243 от 20.12.2024г.).
Первичное лечение включало:
1) ПЦР (полная – 33%, оптимальная – 77%) с последующей адъювантной полихимиотерапией (АПХТ) по схеме Паклитаксел 175 мг/м2 + Карбоплатин AUC 5-6 (РаС) с циклом 21 день в количестве 6 курсов;
2) НАПХТ по схеме РаС до 3 курсов с последующей ИЦР и АПХТ по схеме РаС до трех курсов.
Поддерживающая терапия назначалась в зависимости от статуса BRCA:
1. BRCA-mut: ингибиторы поли(АДФ-рибоза)-полимеразы (PARP) (43,6%), ингибиторы рецепторов фактора роста эндотелия сосудов (VEGFR) (7,2%), без поддерживающей терапии (49,2%).
2. BRCA-wt: ингибиторы VEGFR (24,3%), без поддерживающей терапии (75,7%).
Дополнительное характеристики пациентов, включенных в исследование, представлены в таблицах 1 и 2.
Таблица 1 - Основные характеристики пациентов
Параметр | Кол-во | Доля (%) |
Стадия FIGO | ||
IIIa | 9 | 3,8 ± 1,23 |
IIIb | 14 | 5,8 ± 1,51 |
IIIc | 142 | 59,2 ± 3,17 |
IVa | 18 | 7,5 ± 1,70 |
IVb | 57 | 23,8 ± 2,75 |
Статус BRCA | ||
BRCA-wt | 185 | 77,1 ± 2,71 |
BRCA-mut | 55 | 22,9 ± 2,71 |
Первичная терапия | ||
НАПХТ | 153 | 63,8 ± 3,10 |
ПЦР | 87 | 36,3 ± 3,10 |
Поддерживающая терапия | ||
Нет | 165 | 68,8 ± 2,99 |
Да | 75 | 31,3 ± 2,99 |
Исход ВБП | ||
Завершено (прогрессирование) | 148 | 61,7 ± 3,14 |
Цензурировано | 92 | 38,3 ± 3,14 |
Таблица 2 - Возраст и длительность наблюдения
Признак | Параметр | ||||||
Минимум | Максимум | Интерквартильный диапазон Q25 | Медиана Q50 | Интерквартильный диапазон Q75 | Среднее значение | Стандартное отклонение | |
Возраст (лет) | 32 | 85 | 52 | 62 | 67 | 59,808 | 10,769 |
Длительность Наблюдения (дни) | 3 | 1323 | 146 | 324 | 579,5 | 392,788 | 302,422 |
Примечание: n=240
Статистический анализ включал построение моделей пропорциональных рисков Кокса. Значимость оценивалась с помощью теста Вальда. Построение кривых выживаемости проводилось по методу Каплан-Мейера, сравнение групп – лог-ранк тестом. При выполнении множественных сравнений полученные уровни статистической значимости р корректировали с применением поправки Бенджамини-Хохберга. Первоначально оценивалась ВБП в зависимости от метода первичной терапии, затем выявлялись дополнительные значимые факторы. С этой целью в начале выстраивали модель с многими факторами, затем факторы, не оказавшие значимого влияния на модель, отбрасывали. Процесс повторяли до тех пор, пока не останутся только значимые факторы.
3. Результаты
Анализ выживаемости без прогрессирования в общей популяции: при анализе ВБП в обеих группах после первичного лечения были получены убедительные данные, говорящие о преимуществе первичной циторедуктивной операцией над интервальным методом терапии (hazards ratio [HR], 0.46, 95% CI, 0.32-0.66) p = 0,00097 (рис. 1).
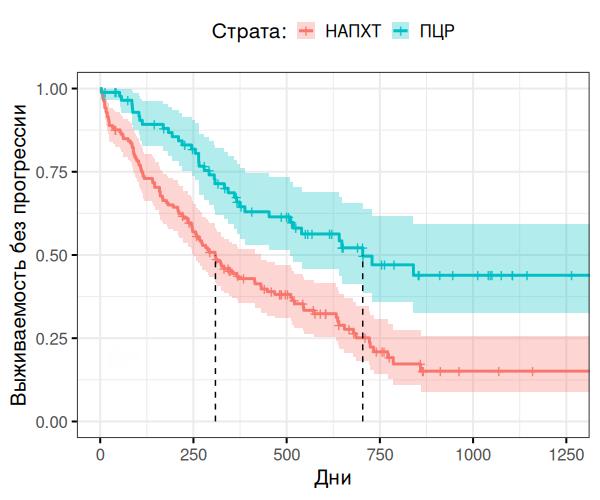
Рисунок 1 - Анализ выживаемости без прогрессирования (ВБП) в группах
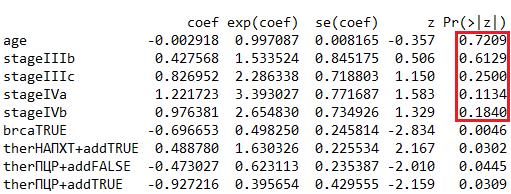
Рисунок 2 - Выявление дополнительных предикторных параметров
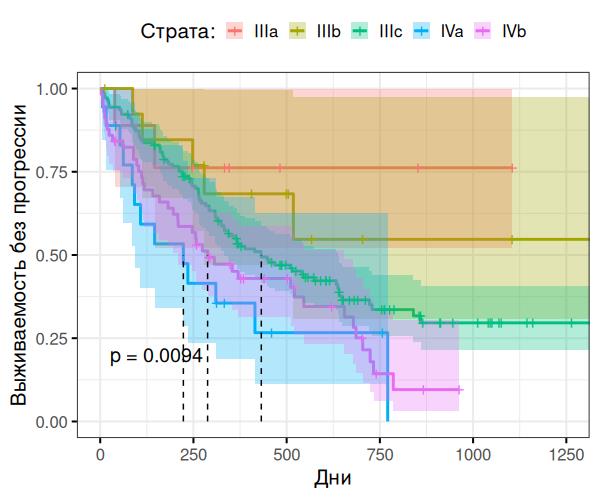
Рисунок 3 - Анализ по Каплан-Мейеру (вне модели)
При построении последующей модели с факторами, которые показали свою значимость в предыдущей, было подтверждено, что все включенные переменные имеют значимые коэффициенты (рис. 4).
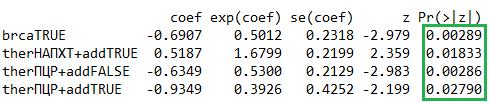
Рисунок 4 - Анализ значимых факторов
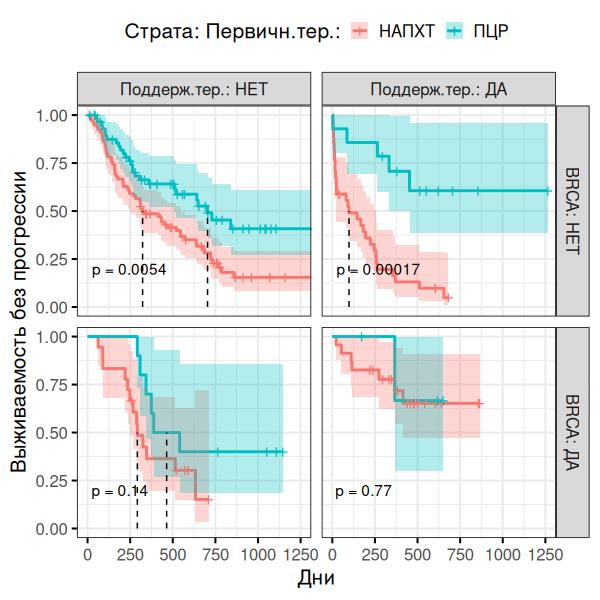
Рисунок 5 - Оценка влияние статуса BRCA и поддерживающей терапии
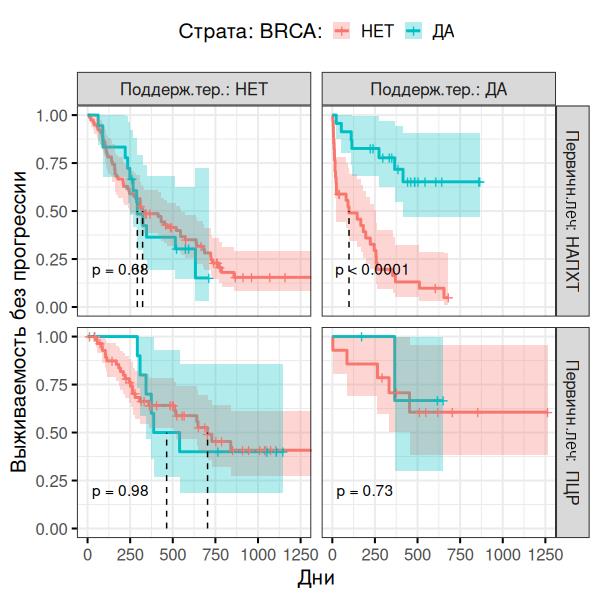
Рисунок 6 - Анализ взаимодействия типа терапии и статуса BRCA
4. Обсуждение
Метаанализы подтверждают ключевую роль хирургического компонента в лечении РЯ. Bristow R и соавт. (N=6885) выявили значимую корреляцию между объемом циторедукции и выживаемостью без прогрессирования (ВБП)
. Du Bois и соавт. (N=3126) показали, что медиана общей выживаемости (ОВ) при полной циторедукции достигала 99,1 мес. против 29,6 мес. при неоптимальной . Аналогично, Chi D и Harter P с коллегами продемонстрировали значительное увеличение ОВ при увеличении частоты полных и оптимальных циторедукций , .Однако агрессивная хирургия сопряжена с рисками. В исследовании Scorpion Fagotti A и соавт. зафиксировали значительный рост послеоперационных осложнений III-IV ст. по Clavien-Dindo в группе первичной ПЦР по сравнению с НАПХТ – 52,7% vs 5,7%
. В последующем анализе той же группы разницы в ВБП и ОВ между ПЦР и НАПХТ выявлено не было . Метаанализ Cochrane Library (5 RCT, N=1774) также не обнаружил достоверных различий в ОВ и ВБП, но отметил значительно меньшую частоту серьезных нежелательных явлений в группе НАПХТ (6% vs 29%) .Важным прогностическим фактором, по мнению Cho J и соавт., является биомаркерный и генетический портрет опухоли, включая инфильтрирующие лимфоциты (TIL) и мутации BRCA 1/2, ассоциированные с увеличением 5-летней выживаемости на 20% и более
.Следует отметить, что выбор тактики при РЯ не имеет универсального алгоритма. В ситуациях, однозначно позволяющих выполнить ПЦР, она предпочтительна (HR=0.46, p=0.00097). В сомнительных случаях (высокая коморбидность, распространенность процесса) ключевыми точками опоры становятся статус мутации BRCA и возможность последующей поддерживающей терапии. Для пациентов с BRCA-мутацией стратегия НАПХТ с последующей терапией ингибиторами PARP снижает риск прогрессирования на 82% (HR=0,18; p<0,001) по сравнению с BRCA-wt, что делает ее эффективной альтернативой. Для пациентов с BRCA-wt, напротив, более оправдан агрессивный хирургический подход (ПЦР), что подтверждается построенной моделью (рис. 7).
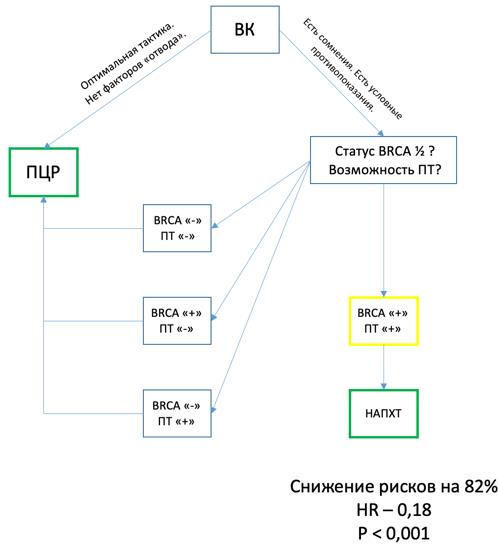
Рисунок 7 - Авторский алгоритм для выбора тактики терапии РЯ
Примечание: условные сокращения: ВК – врачебный консилиум; ПТ – поддерживающая терапия; ПЦР – первичная циторедуктивная операция; НАПХТ – неоадъювантная полихимиотерапия
5. Заключение
Результаты проведенного исследования позволяют нам сформулировать следующие выводы:
1. В общей популяции пациенток с РЯ ПЦР значимо снижает риск прогрессирования по сравнению с интервальным методом лечения.
2. Статус мутации в генах BRCA1/2 и возможность проведения поддерживающей терапии являются значимыми факторами, влияющими на выбор первичной тактики.
3. Для пациенток с BRCA-wt критически важен выбор в пользу ПЦР, в то время как для BRCA-mut пациенток эффективной альтернативой может быть НАПХТ+ИЦР с последующей поддерживающей терапией.
4. Разрабатываемый алгоритм, основанный на персонифицированных данных, позволяет улучшить результаты лечения в реальной клинической практике.
Дальнейшая работа будет направлена на интеграцию дополнительных молекулярно-генетических и иммуногистохимических маркеров.
