Оценка возможности подавления роста злокачественных клеток человека в культуре in vitro с использованием разработанного моноклонального антитела
Оценка возможности подавления роста злокачественных клеток человека в культуре in vitro с использованием разработанного моноклонального антитела
Аннотация
Энергетическое перепрограммирование стало важной характеристикой раковых клеток, однако роль микроэлементов, таких как железо, в этих процессах остается недостаточно изученной, а тема актуальной. Мы предположили, что в процессе онкогенеза опухолевые клетки могли приобрести дополнительный энергетический путь с использованием ионов железа и разработали моноклональное антитело к белку, который участвует в переносе электронов в цепи окислительно-восстановительных реакций с железом.
Цель исследования: оценить способность разработанного моноклонального антитела 3G7H8 подавлять рост злокачественных клеток человека in vitro.
Материалы и методы: использовали две клеточные линии: HeLa (адгезивная культура) и K562 (суспензионная культура). Для HeLa применяли систему xCELLigence для анализа роста клеток в реальном времени. Для K562 проводили 3-дневное культивирование с подсчетом клеток и оценкой жизнеспособности.
Основные результаты: антитело 3G7H8 значительно подавляло рост клеток HeLa по сравнению с контролем. При добавлении антитела к культуре K562 количество клеток уменьшалось на 61-72% за 3 дня, в то время как в контроле увеличивалось на 83%.
Выводы: моноклональное антитело 3G7H8 продемонстрировало антипролиферативный эффект на обеих клеточных линиях и потенциальную противоопухолевую активность разработанного моноклонального антитела in vitro. Результаты указывают на перспективность терапевтического применения разработанного антитела, особенно для лечения рака шейки матки.
1. Введение
С 2011 года энергетическое перепрограммирование стало важной характеристикой раковых клеток, однако роль микроэлементов, таких как железо, в этих процессах остается недостаточно изученной , , . Железо, обладая способностью к переносу электронов, участвует во многих биохимических реакциях, критически важных для клеточного гомеостаза, включая дыхание и репликацию ДНК , , . У онкологических пациентов метаболизм железа часто изменен, и опухолевые клетки используют разные механизмы для увеличения его биодоступности , , . Согласно теории симбиогенеза, митохондрии происходят от аэробных бактерий, которые стали симбионтами предковых эукариотических клеток , . Мы предположили, что в процессе онкогенеза опухолевые клетки могли приобрести дополнительный энергетический путь с использованием ионов железа, включая окислительно-восстановительные реакции. В качестве объекта для дальнейших исследований был выбран бактериальный белок рустицианин, который участвует в переносе электронов в цепи окислительно-восстановительных реакций с железом и способствует образованию АТФ. Мы предположили существование его гомолога в опухолевых клетках. На следующем этапе мы провели клонирование, экспрессию и очистку рекомбинантного рустицианина, иммунизировали лабораторных мышей, получили клеточные линии гибридом и протестировали моноклональные антитела методом ИФА. Выделен наиболее активный клон антител к рустицианину «3G7H8».
Цель исследования: оценить способность разработанного моноклонального антитела 3G7H8 подавлять рост злокачественных клеток человека in vitro.
2. Методы и принципы исследования
Исследование проведено в лаборатории ГБУЗ «Самарский областной медицинский центр Династия» Для оценки антипролиферативного эффекта разработанного антитела 3G7H8 (мышиное) было проведено два эксперимента с адгезивной клеточной линией и суспензионной клеточной линией. Оценка воздействия антитела на адгезивную клеточную культуру линии HeLa (аденокарцинома шейки матки) проводилась с использованием инструмента xCELLigence DP (ACEA Biosciences, США), позволяющего детектировать клеточный индекс в режиме реального времени. Исследуемое моноклональное антитело концентрации – 0,01442 мг добавлялось к клеточной культуре. Контролем служила клеточная линия HeLa без добавления антитела. Оценка антипролифиративного эффекта антитела 3G7H8 проводилась через 70 часов, в 15 сериях.
Для оценки антипролиферативного эффекта разработанного антитела на суспензионной культуре K562 (миелогенный лейкоз) проводилось культивирование в течение трех дней в 24-луночных планшетах с использованием среды RPMI в инкубаторе Thermo Scientific (США) при температуре 370С. В каждую лунку добавлялось по 1 мл среды, содержащей 1 млн клеток K562. Исследуемое моноклональное антитело в двух концентрациях (концентрация 1 – 0,01442 мг, концентрация 2 - 0,02884 мг) добавлялось к клеточной культуре. Подсчет клеток и оценка жизнеспособности проводились на клеточном анализаторе Countess 2FL с трипановым синим по утвержденной производителем анализатора методике в день 1 до добавления исследуемого вещества и на третий день культивации. Контролем служила суспензионная культура K562 без добавления антитела. Эксперимент проводился в 10 сериях. Статистический анализ проводилась с помощью компьютерной программы IBM SPSS Statistics 21.
3. Основные результаты
Получены следующие результаты оценки антипролифиративного эффекта антитела 3G7H8 с использованием аппартата xCELLigence DP (ACEA Biosciences) на адгезивной линии HeLa: снижение клеточного индекса через 10 часов в контроле – 2,6+0,2, в основной группе – 1,2+0,1, в 2,1 раза (p<0,05), через 70 часов культивирования клеточный индекс в контроле – 4,1+0,2, в основной группе – 1,5+0,1, в 2,7 раза (p<0,05).
Представленные на рис.1 график роста клеток в отсутствии или присутствии антител 3G7H8 в культуральной среде демонстрируют, что использование антител 3G7H8 значительно подавляет рост опухолевых клеток тестированной линии и не подавляет рост контрольной культуры. Таким образом, полученные моноклональные антитела 3G7H8 ингибируют клеточный ответ, замедляя темп пролиферации опухолевых клеток in vitro. Результаты указывают на перспективность терапевтического использования моноклонального антитела 3G7H8 для лечения рака шейки матки человека.
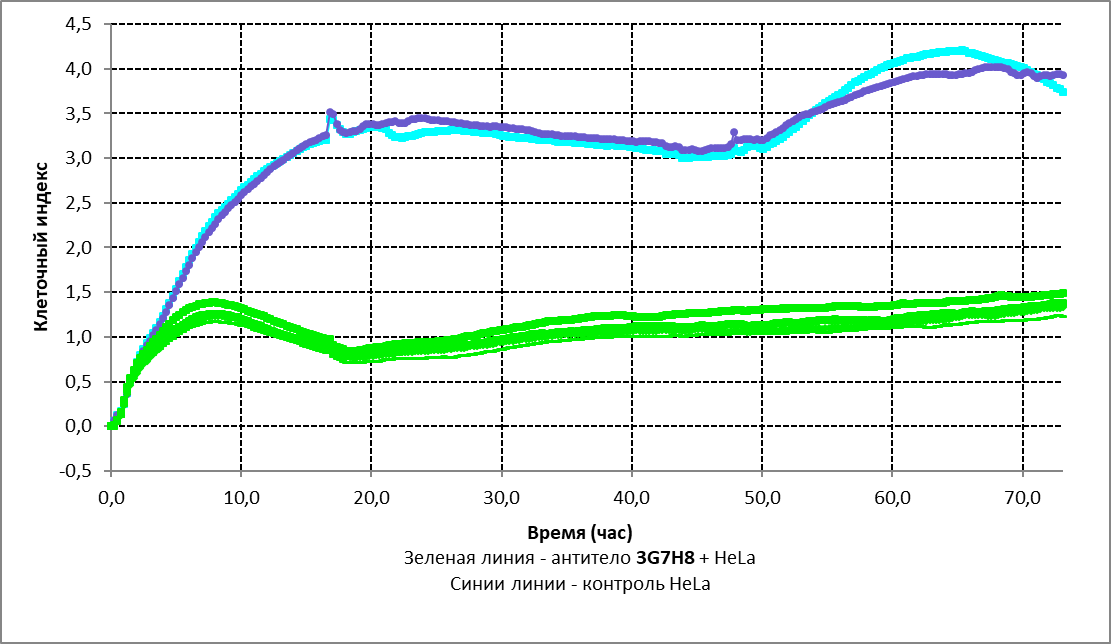
Рисунок 1 - График роста клеток в отсутствии или присутствии антител 3G7H8
Таблица 1 - Результаты исследования антипролиферативного действия моноклонального антитела 3G7H8 на клеточных моделях — культура K562
№ серии | Моноклональное антитело 3G7H8 концентрация 1 | Моноклональное антитело 3G7H8 концентрация 2 | Контроль | |||
Количество клеток день 1 | Количество клеток день 3 | Количество клеток день 1 | Количество клеток день 3 | Количество клеток день 1 | Количество клеток день 3 | |
1 | 1 070 000 | 399 000 | 1 010 000 | 290 000 | 1 000 000 | 2 010 000 |
2 | 1 010 000 | 420 000 | 1 030 000 | 310 000 | 990 000 | 1 800 000 |
3 | 1 050 000 | 380 000 | 1 015 000 | 300 000 | 1 010 000 | 1 900 000 |
4 | 990 000 | 400 000 | 1 000 000 | 270 000 | 1 050 000 | 1 900 000 |
5 | 1 040 000 | 490 000 | 1 040 000 | 295 000 | 1 020 000 | 1 970 000 |
6 | 1 097 000 | 350 000 | 990 000 | 250 000 | 980 000 | 1 910 000 |
7 | 1 060 000 | 450 000 | 1 070 000 | 300 000 | 1 030 000 | 2 000 000 |
8 | 1 000 000 | 430 000 | 1 020 000 | 280 000 | 1 015 000 | 2 020 000 |
9 | 1 030 000 | 380 000 | 1 010 000 | 290 000 | 1 010 000 | 1 900 000 |
10 | 1 040 000 | 390 000 | 1 020 000 | 250 000 | 1 000 000 | 1 850 000 |
Ср. знач. | 1 038 700 | 408 900 | 1 020 500 | 283 500 | 1 010 500 | 1 926 000* |
Ст. откл. | 31 196 | 38 091 | 21 266 | 19 755 | 19 033 | 68 731 |
Примечание: * p<0,05 (уровень значимости различий контрольной и основных групп на 3 день культивирования)
При добавлении антитела 3G7H8 в концентрации 1 средняя жизнеспособность клеток K562 снизилась с 96% до 9% за 3 дня (p<0,001). При концентрации 2 антитела 3G7H8 средняя жизнеспособность снизилась с 97% до 2% за 3 дня (p<0,001). В контрольной группе средняя жизнеспособность осталась высокой, снизилась с 97% до 92% за 3 дня (p>0,05) (таблица 2).
Таблица 2 - Результаты исследования жизнеспособности опухолевых клеток на клеточных моделях - культура K562 (миелогенный лейкоз)
№ серии | Моноклональное антитело 3G7H8 концентрация 1 | Моноклональное антитело 3G7H8 концентрация 2 | Контроль | |||
Жизнеспособность день 1, % | Жизнеспособность день 3, % | Жизнеспособность день 1, % | Жизнеспособность день 3, % | Жизнеспособность день 1, % | Жизнеспособность день 3, % | |
1 | 95 | 10 | 95 | 3 | 98 | 93 |
2 | 96 | 8 | 99 | 1 | 99 | 95 |
3 | 95 | 11 | 98 | 2 | 95 | 90 |
4 | 97 | 9 | 95 | 3 | 94 | 91 |
5 | 95 | 12 | 98 | 2 | 98 | 91 |
6 | 99 | 8 | 95 | 3 | 97 | 92 |
7 | 96 | 9 | 99 | 2 | 96 | 95 |
8 | 97 | 10 | 95 | 2 | 97 | 93 |
9 | 98 | 8 | 97 | 3 | 98 | 90 |
10 | 96 | 9 | 99 | 1 | 96 | 94 |
Ср. знач. | 96 | 9 | 97 | 2 | 97 | 92* |
Ст. откл. | 1 | 1 | 2 | 1 | 1 | 2 |
Примечание: * p<0,001 (уровень значимости различий контрольной и основных групп на 3 день культивирования)
4. Обсуждение
Моноклональное антитело 3G7H8 ингибирует пролиферацию и жизнеспособность опухолевых клеток на обеих клеточных линиях in vitro: значительно подавляло рост клеток HeLa, а также эффективно подавляло пролиферацию и жизнеспособность клеток K562 по сравнению с контролем in vitro. Эффект зависит от концентрации: при более высокой концентрации (концентрация 2) наблюдается более выраженное подавление роста и жизнеспособности клеток. В контрольной группе клетки продолжают активно делиться и сохраняют высокую жизнеспособность. Эти результаты указывают на перспективность использования моноклонального антитела 3G7H8 для терапии злокачественных новообразований.
Механизмы действия моноклонального антитела 3G7H8, приводящие к подавлению роста и жизнеспособности опухолевых клеток, требуют дополнительного изучения. Необходимо исследовать, какие молекулярные мишени и сигнальные пути вовлечены в реализацию антипролиферативного эффекта данного антитела. Ограничения проведенного исследования включают использование только двух клеточных линий in vitro. Для более полной оценки противоопухолевой активности антитела 3G7H8 требуется расширение спектра тестируемых опухолевых клеток, а также исследование на животных моделях.
Перспективы дальнейших исследований должны быть направлены на более глубокое понимание механизмов взаимодействия антитела 3G7H8 с опухолевыми клетками. Это может включать изучение влияния антитела на ключевые внутриклеточные процессы, такие как метаболизм, апоптоз, ангиогенез и др. Также необходимо получение дополнительных данных, подтверждающих противоопухолевую активность антитела in vivo, что является важным этапом для перехода к клиническим испытаниям.
5. Заключение
Проведенное исследование показало потенциальную противоопухолевую активность разработанного моноклонального антитела 3G7H8 in vitro. Для практического применения результатов исследования необходимо в дальнейшем:
– оптимизация условий культивирования опухолевых клеток in vitro для максимизации эффекта антитела 3G7H8, включая подбор оптимальной концентрации, времени инкубации и т.д.;
– исследование комбинированного применения антитела 3G7H8 с другими противоопухолевыми агентами (химиотерапевтические препараты, таргетные препараты, иммунотерапия) для потенцирования противоопухолевого эффекта;
– оценка профиля безопасности и переносимости антитела 3G7H8 в доклинических исследованиях, необходимая для планирования клинических испытаний.
Таким образом, полученные результаты демонстрируют перспективность дальнейшего изучения моноклонального антитела 3G7H8 в качестве потенциального противоопухолевого агента, особенно для лечения рака шейки матки. Однако для реализации его терапевтического потенциала требуются дополнительные комплексные исследования, направленные на выяснение механизмов действия и получение доклинических данных, подтверждающих эффективность и безопасность.
