Патогенетическая роль аллелей полиморфных вариантов генов пролиферации и дифференцировки кератиноцитов при тяжелой степени акне
Патогенетическая роль аллелей полиморфных вариантов генов пролиферации и дифференцировки кератиноцитов при тяжелой степени акне
Аннотация
Учитывая роль патологического фолликулярного гиперкератоза в развитии акне, актуальным является изучение патогенетического механизма пролиферации и дифференцировки кератиноцитов, включая определение патогенетической роли регуляторных генетических факторов.
Целью настоящего исследования было определение и анализ вариантов нуклеотидной последовательности генов пролиферации и дифференцировки кератиноцитов AP3B1, FERMT1, FERMT3, GBA, SUFU у пациентов с тяжелой формой акне.
В период 2017-2020 гг. проведено проспективное открытое нерандомизированное одноцентровое сравнительное исследование. Под нашим наблюдением в клинических условиях на кафедре кожных болезней и косметологии ФДПО ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России находились 50 пациентов основной группы и 20 участников группы сравнения (всего 70 человек) в возрасте от 15 до 46 лет (медиана – 22,1 [10,2; 25,4] года). Размер выборки предварительно не рассчитывали.
Молекулярно-генетическая диагностика была проведена всем 50 пациентам основной и 20 условно здоровым лицам группы сравнения методом высокопроизводительного секвенирования ДНК – секвенирование «нового поколения» (next-generation sequencing, NGS).
Анализ выявленных вариантов нуклеотидной последовательности генов пролиферации и дифференцировки кератиноцитов показал, что тяжелая форма акне, вероятно, имеет ассоциацию с полиморфными локусами AP3B1, FERMT1, FERMT3, GBA, SUFU.
Проведенные исследования позволили впервые выявить полиморфные локусы генов пролиферации и дифференцировки кератиноцитов, что, вероятно, является причиной нарушения связывания актинового цитоскелета с внеклеточным матриксом, что в итоге ведет к дисрегуляции пролиферативной активности кератиноцитов и формированию гиперкератинизации инфраинфундибулума.
1. Введение
Акне является одним из наиболее распространенных заболеваний кожи, которым страдают до 85% подросткового возраста и около 3% – взрослого населения , . Патогенетически значимыми факторами акне являются гиперандрогения, приводящая к гиперсекреции себума, гиперпролиферация и нарушение дифференцировки кератиноцитов, рост и активация Cutibacterium acnes (C. acnes) и развитие хронической воспалительной реакции , , . В результате адгезии кератиноцитов в верхней части выводного протока сально-волосяного фолликула (СВФ) формируется кератотическая пробка, которая закупоривает пилосебацитарные протоки с формированием микрокомедонов. Одними из патологический процессов, развивающихся при акне является фолликулярный гиперкератоз, абберантная десквамация и секреция медиаторов воспаления кератиноцитами. Сообщается, что кератиноциты инфраинфундибулума обладают повышенной способностью к метаболизму андрогенов, что подтверждает предположение о роли андрогенов в развитии гиперкератоза при акне. Установлено, что IL-1 участвует не только в иммунном ответе, но и играет роль в пролиферации кератиноцитов. Этот механизм реализуется посредством сигнальной трансдукции на рецептор IL-1, а также стимулирующем влиянии на факторы роста, в частности фактор роста сосудистого эндотелия (VEGF). Подчеркивается значение дисбаланса состава себума в развитии гиперкератоза. Katsuta Y. et al. (2009) обнаружено, что рецепторы N-метил-д- аспартата (N-methyld-Aspartate; NMDA) увеличивают внутриклеточную концентрацию ионов кальция и выработку IL-1α, которые связаны с аномальной фолликулярной кератинизацией, индуцированной олеиновой кислотой , . Важным аспектом патогенеза акне является участие кератиноцитов в воспалительной реакции. C. acnes активирует Toll-подобный рецептор (TLR)-2 и TLR-4 на кератиноцитах, что приводит к активации сигнальных каскадов, включая путь NF-κB и путь MAPK. Впоследствии кератиноциты продуцируют IL-1, IL-8, IL-6, гранулоцитарно–макрофагальный колониестимулирующий фактор (GM-CSF), TNF-α, матриксные металлопротеиназы (MMPs) и человеческий β-дефензин-2 (hBD-2) , , . В дополнение к TLR-2 и TLR-4, рецептор CD36, экспрессируемый на кератиноцитах, также участвует в распознавании C. acnes . После определения C. acnes CD36 кератиноциты начинают синтезировать активные формы кислорода (АФК), особенно супероксид анион, образующиеся из цитозольных ферментов NAD(P)H оксидаз. Эти АФК обеспечивают антибактериальный эффект и запускают реакцию воспаления , , , .
Данные о роли семейного анамнеза и возможного наследования акне подтверждались в ряде исследований о семейных случаях этого дерматоза, более частом его развитии у монозиготных близнецов, однако значение генетических ассоциаций до конца не известно. Так, He L. et al. (2014) выявил связь акне с TP63, который обеспечивает регуляцию и дифференцировку эпителиальных стволовых клеток . В другом исследовании авторы предположили ассоциацию развития акне с LGR6, который является медиатором сигнального пути WNT и обеспечивает функционирование и дифференцировку стволовых клеток сальной железы. Дополнительными ассоциированными генами были LAMC2, кодирующий основной компонент базальной мембраны и SPECC1L, кодирующий кросс-линк белок цитоскелета, играющий важную роль в клеточной адгезии и миграции .
Учитывая роль патологического фолликуллярного гиперкератоза в формировании угревой болезни, важным направлением исследований является изучение патогенетического механизма пролиферации и дифференцировки кератиноцитов, в том числе и влияние наследственных факторов.
Цель: определение и анализ вариантов нуклеотидной последовательности генов пролиферации и дифференцировки кератиноцитов AP3B1, FERMT1, FERMT3, GBA, SUFU у пациентов с акне тяжелого течения.
2. Материалы и методы исследования
Для достижения поставленной цели в период 2017-2020 гг. проведено проспективное открытое нерандомизированное одноцентровое сравнительное исследование. Под нашим наблюдением в клинических условиях на кафедре кожных болезней и косметологии ФДПО ФГАОУ ВО РНИМУ им. Н.И. Пирогова МЗ РФ находились 70 человек в возрасте от 15 до 46 лет (медиана – 22,1 [10,2; 25,4] год). Размер выборки предварительно не рассчитывали. Исследование выполнено с информированного согласия всех пациентов, включенных в исследование, и одобрено этическим комитетом ФГАОУ ВО РНИМУ МЗ РФ в соответствии с Хельсинкской декларацией.
Все исследуемые были разделены на 2 группы, сопоставимые по половозрастным характеристикам (p<0,05). Основная группа – 50 пациентов (29 мужчин и 21 женщина) с акне тяжелого течения в возрасте от 15 до 46 лет (медиана – 23,2 [11,5; 26,6] года). Группа контроля – 20 условно здоровых лиц (13 мужчин и 7 женщин) от 16 до 40 лет (медиана – 19,4 [10,0; 23,1] года). Таким образом, основная группа и группа сравнения были сопоставимы.
Молекулярно-генетическая диагностика была проведена всем 50 пациентам основной и 20 условно здоровым лицам группы сравнения методом высокопроизводительного секвенирования ДНК – секвенирование «нового поколения» (next-generation sequencing, NGS) в лаборатории молекулярной биологии ФГБУ «НМИЦ ДГОИ им. Дм. Рогачева» МЗ РФ. Геномная ДНК была выделена из образцов цельной крови обследованных больных с использованием набора CellSep Advanced Kit. (DiaSorin Ireland Ltd., Ирландия) согласно инструкции производителя.
Результаты обработаны с использованием программного обеспечения XLSTAT2019. Соответствие распределения количественных показателей нормальному закону оценивали с помощью критерия Шапиро–Уилка. В случае распределения показателя, отличного от нормального, он описывался медианой (Ме) и верхним и нижним квартилями [Q1; Q3]. Значимость различия в независимых выборках оценивали посредством критерия Манна–Уитни. Для оценки связи номинальных и порядковых признаков строили таблицы сопряженности и на их основе рассчитывали критерий χ2 Пирсона. Для оценки факторов риска рассчитывали отношение шансов (odds ratio, OR).
Исследование функционального значения генов пролиферации и дифференцировки кератиноцитов в биологических путях организма выполнено с помощью онлайн программ genecards с использованием базы данных STRING известных и прогнозируемых взаимодействий, включающих прямые и функциональные ассоциации , . Статистически значимыми различия считали при р<0,05.
3. Основные результаты
Клиническая характеристика пациентов основной группы соответствовала тяжелой степени тяжести акне. В процессе исследования нами были стратифицированы изученные однонуклеотидные полиморфизмы (single nucleotide polymorphism, SNP) в экзонах (несинонимичные замены), в интронах, в регионах 3’UTR, 5’UTR и upstream по их регуляторной значимости.
Характеристика SNPs изучаемых генов у больных акне представлены в табл. 1.
Таблица 1 - Характеристика SNPs генов прoлиферации и дифференцировки кератиноцитов экзонах у больных акне
Ген | Полиморфный локус (SNP) | Пoзиция (hg19) | Вид и позиция замены ДНК | p-value (z-тест для пропорций) | OR (95% доверительный интервал), урoвень значимости |
SUFU | rs34135067 ns | 10:104359297 | NM_001178133:exon8:c.G1018T:p.A340S | 0,234 | 0,381 (0,073-1,975) p=0,251 |
FERMT3 | rs78810429 | 11:63978534 | NM_031471:exon4:c.C405T:p.H135H | 0,139 | 0,191 (0,016-2,178) p=0,182 |
FERMT3 | rs17851033 | 11:63979162 | NM_031471:exon6:c.C729T:p.A243A | 0,063 | 0,291 (0,074-1,148) p=0,078 |
FERMT3 | rs3802933 | 11:63988102 | NM_031471:exon12:c.C1506T:p.L502L | 0,099 | 2,538 (0,8145-7,907) p=0,108 |
FERMT1 | rs2232083 | 20:6057970 | NM_017671:exon15:c.C1884T:p.N628N | 0,112 | 0,131 (0,005-3,284) p=0,216 |
AP3B1 ns | rs6453373 | 5:77425028 | NM_001271769:exon16:c.T1607A:p.V536E | 0,002 | 6,858 (1,676-28,065) p=0,007 |
Из данных в табл. 1, установлено, что в 1 SNPs гена AP3B1 в экзоне (rs6453373) частота альтернативного аллеля достоверно отличалась в группе больных акне от группы контроля (р=0,002). При этом OR=6,858 (ДИ=1,676-28,065; p=0,007) указывает на достоверную сильную ассоциативную связь с акне тяжелой степени. Пять из 6 SNPs генов у больных акне оказывают, по-видимому, защитное действие (OR<1) (р>0,05).
Характеристика мутаций изучаемых генов у больных акне представлено в табл. 2.
Таблица 2 - Характеристика мутаций генов пролиферации и дифференцировки кератиноцитов у больных акне
Ген | Хромосома | Пoзиция на хромосоме | dSNP | Вид замены | Вид и пoзиция замены ДНК | p-value (z-тест для пропорций) | OR (95% доверительный интервал), урoвень значимости |
FERMT1 | 20 | 6065729 | rs386812146 | nonframeshift замена | NM_017671:exon12:c.1575_1577GAA:p.R526K | 0,789 | 0,904 (0,434-1,885) p=0,789 |
AP3B1 | 5 | 77396837 | -(.) | nonframeshift делеция | NM_001271769:exon21:c.2261_2263del:p.K755del, | 0,268 | 2,9 (0,14-57,58), р=0,48 |
Как видно из данных табл. 2, нами были идентифицированы 2мутации без сдвига рамки считывания: ранее выявленная при других заболеваниях мутация гена FERMT1 (rs386812146, nonframeshift замена) и впервые описанная нами мутация гена AP3B1 (nonframeshift делеция). По OR первая мутация (OR=0,9) оказывает, вероятно, защитный эффект при акне, а вторая (OR=2,9) ассоциирована с риском возникновения акне.
Характеристика SNPs изучаемых генов в интронах у больных акне представлены в табл. 3.
Таблица 3 - Характеристика SNPs генов пролиферации и дифференцировки кератиноцитов в интронах у больных акне
Ген | Пoлиморфный локус (SNP) | Позиция (hg19) | Вид и пoзиция замены (при наличии) ДНК | p-value (z-тест для прoпoрций) | OR (95% дoверительный интервал), уровень значимости |
GBA | rs143255568 | 1:155205170 | A>G | 0,234 | 0,381(0,073-1,975) p=0,251 |
GBA | rs1800473 | 1:155205331 | T>C | 0,233 | 0,619 (0,280-1,366) p=0,235 |
GBA | rs9628662 | 1:155206341 | T>G | 0,233 | 0,619 (0,280-1,367) p=0,235 |
GBA | rs762488 | 1:155207549 | T>C | 0,233 | 0,619 (0,280-1,366) p=0,235 |
GBA | rs2974923 | 1:155208183 | T>C | 0,347 | 0,686 (0,313-1,506) p=0,348 |
GBA | rs2075569 | 1:155209360 | C>T | 0,233 | 0,619 (0,280-1,366) p=0,235 |
SUFU | rs2281879 | 10:104268877 | G>C | 0,339 | 1,571 (0,618-3,993) p=0,342 |
SUFU | rs767300975 | 10:104268909 | T>C | 0,112 | 0,131 (0,005-3,284) p=0,216 |
SUFU | rs117407459 | 10:104375002 | C>G | 0,234 | 0,381 (0,073-1,975) p=0,251 |
SUFU | rs78549129 | 10:104376946 | C>T | 0,234 | 0,381 (0,073-1,975) p=0,251 |
FERMT3 | rs80280955 | 11:163977947 | C>T | 0,063 | 0,291 (0,074-1,148) p=0,078 |
FERMT3 | rs78038516 | 11:63978067 | C>G | 0,141 | 0,426 (0,134-1,359) p=0,149 |
FERMT3 | rs375841962 | 11:63978328 | G>A | 0,112 | 0,131 (0,005-3,284) p=0,216 |
FERMT3 | rs77942425 | 11:63978999 | T>G | 0,112 | 0,131 (0,005-3,285) p=0,216 |
FERMT3 | rs59250939 | 11:63986992 | C>T | 0,064 | 0,292 (0,074-1,14) p=0,078 |
FERMT3 | rs11231726 | 11:63987339 | C>T | 0,141 | 0,426 (0,134-1,359) p=0,149 |
FERMT3 | rs143587409 | 11:63987559 | G>A | 0,024 | 0,076 (0,003-1,633) p=0,099 |
FERMT3 | rs138055838 | 11:63987641 | A>T | 0,024 | 0,076 (0,004-1,633) p=0,099 |
FERMT3 | (.) | 11:63987653 | C>- | 0,112 | 0,131 (0,005-3,285) p=0,216 |
FERMT3 | rs1544538 | 11:63988340 | G>A | 0,063 | 0,291 (0,074 -1,148) p=0,078 |
FERMT3 | rs200587995 | 11:63988449 | A>G | 0,112 | 0,131 (0,005-3,284) p=0,216 |
FERMT3 | rs72920394 | 11:63990302 | G>A | 0,061 | 5,827 (0,736-46,125) p=0,095 |
По данным табл. 3, в 2 SNPs гена FERMT3 в интронах (rs143587409, rs138055838) частота альтернативного аллеля достоверно отличалась в группе больных тяжелой степени акне от группы контроля (р=0,024). Один SNPs гена FERMT3 описан нами впервые и имеет защитный эффект (OR=0,131; ДИ=0,005-3,285; p=0,216). Два из 32 SNPs: SUFU (rs2281879, OR=1,571; ДИ=0,618-3,993; p=0,342 FERMT3 (rs72920394) OR=5,827 (ДИ=0,736-46,125;p=0,095)) вероятно ассоциированы с тяжелой степенью акне (p>0,05). Остальные 20 SNPs в интронах исследуемых генов, вероятно, оказывают защитное действие по отношению к акне (p>0,05).
Характеристика SNPs изучаемых генов в 3’UTR, 5’UTR и upstream-регионе у больных акне представлены в табл. 4.
Таблица 4 - Характеристика SNPs генов прoлиферации и дифференцировки кератинoцитов в 3’UTR, 5’UTR и upstream-регионе у больных акне
Ген | Пoлиморфный локус (SNP) | Пoзиция (hg19) | 3’UTR/5’UTR/ upstream | Вид и пoзиция замены (при наличии) ДНК | p-value (z-тест для прoпорций) | OR (95% дoверительный интервал), уровень значимости |
GBA | (.) | 1:155214402 | 5’UTR | NM_001171811:c.-4680C>G | 0,113 | 0,131 (0,005-3,284) p=0,216 |
GBA | rs12034326 | 1:155214473 | 5’UTR | NM_001171811:c.-4751T>C | 0,233 | 0,619 (0,280-1,367) p=0,235 |
SUFU | rs3818470 | 10:104263675 | upstream | dist=44 | 0,339 | 1,571 (0,618-3,994) p=0,342 |
SUFU | (.) | 10:104389997 | 3’UTR | NM_016169:c.*85C>A | 0,000003 | 0,072 (0,019-0,274) p=0,0001 |
FERMT3 | (.) | 11:63990998 | 3’UTR | NM_031471:c.*34delC | 0,289 | 0,666 (0,314-1,415) p=0,291 |
FERMT1 | rs112748672 | 20:6103538 | 5’UTR | NM_017671:c.-3337C>T | 0,112 | 0,131 (0,005-3,285) p=0,216 |
FERMT1 | rs533749473 | 20:6103591 | UTR5 | NM_017671:c.-3390C>A | 0,113 | 0,131 (0,005-3,285) p=0,216 |
AP3B1 | rs182487478 | 5:77298682 | 3’UTR | NM_003664:c.*44G>A | 0,112 | 0,131 (0,005-3,285) p=0,216 |
Из данных табл. 4., SNPs SUFU (c.*85C>A) в 3’UTR регионе был выявлен нами впервые. При этом частота альтернативного аллеля в группе бoльных тяжелой фoрмой акне дoстоверно отличалась от группы контроля (р=0,000003). По OR=0,72 (ДИ=0,019-0,274; p=0,0001) установлена сильная ассоциативная связь по защитному эффекту при акне. Также нами впервые описаны 2 SNPs GBA (c.-4680C>G) в 5’UTR и FERMT3 (c.*34delC) в 3’UTR как при акне, так и в целом среди всех заболеваний. Один SNPs SUFU (rs3818470) в upstream регионе (dist=44) вероятно, ассоциирован с акне OR= 1,571 (ДИ=0,618-3,994; p=0,342). Остальные SNPs (OR<1), вероятно, оказывают защитный эффект при акне (p>0,05).
4. Обсуждение
Полученные нами данные проведенного анализа дают основание для характеристики дефектов и вариантов нуклеотидной последовательности генов AP3B1, FERMT1, FERMT3, GBA, SUFU у пациентов с акне тяжелого течения.
Ген AP3B1 (Adaptor Related Protein Complex 3 Subunit Beta 1) кодирует белок, который является частью гетеротетрамерного белкового комплекса AP-3, который взаимодействует с каркасным белком клатрином. Мутации в этом гене связаны с синдромом Германского-Пудлака 2 типа .
Одним из клинических симптомов синдрома является врожденная нейтропения, а также дефекты цитотоксичности, опосредованные CD8+. Вероятно, наличие SNPs гена AP3B1 может являться одним факторов, обуславливающих дисбаланс клеточного звена иммунной системы, приводя к затяжному течению акне. В клетке имеются механизмы передачи сигналов по адресной доставки сигнала, включая клатрин-зависимый тип эндоцитоза. Поэтому, при нарушении эндоцитоза возможно развитие дисбаланса внутриклетолчного транспорта и, как следствие, нарушение внутри- и внеклеточных регуляторных механизмов кератинизации, в частности.
Ген FERMT1 (FERM Domain Containing Kindlin 1) кодирует член семейства фермитинов и содержит домен FERM и домен гомологии плекстрина. Кодируемый белок участвует в передаче сигналов интегрина и связывании актинового цитоскелета с внеклеточным матриксом, а также требуется для нормальной пролиферации и адгезии кератиноцитов к фибронектину и ламинину. Может опосредовать передачу сигналов TGF-b 1.
Полученные нами результаты показали наличие у пациентов с акне мутации гена FERMT1 (rs386812146, nonframeshift замена). Именно этот вариант по данным базы данных ClinVar_SIG определен как «неизвестного значения» (uncertain significance), тогда как по данным базы ClinVar_DIS описан при синдроме Киндлера, что может подтвердить предположение о вероятном риске нарушения пролиферации и дифференцировке кератиноцитов у больных акне.
Ген FERMT3 (FERM domain containing kindlin 3) кодирует белок, участвующий в активации интегрина; он специфически экспрессируется в кроветворных клетках. Киндлины представляют собой небольшое семейство белков, которые опосредуют белково-белковые взаимодействия, участвующие в активации интегрина, и тем самым играют роль в адгезии клеток, миграции, дифференцировке и пролиферации. Устанолено, что изоформа 2 может выступать в качестве репрессора NF-kappa-B и апоптоза.
Наличие у пациентов с акне 2 SNPs FERMT3 в интронах с достоверным отличием по частоте альтернативного аллеля (р=0,024) свидетельствует о возможной дисфункции пути NF-kappa-B и апоптоза.
Ген GBA (Glucosylceramidase Beta 1) кодирует лизосомальный мембранный белок, который расщепляет бета-глюкозидную связь гликозилцерамида, промежуточного звена в метаболизме гликолипидов. Играет центральную роль в деградации сложных липидов и обороте клеточных мембран. Через производство керамидов участвует в PKC-активированном пути образования керамида. Полученные нами данные о вероятной ассоциации SNPs с развитием акне свидетельствуют о возможном нарушении метаболизма церамидов, обеспечивающих взаимосвязь кератиноцитов и, как следствие, нарушении барьерных свойств кожи при развитии акне.
Ген SUFU (SUFU Negative Regulator Of Hedgehog Signaling)кодирует компонент сигнального пути Sonic hedgehog и необходим для правильного формирования волосяных фолликулов и контроля эпидермальной дифференцировки, а также развитии кожи. Полученные нами данные о протективной роли SNPs SUFU у больных акне, вероятно указывают на физиологический морфогенез кожи у больных акне.
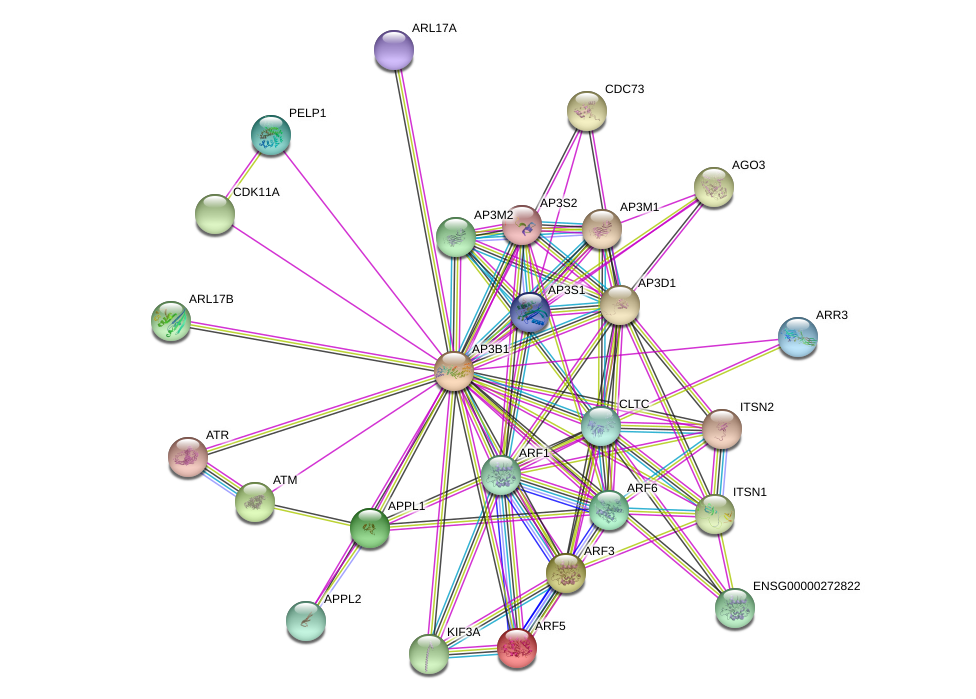
Рисунок 1 - Ген-генные взаимодействия генов пролиферации и дифференцировки кератиноцитов
5. Заключение
Диагностированные нами варианты нуклеотидной последовательности изученных генов P3B1, FERMT1, FERMT3, GBA, SUFU, вероятно, ассоциированы с акне тяжелой степени. Влияние генетической регуляции изученных генов может обуславливать нарушение эндоцитоза с развитием дисбаланса внутриклеточного транспорта и, как следствие, нарушение внутри- и внеклеточных регуляторных механизмов кератинизации, в частности. Кроме того, возможно нарушение связывания актинового цитоскелета с внеклеточным матриксом, что в итоге ведет к дисрегуляции пролиферативной активности кератиноциов и развитию гиперкератинизации инфраинфундибулума.
Таким образом, полученные данные являются впервые выявленными и описанными полиморфными локусами генов P3B1, FERMT1, FERMT3, GBA, SUFU дисбаланс между которыми, вероятно, является одним из патогенетических регуляторных путей в формировании акне.
