ДИФФЕРЕНЦИАЦИЯ ТРЕХ ПОРОД БОРЗЫХ С ИСПОЛЬЗОВАНИЕМ ISSR-PCR МАРКЕРОВ
ДИФФЕРЕНЦИАЦИЯ ТРЕХ ПОРОД БОРЗЫХ С ИСПОЛЬЗОВАНИЕМ ISSR-PCR МАРКЕРОВ
Аннотация
Для современного собаководства вопрос сохранения чистоты пород по-прежнему актуален. Методы устранения ошибок происхождения, такие как генотипирование микросателлитных локусов, успешно используются уже давно, но проблемы формирования и идентификации «генетического стандарта породы» до сих пор остаются нерешенными. Хотя кинологическими организациями предпринимаются определенные меры по контролю и устранению ошибок происхождения, они не решают проблему определения породной принадлежности животных. Одним из направлений в развитии методов, простых и достаточно надежных для решения подобных вопросов, является использование методов геномного сканирования (полилокусного генотипирования) высокополиморфных геномных участков, к которым относятся фрагменты ДНК, фланкированные инвертированными повторами микросателлитов (Inter-Simple Sequence Repeats – ISSR). В данной работе исследовался полиморфизм фрагментов ДНК, фланкированных инвертированными повторами микросателлитов и его дальнейшее сравнение у собак трех пород борзых: русская псовая борзая, хортая борзая и грейхаунд для выявления потенциальных породоспецифичных маркеров. Данные породы были выбраны, поскольку принадлежат к одной группе, а также предполагается, что они близки на генетическом уровне, так как при формировании этих пород приливались крови одних к другим. В результате были выявлены некоторые различия по использованным маркерам (АСС)6Т, (САС)7Т, (АСС)6С у трех пород борзых и соответствие полученных ранее данных об их происхождении, что свидетельствует об эффективности этих ДНК маркеров и позволяет рассчитывать на то, что использование выбранных микросателлитных локусов может быть применено в дальнейшем для формирования «генофондного стандарта» как дополнительной характеристики при оценке породных особенностей собак.
1. Введение
Собаководство демонстрирует выдающиеся селекционные достижения на сегодняшний день. Международная кинологическая федерация (FCI) признает более 440 различных пород собак. Несмотря на то, что породы, не только собак, но и многих животных в целом, существуют уже давно, до сих пор ведутся споры об определении этого термина. Одно из определений относится к определенной группе домашних животных, которые имеют общий внешний вид (фенотип), сходное поведение и/или другие характеристики, отличающие их от других организмов того же вида. Например, FAO (Продовольственная и сельскохозяйственная организация ООН) трактует этот термин несколько абстрактно, подчеркивая, что он не может быть определен строго и однозначно. Так, по FAO порода – это внутривидовая группа сельскохозяйственных животных с определяемыми и опознаваемыми внешними характеристиками, которые позволяют на основании визуальной оценки отличить эту группу от других таким же образом определенных групп в пределах того же вида, либо группа, географическое и/или культурное отделение которой от фенотипически сходных групп привело к тому, что была признана ее самобытная идентичность . Одной из потребностей современной племенной работы является необходимость точно знать родословную отдельной собаки, которая будет или, по крайней мере, может быть использована в разведении. Это способствует не только чистоте породы, но и необходимо для регулирования искусственного отбора в племенных парах с целью получения желаемых признаков. В настоящее время существует возможность установить наличие или отсутствие кровных связей между несколькими особями, для чего чаще всего используются специализированные панели генетических маркеров. В собаководстве к ним в первую очередь относятся списки микросателлитных локусов, рекомендованные Международным обществом генетики животных (ISAG) . В настоящее время нигде в мире не существует признанного генетического стандарта породы, который мог бы решить эту проблему раз и навсегда. Уже появились коммерческие тесты для идентификации пород на основе анализа SNP, но нет открытых данных об их достоверности, а значит, нет и описаний особенностей генофонда пород. Также важно отметить относительную дороговизну метода из-за необходимости использования ДНК-чипов, что только усугубляет проблему , . Поэтому перспективным является поиск молекулярно-генетических маркеров, которые могут точно представлять значимые и последовательные различия между породами и в то же время быть простыми, удобными и недорогими в использовании. ISSR-PCR маркеры могут стать возможным решением этой проблемы , , , .
2. Методы и принципы исследования
Исследование проводилось на кафедре зоологии РГАУ-МСХА имени К.А. Тимирязева. В качестве материала использовались образцы буккального эпителия собак трех пород – русской псовой борзой, грейхаунда и хортой борзой (табл. 1). Для выделения ДНК использовался набор реагентов для выделения ДНК на сорбенте «S-Сорб» («Синтол», Россия).
Таблица 1 - Количество изучаемых собак
Порода | Кол-во особей (шт.) | Кол-во кобелей (шт.) | Кол-во сук (шт.) |
рпб* | 18 | 8 | 10 |
грейхаунд | 18 | 9 | 9 |
хортая | 19 | 9 | 10 |
Примечание: *рпб – русская псовая борзая
Для определения полиморфизма ДНК использовались ISSR-PCR-маркеры. Были взяты следующие праймеры: (ACC)6C, (ACC)6T, (CAC)7T. Выбор этой «тройки» осуществлён согласно правилам подбора праймеров, особенное внимание обратили на GC-состав. Оптимальным считается 40-60% для точности отжига в полимеразной цепной реакции (ПЦР). Фактический состав использованных нами праймеров – около 65%. Два из них – (ACC)6C и (ACC)6T – обладают одинаковой коровой последовательностью (АСС), но разными якорными последовательностями (Т и С). При получении разных спектров фрагментов ДНК по этой паре праймеров, несмотря на отличие в один нуклеотид, мы можем говорить о высокой точности отжига.
Для постановки реакции применялись наборы реагентов для проведения ПЦР-РВ («Синтол», Россия). ПЦР проводили с использованием амплификатора Tercik DNA-Technology (Россия) по следующей программе:
1) первичная денатурация: t = 94°C, 2 мин;
2) денатурация: t = 94°C, 30 с;)
3) отжиг: t = 58°C, 30 с;
4) элонгация: t = 72°C, 2 мин - 40 циклов;
5) окончательная элонгация: t = 72°C, 10 мин.
Разделение полученных ампликонов по молекулярной массе проводили методом горизонтального электрофореза в 1,5% агарозном геле с окрашиванием бромистым этидием. Для определения длины фрагментов использовали маркер молекулярной массы 100 bp + 1,5 Kb + 3 Kb (12 фрагментов от 100 до 3000 bp) (Сибэнзим, Россия) (рис. 1). Статистическую обработку данных проводили с помощью программы Statistica.
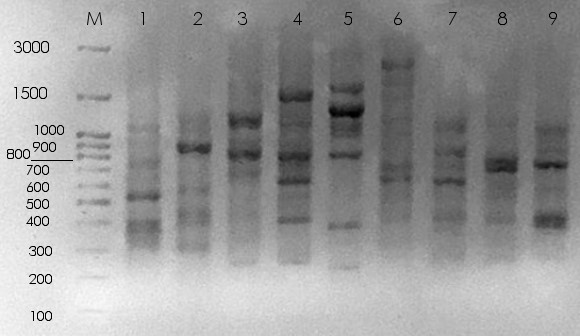
Рисунок 1 - Спектры фрагментов ДНК борзых, фланкированных микросателлитом (АСС)6С:
1-3 – хортая; 4-6 – грейхаунд; 7-9 – русская псовая; М – маркер молекулярных масс
3. Основные результаты
Исследование включало генотипирование 55 борзых (18 русских псовых борзых, 18 грейхаундов, 19 хортых борзых) с использованием трех праймеров (ACC)6C, (ACC)6T, (CAC)7T. Результаты представлены в таблице 2.
Таблица 2 - Результаты генотипирования трёх пород борзых
Праймер | Порода | Границы спектра, п. о. | Амплифицируемые фрагменты (ампликоны) | ДПЛ*, % | Уникальные локусы, п. о. | ||
Всего | Консервативные | Полиморфные | |||||
(ACC)6T | рпб** | 3000-350 | 21 | 1 | 20 | 95,2 | 1175-1120, 700-680 |
грейхаунд | 3000-300 | 22 | 0 | 22 | 100 | 1900-1800, 1550-1500 | |
хортая | 2800-350 | 19 | 1 | 18 | 94,7 | 2800-2700, 2600-2500 | |
(САС)7Т
| рпб | 3000-300 | 24 | 0 | 24 | 100 | – |
грейхаунд | 3000-300 | 25 | 0 | 25 | 100 | 2550-2500 | |
хортая | 2925-300 | 23 | 1 | 22 | 95,7 | 2250-2200 | |
(ACC)6C
| рпб | 2550-400 | 15 | 0 | 15 | 100 | – |
грейхаунд | 2650-200 | 18 | 0 | 18 | 100 | 2650-2600 | |
хортая | 1650-200 | 15 | 0 | 15 | 100 | – | |
(ACC)6G | рпб | 2550-400 | 15 | 0 | 15 | 100 | – |
грейхаунд | 800-350 | 6 | 0 | 6 | 100 | – | |
хортая | 800-100 | 7 | 0 | 7 | 100 | – | |
Примечание: *ДПЛ – доля полиморфных локусов; **рпб – русская псовая борзая
По праймеру (ACC)6T во всём спектре у русских псовых борзых выявлено 8 фрагментов ДНК (среднее число фрагментов – 5), у грейхаундов – 10 (среднее – 4), у хортых – 10 (среднее – 4). Границы спектра у русской псовой от 3000 до 350 п.о., у грейхаунда 3000 дп 300 п.о., у хортой борзой от 2800 до 350 п.о. Уникальные локусы встречаются у каждой породы: у рпб эти локусы представлены длиной 1175-1120 п.о. и 700-680 п.о., у грейхаунда 1900-1800 п.о. и 1550-1500 п.о., а у хортой 2800-2700 п.о. и 2600-2500 п.о. У русской псовой борзой: фрагменты средней длины; у грейхаунда: длинные; у хортой: длинные, более длинные, чем у английской борзой. Консервативные последовательности обнаружены только у русской псовой борзой и у хортой борзой. Количество полиморфных фрагментов ДНК у русской псовой равно 7 единицам, у грейхаунда – 10, у хортой – 9. Доля полиморфных локусов у русской псовой борзой составляет 87,5 %, у грейхаунда – 100 %, у хортой борзой 90 %.
По праймеру (САС)7Т во всём спектре у русских псовых борзых обнаружили 10 фрагментов ДНК (среднее число фрагментов – 4), у грейхаундов – 12 (среднее – 5), у хортых – 16 (среднее – 4). Границы спектра у русской псовой борзой составили от 3000 до 300 п.о., у грейхаунда те же границы, что и у рпб, у хортой борзой 2925-300 п.о. Уникальные локусы для русской псовой борзой не обнаружены, у двух других пород присутствуют длинные фрагменты, при этом у английской борзой они длиннее, чем у хортой, примерно на 300 пар оснований. Соответственно у грейхаунда длина локуса составила 2550-2500 п.о., а у хортой 2250-2200 п.о. Консервативные последовательности характерны только для хортой борзой. Полиморфные фрагменты ДНК представлены в количестве: у русской псовой – 10 единиц, у грейхаунда – 12, у хортой – 15. Доля полиморфных локусов у рпб – 100 %, у грейхаунда 100 %, у хортой борзой – 93,75 %.
По праймеру (ACC)6C во всём спектре у русских псовых борзых наблюдали 8 фрагментов ДНК (среднее число фрагментов – 3), у грейхаундов – 10 (среднее – 6), у хортых – 8 (среднее – 5). Границы спектра у русской псовой борзой представлены от 2550 до 400 п.о., у грейхаунда от 2650 до 200 п.о. У хортой борзой самые узкие границы спектра – 1650-200 п.о. Уникальные локусы выявлены только для грейхаундов – длинные фрагменты – 2650-2600 п.о. Консервативные последовательности не обнаружены ни для одной из пород. Количество полиморфных фрагментов ДНК у рпб – 8 единиц, у грейхаунда 10 единиц, у хортой так же, как и у русской псовой – 8 единиц. Доля полиморфных у всех трех пород составила 100 %.
Далее нами был произведён расчёт индекса PIC (Polymorphous Information Content – полиморфное информационное содержание), отражающим степень гетерозиготности локусов, по следующей формуле: PIC=2f(1-f),
где f – это частота рецессивного аллеля. Она, в свою очередь, рассчитывается по формуле: f=√r, где r - частота рецессивных генотипов (за неё принимается доля животных, у которых фрагмент ДНК с данной длиной отсутствует в выбранном спектре ампликонов).
По результатам расчётов (табл. 3) видно, что «внутри» каждого праймера достоверных различий в полиморфизме по породам нет. Несмотря на то, что по маркеру (ACC)6C наблюдается большее значение PIC для каждой из борзых по сравнению с двумя другими маркерами, достоверные различия по нему с праймерами (ACC)6T и (CAC)7T обнаружены только для грейхаундов – со всеми породами – и в одном случае – для хортой (при сравнении с PIC для хортых по праймеру (ACC)6T).
Таблица 3 - Значения PIC по трём праймерам
Порода / Праймер | (ACC)6T | (САС)7Т | (ACC)6C |
Русская псовая борзая | 0,173 ± 0,029 | 0,187 ± 0,024 | 0,241 ± 0,031 |
Грейхаунд | 0,1852 ± 0,028 | 0,2486 ± 0,024 | 0,2991-3,5-7± 0,031 |
Хортая борзая | 0,1773-4 ± 0,031 | 0,1747 ± 0,032 | 0,2794 ± 0,037 |
Примечание: 1, 3 - p≤0,001; 2, 5, 7 - p≤0,01; 4, 6 - p≤0,05
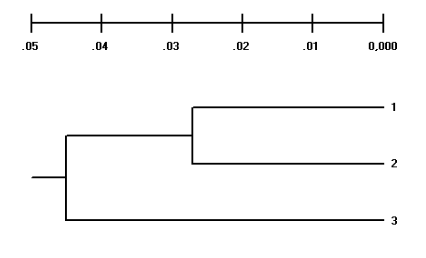
Рисунок 2 - Дендрограмма генетических расстояний между борзыми по всем праймерам
Примечание: русская псовая борзая – 1; грейхаунд – 2; хортая борзая – 3
4. Заключение
Использование в полимеразной цепной реакции праймеров с идентичными коровыми мотивами и отличающихся только «якорным» нуклеотидом приводит к различным спектрам продуктов амплификации, что свидетельствует о точности отжига последовательностей (ACC)6T и (ACC)6C.
Для изученных представителей трех пород борзых в спектрах продуктов амплификации были выявлены следующие породно-специфические фрагменты геномной ДНК, фланкированные инвертированными повторами микросателлитных локусов: по маркеру (АСС)6Т у русской псовой борзой 2 уникальных локуса – 1175-1120 п.о. и 700-680 п.о., у грейхаунда также 2 – 1900-1800 п.о. и 1550-1500 п.о., и у хортой борзой 2 локуса – 2800-2700 п.о. и 2600-2500 п.о. По маркеру (САС)7Т уникальные локусы найдены только у грейхаунда – 2550-2500 п.о., и у хортой – 2250-2200 п.о. По маркеру (АСС)6С уникальный локус был найден только у грейхаунда – 2650-2600 п.о.
Было обнаружено, что статистика PIC значительно отличается между фрагментами геномной ДНК у сравниваемых пород. Несмотря на то, что по маркеру (ACC)6C наблюдалась большее значение PIC для каждой из борзых по сравнению с двумя другими маркерами, достоверные различия по нему с праймерами (ACC)6T и (CAC)7T обнаружены только для грейхаундов – со всеми породами – и в одном случае – для хортой (при сравнении с PIC для хортых по праймеру (ACC)6T). Наибольшая ожидаемая гетерозиготность для вех праймерой была выявлена у грейхаундов. По маркерам (АСС)6Т и (САС)7Т этот параметр был выше у русской псовой борзой нежели у хортой, а по праймеру (АСС)6С наоборот – у хортой борзой выше, чем у русской псовой.
На основе полученных данных была построена дендрограмма генетических связей трех исследованных пород борзой, в которой хортая борзая генетически дифференцирована от русской псовой и грейхаунда. На основании этого можно утверждать, что прививка крови грейхаунда к русской псовой борзой в процессе формирования породы имела более длительный характер, чем к хортой борзой.
Данное исследование может стать фундаментом для разработки в будущем генетических породных стандартов для собак, эффективных и удобных методов породного анализа, что в дальнейшем должно привести к принципиальному изменению подходов в организации племенной работы, позволяя исключить из неё массу ошибок.
