ОБЗОР ВАРИАНТОВ ЛЕЧЕБНОЙ ТАКТИКИ ПРИ АХАЛАЗИИ КАРДИИ IV СТАДИИ: КАРДИОПЛАСТИКА ИЛИ ЭКСТИРПАЦИЯ
Анищенко В.В.1, Ковган Ю.М.2, Ким Д.А.3
1ORCID: 0000-0003-1178-5205, Доктор медицинских наук, 2ORCID: 0000-0003-1993-6848, Аспирант, 3ORCID: 0000-0002-5296-9767, Аспирант, Новосибирский Государственный Медицинский Университет, НУЗ "Дорожная клиническая больница на ст. Новосибирск-Главный ОАО "РЖД"
ОБЗОР ВАРИАНТОВ ЛЕЧЕБНОЙ ТАКТИКИ ПРИ АХАЛАЗИИ КАРДИИ IV СТАДИИ: КАРДИОПЛАСТИКА ИЛИ ЭКСТИРПАЦИЯ
Аннотация
Ахалазия кардии - доброкачественное нервно-мышечное заболевание пищевода, характеризующееся медленным прогрессирующим течением и поздней обращаемостью пациента за квалифицированной медицинской помощью. В связи с этим большое количество пациентов поступает с терминальной стадией болезни, которая диагностируется при наличии сигмовидного искривления пищевода. Мегаэзофагус на фоне ахалазии кардии намного хуже откликается на лечебные процедуры в сравнении с начальными стадиями болезни. В этой ситуации ряд хирургов методикой выбора считают экстирпацию пищевода, тогда как другие все же утверждают о эффективности кардиопластических операций.
Ключевые слова: ахалазия кардии, кардиопластика, экстирпация, рак пищевода.Anishchenko V.V.1, Kovgan Y.M.2, Kim D.A.3
1ORCID: 0000-0003-1178-5205, MD, 2ORCID: 0000-0003-1993-6848, Postgraduate student, 3ORCID: 0000-0002-5296-9767, Postgraduate student, Novosibirsk State Medical University, "RR" OJSK Railway Clinical Hospital on the station Novosibirsk-Glavniy
REVIEW OF OPTIONS OF THERAPEUTIC TACTICS IN ACHALASIA STAGE IV: CARDIOPLASTY OR EXTIRPATION
Abstract
Achalasia is a benign neuromuscular diseases of the esophagus which can be characterized by a slow progressive course and the fact that patients seek qualified medical help too late. In this connection a large number of patients come when they are suffering from the disease in its final stage which is diagnosed when there is sigmoid curvature of the esophagus. Megaesophagus with background achalasia responds to treatment much worse in comparison with the early stages of the disease. In this situation a number of surgeons consider extirpation of the esophagus as the method of choice, where as others argue and maintain that cardioplasty operations are effective.
Keywords: achalasia, cardioplasty, extirpation, esophageal cancer.Среди современных способов лечения ахалазии кардии можно выделить три основные группы: консервативные, эндоскопические и хирургические методики [11, С. 206], [13, С. 48]. Но до тех пор, пока не будет выяснена конкретная этиология данного заболевания [11, С. 298], [13, С. 40], весь имеющийся арсенал лечебных мероприятий останется исключительно симптоматическим и направленным только лишь на уменьшение давления нижнего пищеводного сфинктера [9, С. 19], [11, С. 298], [13, С. 48], по большей части механическим способом, никак не влияя на работу тела пищевода, где также, как и в области кардии, происходит дегенерация нервных структур [2, С. 83], [9, С. 19], [12, С. 1238].
Консервативная терапия ахалазии кардии имеет весьма ограниченный диапазон эффективности [11, С. 298] и демонстрируют наименьший потенциал в сравнении с другими способами лечения [12, С. 1242]. Среди множества групп различных препаратов: спазмолитики, витамины, стимуляторы перистальтики – наибольшую эффективность продемонстрировали нитраты длительного действия и блокаторы медленных кальциевых каналов [2, С. 84], [11, С. 298], [13, С. 48]. И хотя по современным иностранным рекомендациям, уменьшая тонус нижнего пищеводного сфинктера вдвое, добиться снижения симптомов дисфагии удалось у 50-87% пациентов в зависимости от выбора формы и способа введения препарата, их применение ограничено рядом факторов [11, С. 298]. Кроме практически полной невозможности применения в молодом возрасте, имеются ряд побочных эффектов в виде головной боли, артериальной гипотензии, головокружения. А также тот факт, что в течение полу года их применения происходит снижение эффективности данных препаратов практически в половину, их назначение показано лишь в группе пациентов старческого возраста с абсолютным противопоказанием к любой инвазивной методики по уменьшению тонуса нижнего пищеводного сфинктера или же для снижения симптомов во процессе подготовки к операции [11, С. 298], [12, С. 1242], [13, С. 48]. Также встречаются редкие публикации по применению ингибиторов фосфодиэстеразы, но их применение для лечения ахалазии кардии в данный момент не получило широкого распространения [12, С. 1242].
Среди эндоскопических методик наиболее простой в выполнении, безопасной и подконтрольной процедурой является баллонная дилятация. Ее эффективность достигает 85% при комбинировании нескольких последовательных сеансов с постепенным увеличением диаметра баллона от 3 до 4 см [11, С. 299]. В то же время, уже через год рецидив симптомов отмечает у 30-40% больных, тогда как повторные сеансы имеют значительно меньший эффект [11, С. 299]. Также важно, что все эндоскопические методики в дальнейшем увеличивают сложность кардиопластических операций и повышают риски как интра-, так и послеоперационных осложнений [12, С. 1244], [11, С. 301]. Во-вторых, все представленные эндоскопические методики связанны с повышенным риском развития послеоперационного гастро-эзофагеального рефлюкса на фоне полного или частичного разрушения замыкательной функции кардии [11, С. 301].
В отношении применения ботулинового токсина типа А хотелось бы отметить тот факт, что до сих пор на территории Российской Федерации препарат «Диспорт» не зарегистрирован в качестве средства для применения в гастроэнтерологии и его использование разрешено только в неврологии и косметологии [13, С. 50].
Пероральная эндоскопическая миотомия - самая «молодая» из всех представленных методик, впервые описанная Inoue в 2009 году и на данный момент не имеет достоверных долгосрочных результатов [11, С. 300]. И хотя демонстрирует уровень снижения дисфагии у около 90% пациентов, имеет в среднем установленный по pH-метрии 50% гастро-эзофагеальный рефлюкс с 30% клиническим проявлением эзофагита [6, С. 498].
Все хирургические вмешательства можно разделить на три большие группы: кардиопластические, резекционно-пластические и резекционные операции в различных объемах. Такое разнообразие операций, с одной стороны, говорит о неудовлетворенности хирургов результатами лечения, тогда как с другой – об отсутствии жестких показаний к выбору того или иного типа оперативного вмешательства, а, в-третьих, с некоторыми нерешенными спорными вопросами.
«Золотым стандартом» современного хирургического лечения ахалазии кардии является кардиомиотомия по Геллеру [9, С. 19], [11, С. 300], [12, С. 1244], [13, С. 50], выполняемая, как большинство операций на области кардии, лапароскопическим доступом [6, С. 485], [13, С. 50]. Очевидным «плюсом» данной операции перед большинством остальных хирургических методик является ее относительная простота выполнения и достаточно длительный эффект в плане купирования дисфагии [11, С. 301], [12, С. 1244], [13, С. 50]. Также нужно отметить, что стандартом после выполнения миотомии уже давно считается создание различных видов фундопликационных манжет для защиты от возникновения гастро-эзофагеального рефлюкса, хотя выбор конкретной методики все еще дискутируется [11, С. 304], [12, С. 1244].
На представленной схеме (рис. 1) продемонстрирован современный алгоритм тактики лечения после установления диагноза АК, составленный по сводным данным Американской коллегии гастроэнтерологов и Американского общества гастроинтестинальных и эндоскопических хирургов [11, С. 306-307], [12, С. 1247].
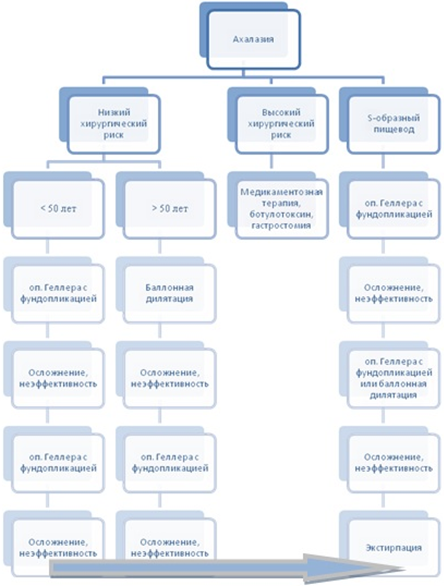
Рис. 1 – современный алгоритм хирургического лечения ахалазии кардии
Но наибольшую тактическую проблему представляет собой именно ситуации, когда была диагностирована IV стадия болезни, характеризующаяся S-образной деформацией пищевода.
В случае толерантности пациента к оперативному лечению его в большинстве случаев начинают с лапароскопической операции Геллера, дополненной неполной задней фундопликацией типа Тупэ 2700 или передней - типа Дор [7, С. 206], [11, С. 304], [12, С. 1244]. По опубликованным данным хорошего и отличного результата у данной категории пациентов после даже повторного вмешательства можно добиться у 40-75% пациентов с IV стадией ахалазии кардии [3, С. 856].
В случае возникновения в послеоперационном периоде такого осложнения, как тяжелый гастро-эзофагеальный рефлюкс, который не снимается подбором адекватной терапии ингибиторов протонной помпы и снижается качество жизни больше, чем имевшаяся до операции дисфагия, пациенту предлагается повторная операцию, но в учреждении более высокого уровня, специализирующемся на данной конкретной патологии [3, С. 857], [7, С. 206].
В ситуации, когда пациент, по прошествии минимальных сроков по купированию послеоперационного отека и пареза в кардиоэзофагеальной зоне, не отметил какого-либо значимого снижения выраженности дисфагии, то это с огромной долей вероятности свидетельствует о технической ошибки в операции (недостаточная миотомия или слишком тугая фундопликация) Пациенту будет, вероятнее всего, предложено несколько сеансов баллонной дилятации, а при их неэффективности или же сразу последующая рекардиомиотомия по Геллеру [3, С. 856], [11, С. 305].
Если же, после описанного круга проведенных мероприятий, пациент все еще не удовлетворен результатом и имеет показания к дальнейшему лечению, то ему будет предложена экстирпация или же варианты эзофагэктомии с заменой удаленного части пищевода на гастральный или колярный трансплантаты [3, С. 856].
Но до сих пор в хирургической литературе встречается множество публикаций, активно пропагандирующих, при установлении диагноза ахалазии кардии IV стадии, сразу же выполнять экстирпацию пищевода [3, С. 856].
По сводной информации единственными абсолютными показаниями к экстирпации пищевода являются [3, С. 857], [11, С. 307], [9, С. 20], [12, С. 1247]:
- Более двух неэффективных хирургических операций с подтвержденным манометрически полным отсутствие перистальтики тела пищевода и как следствие его дилятации более 6 см.
- Развитие тяжелой язвенной стриктуры после неудачно выполненной операции, которая не поддается другому хирургическому или медикаментозному лечению
- Обширная диссекция или перфорация пищевода во время выполнения баллонной дилятации, кардиомиотомии, тракции пищевода. Данное осложнение, в момент того, как оно произошло исключительно сложно диагностировать и чаще оно констатируется уже в ситуации манифестации медиастенита.
- Некроз кардии после введения ботулотоксина встречается менее чем в 1% случаев и скорее всего это редко описываемое осложнение связанно с техническими ошибками в использовании методики.
- Собственное настойчивое желание пациента. Данное показание нельзя назвать в должной мере абсолютным и во многом оно зависит от комплаенса между врачом и пациентом и умения хирурга объяснить пациенту сложившуюся ситуацию, варианты лечения и возможные осложнения после каждой из примененных методик.
Но все же есть и другой взгляд на имеющиеся показания к экстирпации. Главным аргументом «за» удаление пищевода является повышенный риск развития плоскоклеточного рака[2, С. 83], [7, С. 204], [8, С. 2144], [9, С. 19].
По сводным статистическим данным [11, С. 297], [12, С. 1238]:
- Средняя частота возникновения ахалазии кардии 0,3-1,63 случаев на 100000 здорового взрослого населения в год.
- Риск развития рака пищевода выше от 8 до 50 раз при ахалазии кардии и оценивается как 3%.
- Коэффициент заболеваемости раком пищевода на фоне ахалазии кардии 0,34%. То есть на 10000 пациентов с диагнозом ахалазия кардии приходиться 34 человека, у которых можно ожидать возникновение плоскоклеточного рака пищевода.
Среди причин повышенного риска развития рака пищевода можно отметить две основные, которые непосредственно связаны друг с другом.
Во-первых, это хроническая интоксикация лактатами и нитрозаминами на фоне непроходимости пищевода и значительного накопления продуктов жизнедеятельности бактерий и грибов в его просвете [11, С. 298-299].
Во-вторых, имеющаяся непроходимость пищевода на фоне гипертонуса НПС усугубляется дисфункцией его тела, в связи с первичным поражением нервов Ауэрбахова сплетения, и развитием рубцовых и дегенеративных изменений в слизисто-подслизистом слое на фоне длительного перерастяжения стенки пищевода [12, С. 1238].
На данные вопросы теоретизации процессов патогенеза не помогают в решении некоторых важных практических вопросов в клинической медицине и даже наоборот – создают значительную путаницу.
Логично предположить, что с прогрессией стадии ахалазии кардии и с увеличением длительности анамнеза болезни, риск развития рака пищевода должен увеличиваться. Хотя, очевидным остается тот факт, что реализация рака пищевода не зависимо от его вероятности может произойти в любой отдельно взятой ситуации. В то же время, нет ни одного официально опубликованного исследования, проводящего соответствующую корреляцию.
Из прошлого вопроса логично следует и тот факт, что при эффективно выполненной кардиопластической операции риск рака пищевода должен становиться меньше, так как степень расширения пищевода уменьшается и пропульсивная функция пищевода улучшается, пусть даже в значительной степени реализуемая по закону Франка-Старлинга или под воздействием силы притяжения [1, С. 2238], [7, С. 856], [10, С. 1453].
Так, в одном недавно опубликованном исследовании было продемонстрировано, что частота возникновения плоскоклеточного рака была в 8 раз выше у пациентов с АК, которые не проходили никакого лечения, но в 4,5 раза выше у пациентов, прошедших сеансы пневматической дилятации, чем у пациентов, которые были прооперированы в объеме кардиомиотомии по Геллеру [5, С. 2151].
Справедливости ради нужно сказать, что единственным условием, при котором реализация хирургическим рисков, связанных с экстирпацией пищевода, правомочна – это диагностированный рак или последствия тяжелого химического ожога [1, С. 2241], [7, С. 856-857], [10, С. 1454].
Тогда как поступить с пациентом при подтвержденной его не толерантности к любому, более или менее, инвазивному методу лечения при ахалазии кардии IV стадии? Принимая теорию о том, что застой пищи ведет к развитию рака пищевода, тогда любое другое лечение должно также привести к сравнительно большему числу наблюдаемых случаев заболеваемости раком пищевода, которые к счастью не наблюдаются [5, С. 2151].
Существует и другое мнение на причины повышенного уровня заболеваемости раком пищевода при ахалазии кардии после выполнения кардиопластических операций [3, С. 856], [8, С. 2144]:
- Пропущенный изначально до операции рак пищевода I стадии. В этом случае хирург принимает псевдоахалазию, развивающуюся на фоне обструктивной опухолевой непроходимости пищевода, в качестве идиопатической АК и, соответственно, выполняет первично неадекватный объем операции;
- Недостаточное восстановление проходимости пищевода. Безусловно, изначально компрометированная работа пищевода исключительно чувствительна даже к малейшим изменениям анатомии и, как следствие, физиологии этого органа. В этой ситуации, изначально имевшийся застой в просвете пищевода не разрешается и патогенетический механизм возможного развития рака пищевода не разрывается. Из технических причин неудачи после выполнения кардиопластиечских операций можно выделить три основные ситуации. Во-первых, это недостаточное или некачественное выполнение кардиомиотомии. Во-вторых, развитие склеротических и рубцовых изменений в области миотомической раны в отдаленном послеоперационном периоде. В-третьих, формирование слишком "тугой" фундопликационной манжеты, что чаще бывает при выполнении полной фундопликации;
- Развитие тяжелого гастро-эзофагеального рефлюкса на фоне полного разрушения структуры нижнего пищеводного сфинктера и, как следствие, полного нивелирования его защитной функции. Эта ситуация становится аналогична развитию пищевода Барретта на фоне гастро-эзофагеального рефлюкса. Чаще всего данное осложнение возникает при недостаточно сформированной фундопликационной манжете, использовании баллонной дилятации и методики пероральной эндоскопической миотомии.
Также в приоритетности выбора операции экстирпации пищевода имеют значение следующие, менее официальные, но от того не менее важные обстоятельства [3, С. 856], [5, С. 2151], [7, С. 205-206], [8, С. 2146], [9, С. 22-23]:
- Как показывает мировая литература показания к экстирпации пищевода намного чаще выставляют в онкологических учреждениях, специализирующихся на выполнении данной операции при раках пищевода.
- Также отмечено, что среди всех хирургов занимающихся болезнями пищевода и желудка, экстирпацию, как метод лечения при ахалазии кардии IV стадии, чаще всего выбирают именно торакальные хирурги.
- И наконец, при анализе структуры причин у пациентов с раком пищевода, всегда, если имеется в анамнезе ахалазия кардии, она выносится на первое место, тогда как другие факторы риска уже не учитываются. Это обстоятельство искусственно повышает имеющийся риск развития рака пищевода при ахалазии кардии.
Подводя итоги всему вышесказанному, можно сделать следующие выводы.
- Относительный риск рака пищевода невысокий, абсолютный – минимален.
- Качественно выполненная кардиопластическая операция с неполной фундопликацией эффективно купирует явления дисфагии, в то же время успешно протектируя возникновение рефлюкс, и должна быть методикой выбора при ахалазии кардии независимо от стадии болезни.
- Экстирпация пищевода при ахалазии кардии имеет строго ограниченный диапазон использования и показана при многократной неэффективности кардиопластических операций и других вспомогательных методик и развития тяжелых осложнений.
Список литературы / References
- Agarwal A. K. Laparoscopic esophagogastroplasty: a minimally invasive alternative to esophagectomy in the surgical management of megaesophagus with axis deviation / A. K. Agarwal, A. Javed // Surgical Endoscopy. — 2013. — Vol. 27(6). — P. 2238-2242. doi: 10.1007/s00464-012-2751-0.
- Boeckxstaens G. E. Achalasia / G. E. Boeckxstaens, G. Zaninotto, J. E. Richter // The Lancet. — 2014. — Vol. 383(9911). — P. 83-93. doi: 10.1016/S0140-6736(13)60651-0.
- Devaney E. J. Esophagectomy for Achalasia: Patient Selection and Clinical Experience / E. J. Devaney, M. D. Lannettoni, M. B. Orringer et al. // The Annals of Thoracic Surgery. — 2001. — Vol. 72(3). — P. 854-858. doi: http://dx.doi.org/10.1016/S0003-4975(01)02890-9.
- Eckardt A. J. Current clinical approach to achalasia / A. J. Eckardt, V. F. Eckardt // World Journal of Gastroenterology. — 2009. — Vol. 15(32). — P. 3969-3975. doi: 10.3748/wjg.15.3969.
- Eckardt A. J. Editorial: Cancer surveillance in achalasia: better late than never? / A. J. Eckardt, V. F. Eckardt // The American Journal of Gastroenterology. — 2010. — Vol. 105(10). — P. 2150-2152. doi: 10.1038/ajg.2010.257.
- Hashimi S. Complications Following Surgery for Gastroesophageal Reflux Disease and Achalasia / Hashimi, R. M. Bremner // Thoracic Surgery Clinics. — 2015. — Vol. 25(4). — P. 485-498. doi: 10.1016/j.thorsurg.2015.07.010.
- Howard J. M. Oesophagectomy in the management of end-stage achalasiae Case reports and a review of the literature / J. M. Howard, L. Ryan, K. T. Lim et al. // International Journal of Surgery. — 2011. — Vol. 9(3). — P. 204-208. doi: 10.1016/j.ijsu.2010.11.010.
- Leeuwenburgh Long-term esophageal cancer risk in patients with primary achalasia: a prospective study / L. Leeuwenburgh, P. Scholten, J. Alderliesten et al. // The American Journal of Gastroenterology. — 2010. — Vol. 105(10). — P. 2144-2149. doi: 10.1038/ajg.2010.263.
- Molena D. Surgical Management of End-Stage Achalasia / D. Molena, S. C. Yang // Seminars in Thoracic and Cardiovascular Surgery. — 2012. — Vol. 24(1). — P. 19-26. doi: 10.1053/j.semtcvs.2012.01.015.
- Panda N. Laparoscopic Esophagogastroplasty in Management of Megaesophagus with Axis Deviation / N. Panda, N. K. Bansal, M. Narsimhan et al. // Indian Journal of Surgery. — 2015. — Vol. 77(3). — P. 1453-1455. doi: 10.1007/s12262-014-1193-4.
- Stefanidis D. SAGES guidelines for the surgical treatment of esophageal achalasia / D. Stefanidis, Richardson, T. M. Farrell et al. // Surgical Endoscopy. — 2012. — Vol. 26(2). — P. 296-311. doi: 10.1007/s00464-011-2017-2.
- Vaezi M. F. ACG clinical guideline: diagnosis and management of achalasia / M. F. Vaezi, J. E. Pandolfino, M. F. Vela // The American Journal of Gastroenterology. — 2013. — Vol. 108(8). — P. 1238-1249. doi: 10.1038/ajg.2013.196.
- Ивашкин В. Т. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению ахалазии кардии и кардиоспазма / В. Т. Ивашкин, А. С. Трухманов, Э. А. Годжелло и др. // Российский журнал Гастроэнтерологии, Гепатологии, Колопроктологии. — 2016. — №26(4). — С. 36-50.
Список литературы на английском языке / References in English
- Agarwal A. K. Laparoscopic esophagogastroplasty: a minimally invasive alternative to esophagectomy in the surgical management of megaesophagus with axis deviation / A. K. Agarwal, A. Javed // Surgical Endoscopy. — 2013. — Vol. 27(6). — P. 2238-2242. doi: 10.1007/s00464-012-2751-0.
- Boeckxstaens G. E. Achalasia / G. E. Boeckxstaens, G. Zaninotto, J. E. Richter // The Lancet. — 2014. — Vol. 383(9911). — P. 83-93. doi: 10.1016/S0140-6736(13)60651-0.
- Devaney E. J. Esophagectomy for Achalasia: Patient Selection and Clinical Experience / E. J. Devaney, M. D. Lannettoni, M. B. Orringer et al. // The Annals of Thoracic Surgery. — 2001. — Vol. 72(3). — P. 854-858. doi: http://dx.doi.org/10.1016/S0003-4975(01)02890-9.
- Eckardt A. J. Current clinical approach to achalasia / A. J. Eckardt, V. F. Eckardt // World Journal of Gastroenterology. — 2009. — Vol. 15(32). — P. 3969-3975. doi: 10.3748/wjg.15.3969.
- Eckardt A. J. Editorial: Cancer surveillance in achalasia: better late than never? / A. J. Eckardt, V. F. Eckardt // The American Journal of Gastroenterology. — 2010. — Vol. 105(10). — P. 2150-2152. doi: 10.1038/ajg.2010.257.
- Hashimi S. Complications Following Surgery for Gastroesophageal Reflux Disease and Achalasia / Hashimi, R. M. Bremner // Thoracic Surgery Clinics. — 2015. — Vol. 25(4). — P. 485-498. doi: 10.1016/j.thorsurg.2015.07.010.
- Howard J. M. Oesophagectomy in the management of end-stage achalasiae Case reports and a review of the literature / J. M. Howard, L. Ryan, K. T. Lim et al. // International Journal of Surgery. — 2011. — Vol. 9(3). — P. 204-208. doi: 10.1016/j.ijsu.2010.11.010.
- Leeuwenburgh Long-term esophageal cancer risk in patients with primary achalasia: a prospective study / L. Leeuwenburgh, P. Scholten, J. Alderliesten et al. // The American Journal of Gastroenterology. — 2010. — Vol. 105(10). — P. 2144-2149. doi: 10.1038/ajg.2010.263.
- Molena D. Surgical Management of End-Stage Achalasia / D. Molena, S. C. Yang // Seminars in Thoracic and Cardiovascular Surgery. — 2012. — Vol. 24(1). — P. 19-26. doi: 10.1053/j.semtcvs.2012.01.015.
- Panda N. Laparoscopic Esophagogastroplasty in Management of Megaesophagus with Axis Deviation / N. Panda, N. K. Bansal, M. Narsimhan et al. // Indian Journal of Surgery. — 2015. — Vol. 77(3). — P. 1453-1455. doi: 10.1007/s12262-014-1193-4.
- Stefanidis D. SAGES guidelines for the surgical treatment of esophageal achalasia / D. Stefanidis, Richardson, T. M. Farrell et al. // Surgical Endoscopy. — 2012. — Vol. 26(2). — P. 296-311. doi: 10.1007/s00464-011-2017-2.
- Vaezi M. F. ACG clinical guideline: diagnosis and management of achalasia / M. F. Vaezi, J. E. Pandolfino, M. F. Vela // The American Journal of Gastroenterology. — 2013. — Vol. 108(8). — P. 1238-1249. doi: 10.1038/ajg.2013.196.
- Ivashkin V. T. Rekomendacii Rossijskoj gastrojenterologicheskoj associacii po diagnostike i lecheniju ahalazii kardii i kardiospazma [Diagnostics and treatment of cardiac achalasia and cardiospasm: guidelines of the Russian gastroenterological association] / V. T. Ivashkin, A. S. Trukhmanov, E. A. Godzhello and others // Rossijskij zhurnal Gastrojenterologii, Gepatologii, Koloproktologii [Russian Journal of Gastroenterology, Hepatology, Coloproctology]. — 2016. — №26(4). — P. 36-50. [in Russian].
