КОНСТАНТЫ УСТОЙЧИВОСТИ КОМПЛЕКСОВ СУЛЬФОЭТИЛИРОВАННОГО ХИТОЗАНА С ИОНАМИ ЩЕЛОЧНОЗЕМЕЛЬНЫХ И ПЕРЕХОДНЫХ МЕТАЛЛОВ
КОНСТАНТЫ УСТОЙЧИВОСТИ КОМПЛЕКСОВ СУЛЬФОЭТИЛИРОВАННОГО ХИТОЗАНА С ИОНАМИ ЩЕЛОЧНОЗЕМЕЛЬНЫХ И ПЕРЕХОДНЫХ МЕТАЛЛОВ
Петрова Ю.С.¹, Неудачина Л.К.²
1, 2 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
Аннотация
Настоящая работа посвящена изучению протолитических и комплексообразующих свойств нового бифункционального полимера – N-2-сульфоэтилхитозана. Определены значения констант устойчивости исследуемого полимера с ионами щелочноземельных и переходных металлов.
Ключевые слова: N-2-сульфоэтилхитозан, потенциометрическое титрование, константы устойчивости.
Keywords: N-2-sulfoethylchitosan, potentiometric titration, stability constants.
Хитозан – линейный полисахарид, получаемый путем дезацетилирования хитина. Строение хитозана практически идентично строению целлюлозы, однако вместо гидроксильной группы у второго атома углерода пиранозного цикла он содержит аминогруппу, что обуславливает его комплексообразующие свойства по отношению к ионам металлов [1]. Наличие большого количества амино- и гидроксильных групп в составе хитозана в сочетании с высокой реакционной способностью создает широкие возможности для его модифицирования. Последующая сшивка функционализированных хитозанов позволяет получить сорбенты для разделения и концентрирования ионов металлов.
Перспективным видом функционализирования хитозана является его сульфоэтилирование. Предположительно, модифицирование хитозана сульфоэтильными группами приводит к увеличению емкости полимера (за счет образования структуры ионообменной смолы) и селективности комплексообразования (за счет появления возможности формирования хелатных комплексов). Настоящая работа посвящена исследованию кислотно-основных и комплексообразующих свойств сульфоэтилированного хитозана (СЭХ) со степенью замещения (СЗ) атомов водорода аминогруппы 0.3 с целью оценки перспектив его применения в качестве прекурсора для синтеза комплексообразующих сорбентов.
Синтез и идентификация исследуемого соединения описаны ранее [2]. Полимер со степенью модифицирования 0.3 получен методом полимераналогичных превращений в виде натриевой соли N-2-сульфоэтилхитозана. Состав и строение образца подтверждены методами элементного анализа и 1Н ЯМР-спектроскопии.
Исследование кислотно-основных свойств N-2-сульфоэтилхитозана с СЗ 0.3 проводили методом потенциометрического титрования растворов полимера в инертной атмосфере азота при ионной силе m 0.1 моль/дм3 KCl и 20±1°С, используя иономер И-160МИ, оснащенный стеклянным комбинированным электродом ЭСК-10601/7. Иономер калибровали по стандартным буферным растворам. В качестве титранта использовали 0.1 моль/дм3 раствор хлороводородной кислоты. Расчет значений показателей констант кислотной диссоциации функционально-аналитических групп (ФАГ) полимера проводили с использованием модифицированного уравнения Гендерсона-Гассельбаха [3].
Для оценки констант устойчивости исследуемого полимера с ионами металлов к раствору объемом 50.0 дм3, содержащему 0.0200 г N-2-сульфоэтилхитозана прибавляли количество раствора хлороводородной кислоты, эквивалентное общему количеству сульфо- и аминогрупп полимера. Ионную силу поддерживали равной 0.1 моль/дм3 KCl (KNO3). Исходя из предположения о возможности образования комплексов ионов металлов с функциональными группами полимеров состава 2:1 (ФАГ:ион металла), к полученному таким образом раствору добавляли 0.1 моль/дм3 раствор соли металла в количестве, в 2 раза меньшем, чем общее количество аминогрупп полимера. В качестве титранта использовали свободный от карбонатов раствор гидроксида калия. Для каждой серии растворов снимали не менее трех кривых титрования.
Для определения показателей констант устойчивости комплексов ФАГ N-2-сульфоэтилхитозана с ионами металлов состава 1:1 и 1:2 (b1 и b2 соответственно) метод Кальвина и Мельхиора. Данный метод описан в литературе применительно к комплексам ионов металлов как с мономерными [4], так и с полимерными [5] лигандами, и отличается экспрессностью и простотой.
На рис. 1.1 приведена кривая титрования СЭХ с СЗ 0.3, функциональные группы которого полностью протонированы, раствором гидроксида калия. Как видно из представленной зависимости, сульфо- и аминогруппы в составе полимера нельзя оттитровать раздельно. Аналогичная ситуация наблюдается при титровании исследуемого модифицированного хитозана раствором хлороводородной кислоты. В литературе [3] также отмечается, что идентификация кривых титрования полиамфолитов в протонированной и щелочной формах в большинстве случаев затруднена. Это связано с появлением положительных или отрицательных зарядов по цепи полимера, что весьма сильно изменяет константы кислотно-основной диссоциации ФАГ амфолита. Поэтому нами по уравнению Гендерсона-Гассельбаха [3] определен показатель кажущейся константы диссоциации ФАГ исследуемого полимера, отражающий совместное кислотно-основное поведение сульфо- и аминогрупп. Полученное значение составило 6.06.
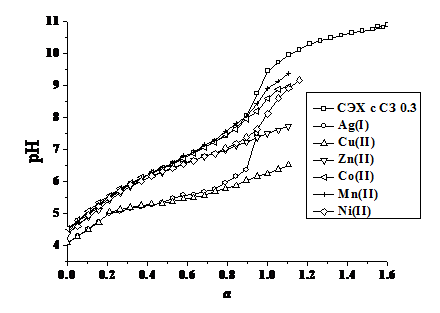
Рис. 1.1. Кривые рН-метрического титрования раствора СЭХ с СЗ 0.3 в отсутствии и присутствии ионов металлов. (m = 0.1 моль/дм3, KCl (KNO3), t=20±1°С).
Исследование комплексообразующих свойств модифицированного хитозана проводили методом потенциометрического титрования. На рис. 1.1 в качестве примера приведены кривые потенциометрического титрования раствора СЭХ с СЗ 0.3, а также его комплексов с ионами серебра (I), меди (II), цинка (II), кобальта (II), никеля (II) и марганца (II). Значения констант устойчивости комплексов исследуемого полимера с ионами металлов представлены в табл. 1.
Таблица 1. Константы устойчивости комплексов ионов металлов с N-2-сульфоэтилхитозаном с СЗ 0.3 (m = 0.1 моль/дм3, KCl (KNO3), t=20±1°С).
|
Ион металла |
Ag(I) |
Cu(II) |
Zn(II) |
Ni(II) |
Co(II) |
Mn(II) |
Cd(II) |
Pb(II) |
|
lgb1 |
3.9 |
3.8 |
2.9 |
2.5 |
2.2 |
1.9 |
2.6 |
2.9 |
|
lgb2 |
7.2 |
7.2 |
– |
– |
– |
– |
– |
– |
Установлено, что исследуемый хитозан не образует комплексных соединений с ионами щелочноземельных металлов, поскольку кривые титрования полимеров в отсутствии и в присутствии кальция (II), магния (II), бария (II) и стронция (II) совпадают. Наибольшей устойчивостью обладают комплексы исследуемых модифицированных полимеров с ионами меди (II) и серебра (I). Из рис. 1.1 и данных табл. 1 видно, что по устойчивости комплексов с N-2-сульфоэтилхитозаном ионы переходных металлов можно расположить в следующей последовательности: Mn(II)<Co(II)<Ni(II)<Cu(II)>Zn(II), что соответствует ряду Ирвинга-Вильямса [13].
Таким образом, исследуемый модифицированный хитозан является перспективными прекурсором для синтеза сорбентов, селективных по отношению к меди (II) и серебру (I).
Финансирование
Работа выполнена при поддержке конкурса на проведение научных исследований аспирантами, молодыми учеными и кандидатами наук УрФУ.
Список литературы / References
1. Пестов А.В., Ятлук Ю.Г. Карбоксиалкилированные производные хитина и хитозана. Екатеринбург: УрО РАН, 2007. 102 с.
2. Петрова Ю.С., Пестов А.В., Неудачина Л.К. Сорбционные свойства сшитых сульфоэтилированных хитозанов в аммиачно-ацетатном буферные растворе // Сборник научных трудов SWorld. Материалы международной научно-практической конференции «Перспективные инновации в науке, образовании, производстве и транспорте ‘2012». Одесса, 2012. Вып. 2. Т. 9. С. 64-67.
3. Салдадзе К.М., Копылова-Валова В.Д. Комплексообразующие иониты (комплекситы). М.: Химия, 1980. 336 с.
4. Инцеди Я. Применение комплексов в аналитической химии. М.: Мир, 1979. 376 с. 5. Acar N., Tulun T. // Eur. Polym. J. 2001. V. 37. № 8. P. 1599.
5. Acar N., Tulun T. // Eur. Polym. J. 2001. V. 37. № 8. P. 1599.
