ПОЛУЧЕНИЕ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ
Толькова Е.С.
Бакалавр, Нижегородский государственный технический университет им. Р.Е. Алексеева
ПОЛУЧЕНИЕ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ
Аннотация
В статье рассмотрено использование моноклональных антител в иммунотерапии и иммунодиагностике онкологических заболеваний и их производство с использованием гибридомной технологии, представлена технологическая схема и машинно-аппаратурная схема производства
Ключевые слова: моноклональные антитела, иммунотерапия, гибридомная технология
Tolkova E.S.
Undergraduate student, Nizhny Novgorod State Technical University n.a. R.E. Alekseev
PRODUCTION OF MONOCLONAL ANTIBODIES
Abstract
The article considers the use of monoclonal antibodies in immunotherapy and immunodiagnostics of oncological diseases and their production using hybridoma technolody with flow diagram and technological scheme of manufacturing process
Keywords: monoclonal antibodies, immunotherapy, hybridoma technology
Моноклональные антитела (МКА) – это иммуноглобулины, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону [1]. Их производство появилось относительно недавно: сообщение о разработке гибридомной технологии было опубликовано в 1975 году учеными Кёлером и Мильштейном, за что в 1984 году они получили Нобелевскую премию.
Создание иммунопрепаратов и диагностических тест-систем является одним из наиболее перспективных направлений разработки биотехнологических препаратов. Объем мирового рынка, предположительно, достигнет 60-80 млрд долларов к 2018 году. В России разработка и продажа препаратов моноклональных антител также является одним из быстрорастущих сегментов рынка. Однако в том, что касается этих препаратов, российский рынок до сих пор на 90% представлен импортными препаратами [4].
Препараты на основе МКА получили широкое распространение в иммунотерапии и иммунодиагностике злокачественных заболеваний. Уже сегодня без препаратов на основе МКА немыслима диагностика злокачественных заболеваний крови, определение иммунологического статуса пациентов, контроль за эффективностью лечения. Антитела, узнающие опухолеспецифичные антигены, могут использоваться для идентификации опухолевых клеток в различных образцах, включая образцы биопсии. С этой целью применяют метрологические методы, т.е. методы изучения антител и антигенов с помощью реакций антиген-антитело, определяемых в сыворотке крови и других жидкостях, а также тканях организма. Для диагностики онкологических заболеваний разработаны различные диагностикумы для количественного определения онкомаркеров: ПСА, СА 125, альфа-фетопротеина и многих других. Помимо этого антитела узнают раковые клетки in vivo и поэтому накапливаются в районе опухоли после введения в кровь больного раком. Таким образом, использование антител с присоединенной радиоактивной меткой также может использоваться для идентификации опухоли, и этот подход может также быть полезен для локализации опухолей радиографией [6].
Использование МКА для иммунотерапии злокачественных образований обусловлено высокой аффинностью антител, используемых в препаратах. Однако главным преимуществом препаратов на основе МКА является их низкая токсичность по сравнению с другими методами лечения. Так, например, при некоторых опухолях иммунотерапия препаратами МКА обладает несомненной эффективностью, сопоставимой с химиотерапией и значительно меньшей токсичностью [5]. Иммунотерапия онкологических заболевания с помощью МКА включает их использование в радиотерапии и в биотерапии.
МКА можно использовать для доставки радиоизотопов к опухолям для диагностической визуализации. Однако если использовать более мощные изотопы, такие как иттрий-90 и иод-131, то можно очень эффективно уничтожать опухолевые клетки. В этом случае, антитела, узнающие опухолеспецифические антигены, помогают концентрировать изотоп в месте локализации опухоли, максимально увеличивая смертоносный эффект для опухолевых клеток и минимизируя влияние на окружающие ткани. Этот подход известен как радиоиммуннотерапия (РИТ), он оказался очень успешным при лечении гематологических раков и в меньшей степени для лечения некоторых опухолей.
Недостаток обычной РИТ состоит в том, что влияние циркулирующих радиоактивных клеток часто приводит к повреждению костного мозга и стволовых клеток. Для преодоления этой проблемы было разработано несколько новых подходов, включающих предварительный выбор мишени. Например, трехступенчатый подход, использовавшийся при лечении рака яичников, заключается в следующем: на первой стадии в организм вводится антитело с присоединенным остатком биотина, узнающее опухолевый антиген. Затем вводится второй компонент, который выводит из системы кровообращения циркулирующие антитела. Наконец, вводится содержащий радиоизотоп стрептавидин, который доставляет высокую дозу радиоактивности непосредственно к раковой опухоли с минимальным уровнем вредя для других тканей. Этот подход основан на высоком сродстве биотина и стрептавидина, что позволяет целенаправленно и эффективно воздействовать на опухоль [5].
Биотерапия – новейшее направление в раковой терапии, использующее биологические агенты, такие как белки (включая антитела), пептиды, нуклеиновые кислоты, вирусы и целые клетки. Около 20% разрабатываемых в настоящее время фармацевтических препаратов – это антитела и их производные; многие из них предполагается использовать для лечения рака. МКА, которые узнают опухолевые антигены, запускают каскад комплемента и другие цитотоксические эффекторные механизмы, помогая тем самым разрушать раковые клетки и удалять их из организма. Более сложные производные антител включают иммунотоксины, у которых к антителу присоединен мощный токсин (например, рицин) и иммунные препараты, у которых к антителу присоединена малая молекула, например, антибиотик. Последняя категория иммуноконьюгатов, которые могут выступать в качестве противораковых агентов – абзимы – антитела, соединенные с ферментами. Использование таких молекул предполагается в случае ADEPT-терапии («антитело-направленный фермент/пролекарственной терапии»), при которой абзим превращает циркулирующее пролекарство (неактивное) в токсичное противоопухолевое лекарство [3, 5].
Традиционный метод производства МКА – это метод in vivo, представляющий собой введение мышам или крысам гибридомных клеток выбранного клона с последующим развитием опухолевых асцитов и отбором асцитной жидкости. Однако этот метод обладает рядом значительных недостатков. Во-первых, от мыши можно получить до 50 мг целевого продукта, что не удовлетворяет потребность в препаратах на основе моноклональных антител. Во-вторых, производство in vitro позволяет обеспечить контроль производства, стандартизацию, а также имеет важные преимущества над производством в условиях in vivo в отношении вирусной безопасности, постоянства производства и отсутствия контаминирующих иммуноглобулинов в неочищенных сборах. Другие преимущества этого метода производства заключаются в использовании культуральных сред без сыворотки, а также в значительном сокращении использования животных [1]. Исходя из этих соображений, способ производства in vitro является предпочтительным, и производство in vivo допускается только в определенных обстоятельствах и должно быть обосновано.
Существуют два подхода к культивированию животных клеток in vitro. Первый подход основан на иммобилизации и включении клеток в твердую матрицу. В качестве примера можно привести перфузию в пористые волокна, применение микрокапсул, агарозных микрошариков или керамических кассет. Второй подход включает культивирование клеток в гомогенной суспензии. Выбор одного из этих двух методов получения моноклональных антител в основном определяется требованиями производственного процесса.
Тем не менее, культивирование клеток в гомогенной суспензии имеет ряд преимуществ: это довольно простой и легкий в управлении метод. Он обладает высокой воспроизводимостью, а значит, высокими потенциальными возможностями для производства высококачественной продукции. Система получения моноклональных антител в гомогенной суспензии способна работать асептически в течение длительного времени, а также просто и эффективно масштабируется. Кроме того, при проведении процесса в суспензии за счет перемешивания достигается высокая гомогенность культуры.
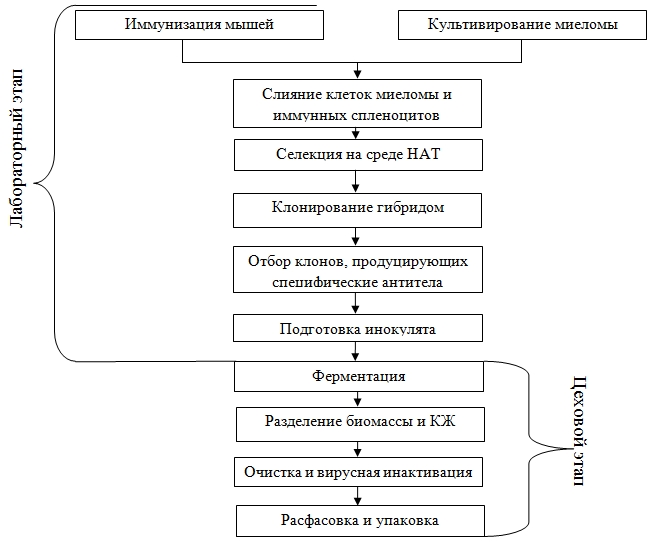
Технологическая схема производства моноклональных антител может быть представлена следующим образом:
Рис. 1 – Технологическая схема производства моноклональных антител
Она включает два этапа – лабораторный, результатом которого является подготовка инокулята, и цеховой, результатом которого является непосредственно получение готового продукта.
Процесс иммунизации проводится с целью формирования иммунного ответа и запуска выраженного антителообразования. Дополнительной задачей является перевод их в такое функциональное состояние, при котором они способны будут образовывать антителопродуцирующие гибридные клетки. Обычно для этого используют мышей или крыс, которых иммунизируют очищенными антигенами. Большое значение имеет то, насколько эффективно проходит процесс иммунизации. Его успех определяется рядом факторов, в том числе свойствами иммуногена, сочетанием с адъювантами, подбором оптимальной схемы иммунизации.
Параллельно с этим происходит культивирование миеломы. Клетки миеломы – это злокачественные трансформированные лимфоидные клетки костного мозга, которые способны синтезировать моноклональные антитела определенной специфичности и обладают способностью к неограниченному размножению in vivo и in vitro.
Плазмоцитомы обладают слабой способностью к росту вне организма. Для поддержания культуры клеток используются различные ростовые факторы, источником которых могут быть перитонеальные макрофаги, спленоциты или сыворотка крови мышей, иммунизированных полным адъювантом Фрейнда.
Гибридизацию лимфобластов и плазмоцитомы проводят путем клеточного слияния, опосредованного различными агентами, приводящими к изменению мембран клеток, формированию цитоплазматических контактов и формированию дикарионов. В качестве индуктора слияния клеток в современных работах используется полиэтиленгликоль (ПЭГ). Он вызывает перераспределение мембранных белков, обеспечивая контакт и слияние клеток за счет ионов кальция, приводящих к образованию кальциевых каналов между клетками. Более современный способ индукции слияния клеток состоит в использовании воздействия электрических импульсов, в результате чего получают несколько типов дикарионов.
Для отбора гибридных клеток используется среда НАТ, содержащая аминоптерин, а также гипоксантин и тимидин, опосредующие альтернативный путь синтеза ДНК. В результате селекции выживают только дикарионы, возникшие в результате слияния двух лимфобластов или лимфобласта и плазмоцитомы. Первые быстро погибают ввиду ограниченного пролиферативного потенциала, а целевые гибридные клетки выживают.
Обнаруженные гибридомные клоны должны быть немедленно реклонированы, т.к. после слияния во многих гибридах начинается «выброс» хромосом и в ходе этого некоторые клетки могут потерять хромосомы, несущие гены синтеза иммуноглобулинов. Существует несколько способов клонирования гибридом. При методе предельных разведений клетки отбирают из тех лунок, в которых обнаружены антитела нужной специфичности, ресуспендируют и затем разводят таким образом, чтобы при последующем разливе в каждую лунку планшета попала бы только одна клетка и формировался только один клон гибридом.
Следующим этапом является скрининг гибридов-продуцентов. Наиболее распространенными методами являются методы иммуноанализа на основе ферментных и флуоресцентных меток.
После отбора гибридомных клеток, синтезирующих интересующие антитела, приступают к их массовому наращиванию, результатом чего является подготовка инокулята.
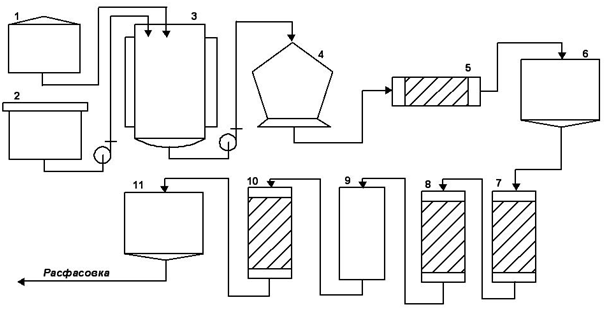
Рис. 2 – Машинно-аппаратурная схема производства
На рисунке представлена машинно-аппаратурная схема производства Методом масштабирования приготовляется инокулят в CO2-инкубаторе 1. Приготовляется и стерилизуется среда в стерилизаторе 2. Готовая и стерилизованная питательная среда и инокулят подаются в ферментер 3.
После процесса ферментации содержимое ферментера подается в центрифугу 4, где разделяются культуральная жидкость и биомасса. Предварительная очистка культуральной жидкости производится в фильтре 5, после чего культуральная жидкость поступает в емкость для хранения 6.
Из емкости для хранения культуральная жидкость поступает в колонну для аффинной хромотографии 7, а затем в колонну для ионно-обменной хромотографии 8. Затем жидкость стерилизуется в установке вирусной инактивации 9. Очистка от остаточных примесей осуществляется в колонне гель-фильтрации 10, после чего продукт поступает в емкость 11.
Накопление целевого продукта происходит в результате ферментации. Наиболее эффективным подходом является культивирование в гомогенной суспензии. Для культивирования могут использоваться бессывороточные среды, например, среда на основе RDF. Примером среды, включающей сыворотку, может быть RPМI 1640. Однако в современных работах чаще всего используются бессывороточные среды. При этом культивирование проводят при температуре около 37оС в присутствии СО2. Очень важно эффективное перемешивание, так как при культивировании необходимо равномерное распределение клеток по всему объему сосуда. Процесс ферментация аэробный, производится полунепрерывным способом с подпиткой при активной подаче воздуха.
При культивировании клеток целевой продукт секретируется в культуральную жидкость, поэтому необходимо удаление биомассы, это осуществляется в процессе центрифугирования. После отделения биомассы, культуральная жидкость фильтруется через мембранный фильтр с размером пор 0,2 мкм и временно помещается в хранилище для дальнейшей обработки. В процессе фильтрации осуществляется полное удаление оставшихся клеток, а также снижение объема жидкости с целью облегчения хромотографии. Может потребоваться несколько следующих друг за другом этапов фильтрации для достижения этих целей.
От области применения антител зависит необходимая степень очистки. Для диагностических целей достаточно иметь препараты антител 70 – 95% степени чистоты. С другой стороны, при применении антител в иммунотерапии их чистота должна быть выше. Очистка осуществляется в следующих друг за другом стадиях аффинной и ионно-обменной хроматографии. В качестве ионнообменника для выделения антител чаще всего используют диэтиламиноэтил, прикрепленный к целлюлозе, сефарозе или акриламидным гранулам. В аффинной хроматографии для очистки используют прикрепленные к носителю антигены.
Вирусная инактивация осуществляется с целью обеззараживания вирусов и бактерий, находящихся в культуральной жидкости.
Следующий этап производства имеет своей целью удаление оставшихся примесей и повышение объемной концентрации целевого продукта. Для этого применяется гель-фильтрация на колонках с агарозой, сефарозой или сефадексом.
Разработка иммунопрепаратов – активно развивающаяся область биотехнологии. В том, что касается разработки препаратов на основе моноклональных антител, наблюдается тенденция к уменьшению использования животных. Так, например, проводились работы по созданию генетически модифицированных бактерий на основе штамма E. coli, способных синтезировать моноклональные антитела [3]. Кроме этого, активно разрабатываются так называемых гуманизированные и химерные антител, которые больше напоминают человеческие иммуноглобулины и потому будут более безопасными в использовании.
Однако создание специфических антител, не вызывающих перекрестных реакций, представляет собой довольно трудную задачу, поскольку получение антител человека путем традиционной гибридомной технологии сталкивается с рядом проблем [2]:
- хромосомы человека в клетках, полученных слиянием лимфоцитов человека с клетками миеломы мыши, нестабильны;
- пока не удалось получить эффективные клеточные линии миеломы человека, которые могли бы заменить мышиные;
- иммунизация человека различными антигенами не проводится из этических соображений.
Таким образом, для получения антител, не вызывающих у человека развития иммунного ответа, было необходимо разрабатывать иные методы. Химерные, гуманизированные и одноцепочечные антитела были разработаны путем сочетания использования гибридомной технологии и технологии рекомбинантной ДНК [2, 5].
Химерные (также гибридные) антитела – это антитела, в которых домен мышиных иммуноглобулинов замещен соответствующим константным доменом иммуноглобулина человека. Они разрабатываются следующим образом: при помощи рекомбинантной технологии соединяются разнородные молекулы ДНК, кодирующие человеческий Fc-фрагмент и мышиный Fab-фрагменты антитела. Поскольку иммуногенные и эффекторные свойства антител определяются в основном его константным доменом, а специфичность взаимодействия с антигеном – вариабельным доменом, то химерные антитела вызывают значительно меньше осложнений при сохранении специфичности, аффинности и авидности, свойственных мышиным моноклональным антителам.
В структуре гуманизированных антител мышиное происхождение имеют только небольшие антигенсвязывающие гипервариабельные участки вариабельного домена. Таким образом, гуманизированные антитела содержат еще меньше чужеродного белка, и соответственно, вероятность иммунного отторжения организмом человека существенно снижается. Это в основном снимает проблему развития иммунного ответа на введение антител больному с терапевтическими или диагностическими целями.
Наряду с полноразмерными химерными и гуманизированными антителами, методами генной инженерии возможно получать так называемые одноцепочечные антитела, состоящие только из вариабельного фрагмента иммуноглобулина, т.е. из вариабельных доменов легких и тяжелых цепей иммуноглобулина, ковалентно связанных гибким пептидным линкером. Одноцепочечные антитела представляют собой минимальный фрагмент молекулы иммуноглобулина, который обладает хорошей антигенсвязывающей активностью.
Проводятся исследования по созданию в перспективе полностью человеческих рекомбинантных антител путем объединения вариабельных доменов антител человека, обладающих целевой активностью, с константными доменами иммуноглобулинов человека нужного изотипа. Главной стадией в создании полноразмерных человеческих антител является получение вариабельных доменов, отвечающих за специфичность антитела, его аффинность и биологические свойства [2].
Препараты на основе МКА получают все большее распространение в иммунодиагностике и, можно сказать, становятся незаменимыми в терапии злокачественных заболеваний, так как они являются эффективным средством терапии и обладают гораздо меньшей токсичности, чем другие формы терапии злокачественных заболеваний. Можно предположить, что разработка иммунопрепаратов на основе МКА будет продолжать активно развиваться, и объем мирового рынка будет расти.
Литература
- МР 3.3.2.2359-08 Медицинские иммунобиологические препараты. Организация производства и контроль качества моноклональных антител
- Алмагамбетов, К. Х. Биотехнология / К. Х. Алмагамбетов. – Астана. – 2011. – 270 с.
- Глик, Б. Молекулярная биотехнология. Принципы и применение. Пер. с англ. / Б. Глик., Дж. Пастернак. – М.: Мир. – 2002. – 589 с.
- Обзор рынка биотехнологий в России и оценка перспектив его развития [Электронный ресурс] URL: http://www.rusventure.ru/ru/programm/analytics/docs/20141020_Russia%20Biotechnology%20Market_fin.pdf (дата обращения 28.06.2015)
- Примроуз, С. Геномика. Роль в медицине / С. Примроуз, Р. Тваймен ; пер. с англ. – М.: БИНОМ. Лаборатория знаний. – 2008. – 277 с.
- Черенков, В. Г. Клиническая онкология: учеб. пособие / В. Г. Черенкв. – 3-е изд., испр. и доп. – М.: МК. – 2010. – 434 с.
References
- MR 3.3.2.2359-08 Medicinskie immunobiologicheskie preparaty. Organizacija proizvodstva i kontrol' kachestva monoklonal'nyh antitel
- Almagambetov, K. H. Biotehnologija / K. H. Almagambetov. – Astana. – 2011. – 270 s.
- Glik, B. Molekuljarnaja biotehnologija. Principy i primenenie. Per. s angl. / B. Glik., Dzh. Pasternak. – M.: Mir. – 2002. – 589 s.
- Obzor rynka biotehnologij v Rossii i ocenka perspektiv ego razvitija [Jelektronnyj resurs] URL: http://www.rusventure.ru/ru/programm/analytics/docs/20141020_Russia%20Biotechnology%20Market_fin.pdf (data obrashhenija 28.06.2015)
- Primrouz, S. Genomika. Rol' v medicine / S. Primrouz, R. Tvajmen ; per. s angl. – M.: BINOM. Laboratorija znanij. – 2008. – 277 s.
- Cherenkov, V. G. Klinicheskaja onkologija: ucheb. posobie / V. G. Cherenkv. – 3-e izd., ispr. i dop. – M.: MK. – 2010. – 434 s.