КУЛЬТИВИРОВАНИЕ И ИЗУЧЕНИЕ МОРФОЛОГИЧЕСКИХ И БИОХИМИЧЕСКИХ ОСОБЕННОСТЕЙ СВЕТЯЩИХСЯ БАКТЕРИЙ
Цветкова Ю.Д.1, Воропаева Д.И. 1, Поворова О.В. 2
1Студент, Могилевский государственный университет им. А.А. Кулешова
2Старший преподаватель, Могилевский государственный университет им. А.А. Кулешова
КУЛЬТИВИРОВАНИЕ И ИЗУЧЕНИЕ МОРФОЛОГИЧЕСКИХ И БИОХИМИЧЕСКИХ ОСОБЕННОСТЕЙ СВЕТЯЩИХСЯ БАКТЕРИЙ
Аннотация
Предложены среды для роста и люминесценции бактерий. Определена способность выделенных микроорганизмов к консолидации в швермеры. Показаны особенности культивирования светящихся бактерий, синтезирующих хитиназу. При использовании культуры светящихся бактерий (наносили бактериальную смесь на крылья, добавляли при кормлении) отмечено истончение крыльев, стенок кишечника и быстрая гибель тараканов Blaberus craniifer.
Ключевые слова: биолюминесценция, бактерии, швермер, хитиназа.
Tsviatkova Y.D.1, Voropaeva D.I.1 , Povorova O.V.2
1Student, Mogilev state A. Kuleshov university ,
2Senior teacher, Mogilev state A. Kuleshov university
CULTIVATION AND STUDY OF MORPHOLOGICAL AND BIOCHEMICAL FEATURES OF THE LUMINESCENT BACTERIAS
Abstract
In the submitted article is given the proffer of the medium for bacterial growth and luminescence. Defined the ability of cultivated microorganisms to consolidate into swarmers. Displayed the features in cultivation of the luminiscent bacterias (which produce chitinase). By applying of the bacterial culture (the bacterial compound was platted on the wings, and added as nutrition ) was noted the thinning of the wings , intestine structure and fast death of the cockroach Blaberus craniifer.
Keywords: bioluminescence, bacterias, swarmer, chitinase.
Светящиеся бактерии использовались ранее как чувствительные индикаторы для выявления фотосинтетического образования кислорода у водорослей. Их используют в неизбирательных экспресс-тестах на общую токсичность, т.к. система люциферазы очень чувствительна к различным загрязнениям; в биоинженерии в качестве репортерных генов используют гены lux-оперона, кодирующие люциферазу [1, с. 165]. Синтезируемые ими полигидроксиалканоаты рассматриваются как перспективный для использования вариант пластика, подверженный биодеградации, в качестве альтернативы современным термопластикам [2, с. 229]. Нас они заинтересовали как естественный объект, синтезирующий хитиназу [3].
Рост и биолюминесценция бактерий зависят от состава среды. Свечение наблюдается только в присутствии кислорода. Грамотрицательные, факультативные анаэробы, имеют жгутики, галофилы, склонны к психрофилии, как свободноживущие в воде и почве [1, с. 166], так и симбионты морских животных.
При культивировании бактерий из замороженных морских организмов – салаки, сельди, скумбрии, кальмаров – не обнаружено свечения. Выделили микроорганизмы, способные к биолюминесценции, только из охлажденной норвежской семги (использовались соскобы с брюшины и голова). Рыбу замачивали в 3% р-ре NaCl в темноте в течении 2 суток при комнатной температуре, +5°С, +7°С, +35°С. 0,5 мл культуральной жидкости вносили на универсальную среду (далее как среда А) для галофиллов светло-желтого цвета: дистиллированная вода - 150мл, пептон - 5,2 гр, агар-агар – 8 гр, NaCl – 4 гр, глицерин - 0,2 гр, KH2PO4 - 0,2 гр. Культивировали 48 ч. в темноте при четырех температурных режимах – комнатной температуре, +5°С, +7°С, +35°С. Свечения не было. Через 2 суток пересеяли на среды В и С, на которых свечение отмечено только при культивировании в условиях темноты при +5°С, +7°С. Среда В светло-янтарная, прозрачная: H20 - 150мл, мясо-пептонный бульон – 15 мл, агар-агар – 8 гр, глицерин - 0,2 гр, NaCl – 4 гр, KH2PO4 - 0,2 гр, дрожжевой автолизат - 0,4 гр. Среда С белая, прозрачная: H2O – 150 мл, агар-агар - 8 гр, рыбная вытяжка -15 мл, NaCl – 4 гр, глицерин - 0,2 гр, KH2PO4 - 0,2 гр, дрожжевой автолизат - 0,4 мл.
Со сред В и С переносили микроорганизмы на белую прозрачную среду D: H20 - 150 мл, рыбная вытяжка - 7 мл, мясо - пептонный бульон - 7 мл, агар-агар - 8 гр, NaCl - 4 гр, глицерин - 0,2 гр, KH2PO4 - 0,2 гр, дрожжевой автолизат - 0,4 мл. Чашки со средами В, С, D светились 3 – 5 дней, с преимущественной интенсивностью свечения на среде С.
Со среды D бактерии пересевали на среды E и F. Среда E белая, прозрачная: H20 - 150 мл, рыбная вытяжка - 4 мл, мясо - пептонный бульон - 4 мл, агар-агар - 8 гр, NaCl – 4 гр, NaNO3 - 1гр, CaCl2 - 0,1 гр, KCl - 0,2 гр, MgSO4 - 0,5 гр, KH2PO4 - 0,5 гр, NaHCO3 - 0,01 гр, глицерин - 0,2 гр. Скорость роста колоний на данной среде выше, свечение средней силы у половины чашек Петри, но более длительное по сравнению с предыдущими средами. На среде F (добавление 1 гр сухой вытяжки из водорослей к среде E) свечения не было.
Свечение зеленого цвета отмечено только у бактерий, культивируемых при +5°С, +7°С, поэтому далее использовали температурный режим +7°С. Со сред B, C, D, E бактериальные культуры переносили на среду G: H20 -150 мл, рыбная вытяжка - 4 мл, молочная сыворотка - 4 мл, агар-агар - 8 гр, NaCl - 4 гр, NaNO3 - 1 гр, CaCl2 - 0,1 мл, KCl - 0,2 гр, MgSO4 - 0,5 гр, KH2PO4 - 0,5 гр, NaHCO3 - 0,01гр, глицерин - 0,2 гр. Культивирование в темноте в течение 24 часов давало свечение наибольшей интенсивности и длительности (14 – 60 суток).
При многократном пересеве микроорганизмов и попытке получения чистой культуры бактерий свечение прекращалось. Со всех чашек, на которых прекращалось свечение, 3% р-ром NaCl смывали культуры и хранили смесь в колбах. При внесении 0,5 мл объединенной бактериальной смеси на среду G отмечено свечение максимальной силы.
При использовании данных бактерий в качестве источника освещения затемненных помещений изучали дополнительные факторы роста. Свечение прекращалось при добавлении в среду G мела, соли (до 10 гр соли/150 мл - нет свечения, 12-16 гр соли/150 мл – нет роста); при использовании жидкой среды с недостатком питательных веществ (норма на 250 мл: 25 мл мясо -пептонного бульона, 6 мл рыбной вытяжки, 6 мл сыворотки, с низким содержанием питательных веществ: 10 мл мясо - пептонного бульона, 3мл рыбной вытяжки, 3мл сыворотки). Для наглядной демонстрации свойств биолюминесценции бактерий культуру в жидкой среде был использован следующий метод.
При посеве колоний с твердых сред В, C, D, E, G в жидкую питательную среду (аналог среды G) люминесценции не наблюдалось. Данную среду и образовавшуюся на ней бактериальную смесь помещали в химический поглотитель и продували в течении 20 минут. Далее смесь помещалась в стерильную пипетку. При повороте пипетки и прохождении пузырька воздуха в жидкости было зафиксировано слабое и непродолжительное свечение.
Для выявления способности светящихся бактерий к консолидации в швермеры использовался нативный препарат-раздавленная капля, микроскоп PZO warszawa SK14 27115, объектив 40/0,65 (160/0,17), ультрафиолетовая лампа Feron ELSM512B - Color. Снимки сделаны на 8-мегапиксельную камеру с разрешением 640x480. Временной промежуток между снимками составил 20 мин.
Съемка проводилась в темном помещении, одним из условий было максимальное снижение вибраций, которые могли негативно повлиять на результаты эксперимента.
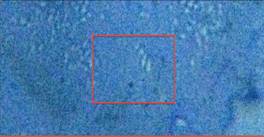
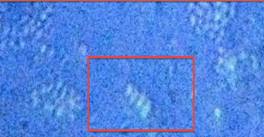
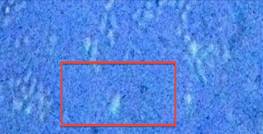
Как видно из предоставленных снимков (рис. 1.1) через каждые 20 - 30 минут наблюдается цикл взаимопревращения вегетативных клеток и клеток-швермеров (наиболее активный участок выделен квадратом).
 |
 |
 |
 |
Рис. 1.1 — Цикл взаимопревращения вегетативных клеток и клеток-швермеров.
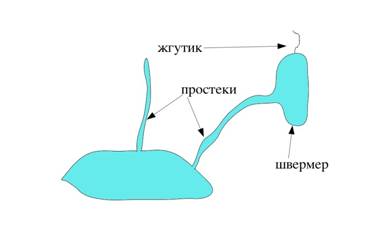
На рисунке 1.2 представлена стадия формирования мигрирующего швермера.
 |
 |
Рис. 1.2 Стадия формирования мигрирующего швермера
А - собственное фото( микроскоп AXIO IMAGEP A1 (Германия), камера — AXIOCAM-mRc5); Б - [2, c. 105].
Выделенные микроорганизмы свечения были идентифицированны как Alteromonas hanedai, Photobacterium phosphoreum, Vibrio logei, обладающие способностью синтезировать хитиназу.
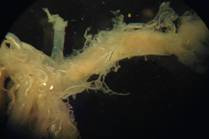
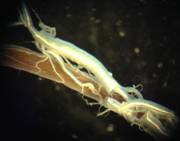
Смесь данных бактерий наносилась на хитинизированную первую пару крыльев тараканов Blaberus craniifer. Как видно из рисунка 1.3 через неделю отмечено общее истончение покровов и изменение структуры. Использование в пищу тараканами светящихся бактерий вызывало гибель беспозвоночных животных в течение 1,5 – 2 суток, при этом отмечено увеличение объема кишечника, уменьшение эластичности стенок кишечника и их обесцвечивание.
 А А |
 Б Б |
 В В |
Рис 1.3 - Изменение кутикулярных покровов крыльев и кишечника тараканов Blaberus craniifer под действием светящихся бактерий
А – надкрылья таракана (сверху – живого, справа – мертвого, снизу – мертвого, обработанного бактериями), Б – кишечник таракана – контроль, В – кишечник таракана, в питании которого были бактерии, синтезирующие хитиназу.
Список литературы
Нетрусов А.И. Микробиология: учебник для студентов высшего профессионального образования / А.И. Нетрусов, И.Б. Котова - М.: Академия, 2012. - 384c.
Ермилова Е.В. Молекулярные аспекты адаптации прокариот / Е.В. Ермилова; под ред. Кирюкова Ю.С. - СПб.: СПбУ, 2007. - 299c.
Бабенко А.Ю. Исследованите экзогенного препарата хитиназы высокой активности, продуцируемой Vibrio sp. X / А. Ю. Бабенко, Е.Ю. Дмитриева, В.Н. Шелегедин // Биотехнология. – 1999. - № 3. - С. 31–38.
