ВЛИЯНИЕ О-ФТОРФЕНИЛБИГУАНИДИНА НА КИНЕТИКУ РЕАКЦИИ ВЫДЕЛЕНИЯ ВОДОРОДА НА ЖЕЛЕЗЕ В КИСЛЫХ ХЛОРИДНЫХ СРЕДАХ
Балыбин Д.В.1, Кузина О.Ю.2, Вигдорович В.И.3, Попова Е.Д.4
1 Кандидат химических наук, старший преподаватель кафедры аналитической и неорганической химии,; 2 Магистрант 1 года обучения направления подготовки «Электрохимия»; 3 Доктор химических наук, профессор кафедры «Химия наноматериалов»; 4Студентка 3 курса специальности «химия», ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина
ВЛИЯНИЕ О-ФТОРФЕНИЛБИГУАНИДИНА НА КИНЕТИКУ РЕАКЦИИ ВЫДЕЛЕНИЯ ВОДОРОДА НА ЖЕЛЕЗЕ В КИСЛЫХ ХЛОРИДНЫХ СРЕДАХ
Аннотация
Показано, что в присутствии и возрастании концентрации о-фторфенилбигуанидина (0,5 – 40 мМ) в солянокислых водных средах наблюдается изменение природы замедленной стадии реакции выделения водорода на железе согласно ряда:
замедленный разряд → лимитирующая химическая рекомбинация → замедленная латеральная диффузия → лимитирующий разряд.
Ключевые слова: железо, ионы водорода, разряд, о-фторфенилбигуанидин, замедленная стадия.
Balybin D. V.1, Kuzina O. Y.2, Vigdorovich V. I.3, Popova E. D.4
1 Candidate of chemical sciences, assistant professor of analytical and inorganic chemistry department,; 2 Graduate student one year of study direction "Electrochemistry"; 3 Doctor of chemical sciences, professor, professor of “Chemistry of nanomaterials” department,; 4 Student of speciality «Chemistry», Tambov State University named after G.R. Derzhavin
INFLUENCE OF O-FLUOROPHENYLBIGUANIDINE ON HYDROGEN EVOLUTION REACTION KINETICS ON IRON IN ACIDIC CHLORIDE MEDIA
Abstract
It is shown that in the presence of increcesing o-fluorophenylbiguanidine concentrations (0,5 – 40 mM) in the hydrogen chloride aqueous media, change of rate determining stage nature of hydrogen evolution reaction on iron is observed according to the row: slow discharge – limiting chemical recombination – slow surface diffusion – limiting discharge.
Keywords: iron, hydrogen ions, discharge, o-fluorophenylbiguanidine, slow stage.
Введение
Реакция катодного выделения водорода (РВВ) – одна из наиболее изученных, обобщённых и вместе с тем изучаемых в настоящее время, так как она во многом является определяющей для интерпретации закономерностей электрохимической кинетики. Одновременно трудно переоценить ее роль и при решении прикладных вопросов, в частности, защиты металлов от коррозии и проблем водородной энергетики, связанных с получением электролитического водорода и его аккумулированием. Таким образом, в прикладном плане в одних условиях РВВ целесообразно стимулировать, в других – подавлять. Существуют работы, посвященные РВВ в различных условиях на различных материалах, но, зачастую, мнения авторов о лимитирующей стадии РВВ, выявив которую возможно будет управлять этим процессом, расходятся.
В связи с этим целью настоящей работы явилось изучение связи кинетики реакции выделения водорода на железе при различной кислотности и концентрации о-фторфенилбигуанидина (о-ФФБГ) в водных и водно-органических кислых хлоридных средах с процессом твердофазной диффузии водорода через стальную (Ст3) мембрану.
Методика эксперимента
Изучена добавка о-фторфенилбигуанидина (Б), который является аналогом гуанидина (А) сильного однокислотного бескислородного органического основания с рКа протонированной формы, иона гуанидиния, по одним данным равным в воде 13,6 [1]; по другим -11 [1].
Исследования проведены в водных и водно-органических(10 масс. % воды в этиленгликоле) растворах с составом электролита х М НСl+ (1 – х) М LiCl, полученных насыщением исходных растворителей сухим хлористым водородом с последующим разбавлением ими полученной системы до заданной кислотности и введением высушенного при 107°С хлорида лития. Кинетику РВВ исследовали на Ст3 в условиях потенциодинамической поляризации (потенциостат - Solartron 1285, скорость развертки 0,66 мВ/с), водородная атмосфера, комнатная температура, потенциалы пересчитаны по стандартной водородной шкале. Электрохимические измерения проведены в двух экспериментальных сериях: в одной использован насыщенный водный хлоридсеребряный электрод сравнения, во второй – равновесный водородный электрод в том же рабочем растворе. Рабочий электрод с видимой поверхностью 0,5 см2 армировали в оправу из эпоксидной смолы, отвержденной полиэтиленполиамином, перед экспериментом шлифовали и полировали, затем обезжиривали ацетоном. Использована трехэлектродная электрохимическая ячейка с разделенным шлифом анодным и катодным пространствами, вспомогательный электрод - гладкая платина.
Экспериментальные результаты и их обсуждение
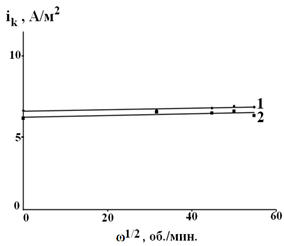
Рис. 1. Зависимость катодного тока от скорости вращения стального электрода в условиях катодной поляризации ΔЕК = -50 мВ, τвыдержки = 300 сек. 1 – 0,1 М НСl + 0,9 М LiCl – фон; 2 – фон +1 мМ о-ФФБГ.
Из рисунка 1 видно, что катодный ток не является функцией скорости вращения дискового электрода, из этого следует, что при поляризации на величину -50 мВ наблюдается кинетический контроль скорости катодной реакции.
Таблица 1
Кинетические параметры РВВ на железе в присутствии о-ФФБГ в водных кислых хлоридных растворах с составом электролита х М НC1 + (1 - x) M LiC1 (водородная атмосфера, комнатная температура).
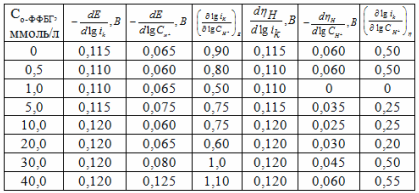
При введении минимального количества добавки о-ФФБГ в водный растворитель лимитирующей стадией является замедленный разряд, как и в фоновых растворах (таблица 1). Увеличение концентрации о-ФФБГ до
1 ммоль/л приводит к смене лимитирующей стадии с замедленного разряда на замедленную рекомбинацию (таблица 1). При 5, 10 (таблица 1) и 20 ммоль/л о-ФФБГ реализуется замедленная латеральная диффузия, а при 30 и
40 ммоль/л о-ФФБГ вновь лимитирует реакция разряда (таблица 1). Во всем концентрационном интервале о-ФФБГ наблюдается следующая смена природы лимитирующей стадии: разряд → рекомбинация → поверхностная диффузия → разряд [2 - 7].
Таблица 2
Кинетические параметры РВВ на железе в присутствии о-ФФБГ в водно-этиленгликолевых растворах, содержащих 10 масс % воды.
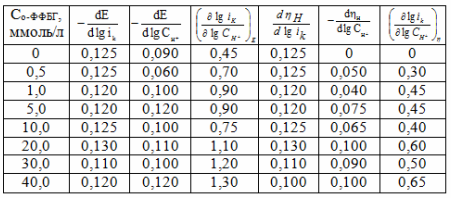
Интересным для изучения является связь кинетики РВВ на железе с его твердофазной диффузией через стальную мембрану в тех же системах. Исследования проведены по общепринятой методике [8].
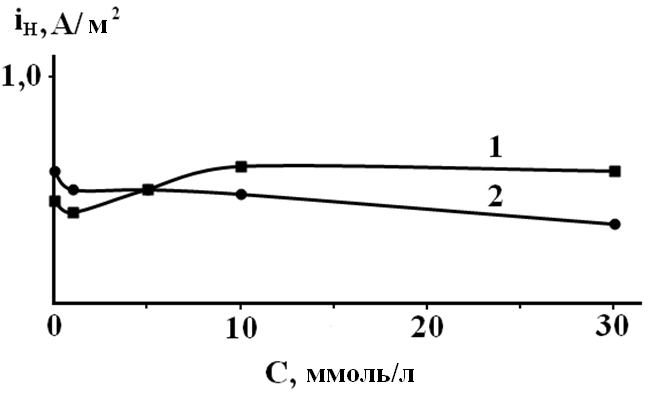
Рис. 2. Закономерности твердофазной диффузии водорода через стальную мембрану из растворов системы Н2О – HCl от концентрации о-ФФБГ (1-0,99М НС1; 2-0,05М НС1).
Можно было ожидать принципиальных изменений кинетических закономерностей в условиях различной природы замедленной стадии, наличие изломов или перегибов на соответствующих кривых в координатах iH, Со-ФФБГ. Однако, оказалось, что скорость диффузии водорода через мембрану iH практически не зависит от этого фактора (рис. 2).
Список литературы
Альберт А., Сержент А.Е.. Константы ионизации кислот и оснований. // М.: Химия. 1964. – 179 с.
Фрумкин А.Н. Перенапряжение водорода. М.: Наука. 1988. – 240 с.
Балыбин Д.В. Влияние гуанидина и фенилбигуанидина на кинетику реакции выделения водорода на железе и его диффузию через стальную мембрану в этиленгликолевых растворах НС1 // Автореф. дисс…канд. хим. наук. Тамбов. 2011. – 20 с.
Вигдорович В.И., Цыганкова Л.Е., Балыбин Д.В., Кузина О.Ю., Крыльский Д.В. Влияние о-фторфенилбигуанидина на кинетику реакции выделения водорода на железе и его диффузию через стальную мембрану в водных растворах НС1 // Наукоёмкие технологии. 2012. Т. 12. № 11, С. 52 – 58.
Балыбин Д.В., Кузина О.Ю., Цыганкова Л.Е., Вигдорович В.И. Влияние м-нитрофенилбигуанидина на кинетику реакции выделения водорода на железе и его диффузию через стальную мембрану в кислых хлоридных средах // Вестник ТГУ. Серия: Естественные и технические науки. 2013. Т. 18. № 1. С. 375 – 380.
Vigdorovich V.I., Tsygankova L.E., Balybin D.V., Kichigin V.I. Influence of o-fluorophenylbiguanidine on the kinetics of hydrogen evolution reaction on iron, the nature of rate-determining step and hydrogen diffusion through a steel membrane// Journal of Electroanalytical Chemistry. 2013. V. 689. №1. P. 117 – 123.
Vigdorovich V.I., Tsygankova L.E., Balybin D.V. Influence of guanidine on kinetics of hydrogen evolution reaction on iron and its diffusion through steel membrane in acidic chloride media // Journal of Electroanalytical Chemistry. 2011. V. 653. №1. P. 1 – 6.
Кардаш Н.В., Батраков В.В. Влияние состава раствора на диффузию водорода через металлическую мембрану. // Защита металлов. 1995. Т. 31. № 4. С. 441 – 444.
